基于全基因组表达谱芯片数据集对结肠癌肝转移可能机制的初步研究
刘正乾,廖锡文,王向坤,周鑫,杨成昆,刘峻奇,朱广志,彭涛
广西医科大学第一附属医院肝胆外科 广西南宁 530021
根据2018 年全球癌症统计数据显示,结直肠癌(colorectal cancer,CRC)全球新发病例数接近110万人,死亡病例55 万人,约占所有恶性肿瘤新发病例数和死亡人数的6%,在恶性肿瘤中发病率位列第三,死亡率位列第二[1]。60%以上的CRC 发生在结肠[2],其中,约有30%的结肠癌患者伴有肠外器官转移,在所有伴发转移癌的患者中,最常见的转移部位发生在肝脏,约占70%,男性的发生概率高于女性[3]。肝转移是导致结肠癌患者死亡的最主要原因,合并远处转移的晚期患者,5 年生存率仅有10%~20%[4]。因此,阐明结肠癌肝转移的相关机制,并依此发现其潜在的治疗靶点,是目前亟待解决的问题之一。以往的多项研究提示了结肠癌发生肝转移的几种潜在机制[5-8],包括:IL-33重塑肿瘤微环境,激活内皮细胞促进肿瘤血管生成;LKB1 激活AMPK、负调控AKT 信号通路和调节基因表达;MEGF6诱导EMT 促进大肠癌细胞生长,抑制细胞凋亡;Arp2 和WAVE2的共定位等。但目前基于全基因组对于此机制较为系统的研究仍然较少,本研究基于对GEO 数据库中结肠癌肝转移患者的结肠原发癌组织、结肠癌旁正常组织和肝转移灶组织的全基因组表达谱芯片数据集进行基因富集分析(gene set enrichment analysis,GSEA)分析,探索结肠癌肝转移的相关机制,现报告如下。
1 资料和方法
1.1 伦理认可
本研究使用Gene Expression Omnibus (GEO)数据库中的结肠癌肝转移的所有数据现在都可以在出版物或者演示文稿中不受限地使用。本研究中包含的各基因组表达谱芯片数据集均下载于GEO 公共数据库,而非作者通过对人类参与者或动物所做的任何试验研究获得,因此不需要额外的伦理委员会批准。
1.2 数据集下载和预处理
结肠癌肝转移的基因组表达谱芯片数据集从GEO下载(https://www.ncbi.nlm.nih.gov/geo/;访问日期:2019年12月27日)检索式为Gene expression analysis of liver and colon cancer primary tumors and metastasis,选择其中GSE92914数据集(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE92914)。GSE92914数据集包括结肠原发癌组织、结肠癌旁正常组织和肝转移灶组织共9组全基因组表达谱芯片数据集。
1.3 GSEA分析
以结肠癌合并肝转移患者的结肠原发癌组织、结肠癌旁正常组织和肝转移灶组织作为分组变量,使用GSEA-4.0.2 版本分析结肠原发癌组织、结肠癌旁正常组织和肝转移灶组织全基因组的基因表达变化对于各种生物学功能和通路的影响。本研究使用来自分子特征数据库(molecular signatures database,MSigDB) 的“c5: gene ontology (GO) gene sets(c5.all.v7.0.symbols.gmt)”作为参照基因集进行GSEA 富集分析。Number of permutations 设置为重复1 000次[9-10]。
1.4 统计学分析
GSEA 富集分析会根据Benjamini-Hochberg 程序校正错误发现率(false discovery rate,FDR)[11]。|NES|>1、Norminal-P<0.01 和FDR<0.25 的富集结果被认为差异有统计学意义。
2 结果
本研究从GEO 数据库GSE92914 数据集中获得3例结肠癌合并肝转移患者的3 个结肠原发癌组织标本、3个结肠癌旁正常组织标本和3个肝转移灶组织标本的全基因组RNA测序数据集,一共获得3 404个编码基因。
在以c5 为参照基因集的GSEA 分析中,对比结肠原发癌组织和结肠癌旁正常组织,发现在患者的结肠原发癌组织中可以显著富集到激素代谢过程、T细胞增殖的正调控和NF-κB 转录因子活性的正调控等生物学功能表现。见图1。
对比肝转移灶组织和结肠癌旁正常组织,发现在患者的肝转移灶组织中可以显著富集到泛素依赖蛋白分解代谢过程的正调控、去磷酸化调节和磷酸酶活性的调节等生物学功能表现。见图2。
对比结肠原发癌组织和肝转移灶组织,发现在患者的肝转移灶组织中可以显著富集到淋巴细胞分化、白细胞分化和电子传递活性等生物学功能表现。见图3。

图1 结肠原发癌组织和结肠癌旁正常组织以c5参考基因集的GSEA富集分析
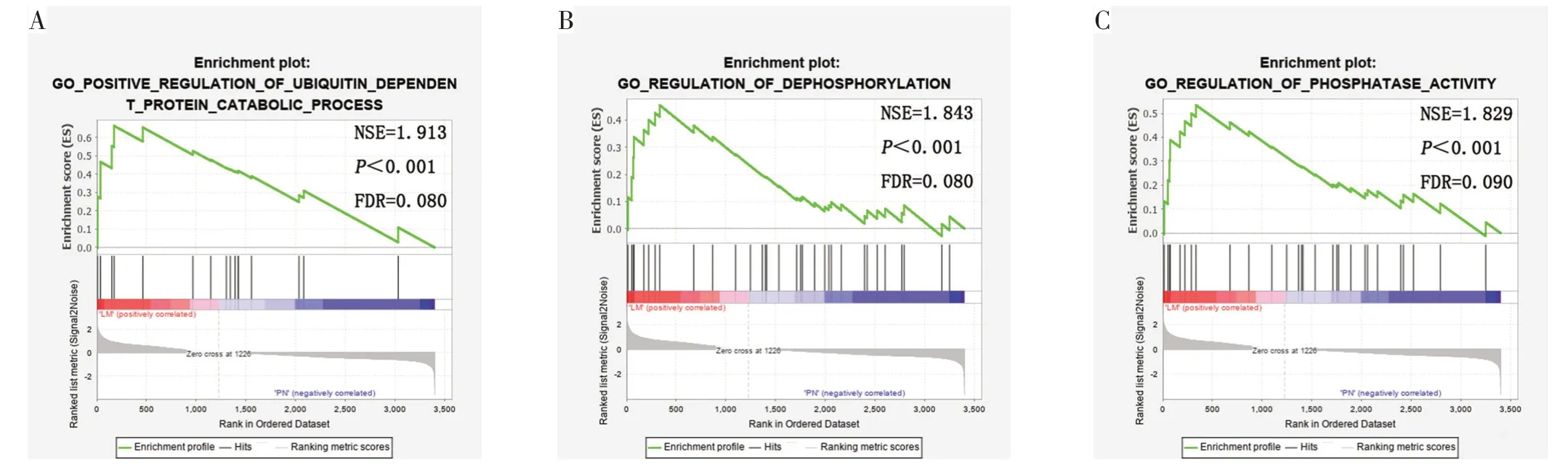
图2 肝转移灶组织和结肠癌旁正常组织以c5参考基因集的GSEA富集分析

图3 结肠原发癌组织和肝转移灶组织以c5参考基因集的GSEA富集分析
3 讨论
本研究通过对GEO数据库GSE92914全基因组表达谱芯片数据集进行GSEA富集分析,发现结肠发生癌变的机制及其后发生肝转移的机制可能分别与机体不同的生物学功能有关。在结肠原发癌组织和结肠癌旁正常组织的分析结果来看,原发癌可能与NF-κB转录因子活性的正调控有关。Karvellas等[12]研究发现NF-κB 转录因子受氧化应激等机制激活,使重度溃疡性结肠炎患者罹患结直肠癌的风险增加,Wang等[13]研究表明REGγ通过与NF-κB-YAP的相互调控可促进结肠癌进展,由此,NF-κB 转录因子可能对结肠癌的发生具有促进作用。此外,本研究还发现激素代谢过程、T细胞增殖的正调控也可能参与了结肠癌的发生,其可能的机制还需要更进一步的探讨。
在对比结肠癌肝转移灶与结肠癌旁正常组织的富集分析结果中,所得结果提示结肠癌肝转移灶的产生或涉及其他与有异于结肠原发癌的途径,比如本研究发现的泛素依赖蛋白分解代谢的正调控。目前已有Ji等[14]研究发现泛素依赖蛋白可抑制肝癌细胞的转移,因此促进泛素依赖蛋白的分解代谢过程可能对肝转移灶的产生也有促进作用。另外,一些对于基质金属蛋白酶(MMPs) 家族的研究表明,MMP2、MMP7、MMP9 等参与了肿瘤细胞外基质的重塑,促进肿瘤细胞脱离原发灶从而加速肿瘤的转移过程[15-17]。因此,细胞外一些蛋白酶的活性增加促进泛素依赖蛋白、基质金属蛋白等分解代谢的加快,从而导致细胞外基质的破坏与重塑,有可能是促进结肠癌细胞发生转移的重要机制之一。此外,本研究还发现结肠癌肝转移的发生可能与结肠癌旁正常组织中某些分子的磷酸化或细胞内磷酸酶活性的改变有关,目前去磷酸化与磷酸酶活性的调节与结肠癌肝转移之间的可能机制未见相关报道,仍有待于进一步的实验验证。
本研究通过对比结肠原发癌组织和肝转移灶组织的富集结果,发现结肠癌肝转移的发生还可能与白细胞分化、淋巴细胞分化有关。Tauriello等[18]研究结果显示,缺乏T 细胞浸润、低Ⅰ型辅助性T 细胞(Th1)活性可增加结肠癌发生转移风险。Wang 等[19]研究发现,通过沉默聚腺苷二磷酸核糖水解酶(PARG)可抑制NF-κB 活性,进一步降低IL-10 和TDF-β 的分泌、影响T 细胞和DC 细胞的增殖分化,从而抑制结肠癌的生长和肝转移。上述两项研究结果提示结肠癌肝转移的发生与T淋巴细胞的分化之间可能存在联系。在Burlaka 等[17]研究中,发现当肝脏发生缺血再灌注损伤时,线粒体、NADPH、NOX、不完全或受损的一氧化氮合酶的电子传递链可能参与缺血后组织的超氧化物自由基的生成,从而对结直肠癌肿瘤细胞的微环境产生影响,促进肿瘤进展。本研究发现电子传递活性的生物学功能改变也可能参与了结肠癌肝转移,与已有文献[17]内容存在相符之处。
本研究存在一定的局限性:第一,纳入本研究的样本量少;第二,本研究数据来源于单一数据库,缺乏基础实验验证,本研究的结果还有待于进一步的实验确认。尽管存在上述局限,但本研究的结果仍可为结肠癌肝转移发病机制的研究提供一定的线索。
综上所述,本研究通过利用GEO 数据库中GSE92914 全基因组表达谱芯片数据集,运用GSEA对结肠癌肝转移的发病机制进行了初步探索,发现结肠癌肝转移灶的产生机制相较于结肠癌原发灶可能出现了改变,淋巴细胞分化、白细胞分化和电子传递活性等生物学功能可能参与了结肠癌肝转移的发生。

