遗传性非息肉病性结直肠癌患者的病理特点以及临床意义分析
杩奇 朱瑞萍
遗传性非息肉病性结直肠癌又称Lynch 综合征,是一种由错配修复基因(MMR)突变引起的一种常染色体显性遗传病。遗传性非息肉病性结直肠癌具有特殊的遗传原因和显著的临床病理特征。作者选取2011 年1 月~2014 年10 月本院收治的散发性结直肠癌患者和遗传性非息肉病性结直肠癌患者的资料,通过对10 个家系共40 例的遗传性非息肉病性结直肠癌患者的资料进行整理调查,回顾性的分析其临床病理和随访资料,同时与随机抽取的40 例散发性结直肠癌患者进行比较统计,探讨遗传性非息肉病性结直肠癌患者的病理特点以及临床意义,以加深对遗传性非息肉病性结直肠癌这一疾病的认识并提高临床诊治水平,研究如下。
1 资料与方法
1.1 一般资料 选取2011 年1 月~2014 年10 月在大连大学附属中山医院就诊的80 例大肠癌患者,其中40 例散发性结直肠癌患者作为对照组,40 例遗传性非息肉病性结直肠癌患者作为试验组。选用阿姆斯特丹标准Ⅱ,作者查阅患有遗传性非息肉病性结直肠癌患者的档案资料,对患肿瘤人数、性别、诊断及手术预后情况等进行分析。本研究经大连大学附属中山医院医学伦理委员会审批通过。
1.2 纳入及排除标准 纳入标准:①根据大肠癌临床诊断标准确定为遗传性非息肉病性结直肠癌患者以及散发性结直肠癌患者;②患者年龄20~70 岁。排除标准:排除临床资料不全的患者。
1.3 观察指标 对比两组患者的性别、肿瘤部位、肿瘤分期、病理类型以及3、5 年生存情况。
1.4 统计学方法 采用SPSS20.0 统计学软件进行统计分析。计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组患者的性别、肿瘤部位、肿瘤分期和病理类型比较 两组患者的性别比较,差异无统计学意义(P>0.05);两组患者的肿瘤部位、肿瘤分期和病理类型比较,差异均有统计学意义(P<0.05)。见表1。
2.2 两组患者的3、5 年生存情况比较 试验组患者的3、5 年生存率分别为87.5%、65.0%,均高于对照组的67.5%、42.5%,差异均有统计学意义(P<0.05)。见表2。

表1 两组患者的性别、肿瘤部位、肿瘤分期和病理类型比较(n)
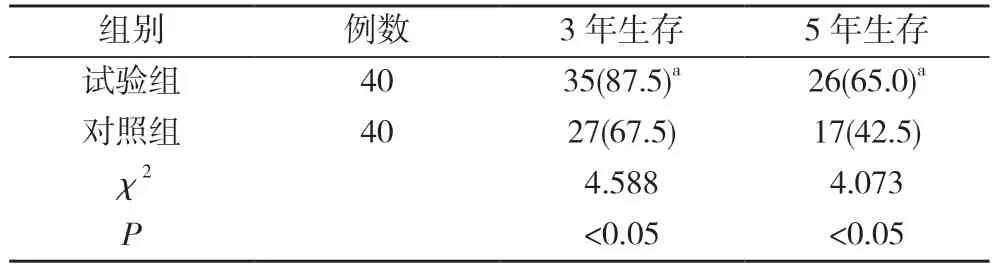
表2 两组患者的3、5 年生存情况比较 [n(%)]
3 讨论
遗传性非息肉病性结直肠癌是一种恶性肿瘤,发生在患者近端结肠或远端结肠及直肠。遗传性非息肉病性结直肠癌具有染色体显性遗传的特点,属于家族性肿瘤。一般来说,家族中基因携带者异常的患者易患遗传性非息肉病性结直肠癌。结直肠癌的早期发病以右半结肠癌为主,并呈多发性病变,常伴有其他全身性恶性肿瘤。遗传性非息肉病性结直肠癌的死亡率高并有遗传性[1]。因此,在临床实践中需要对遗传性非息肉病性结直肠癌进行更深入的研究来了解这类肿瘤的临床病理特征,为目前临床诊治提供科学依据。
遗传性非息肉病性结直肠癌临床诊断的金标准是修复基因突变的检测,其主要依据是遗传性非息肉病性结直肠癌的发病机制。但这种诊断方法对检测设备要求高且成本相对较高。患者需要等待很长时间且在临床上无法推广。目前临床上广泛应用的遗传性非息肉病性结直肠癌诊断标准有两种,即阿姆斯特丹标准和日本标准[2]。阿姆斯特丹诊断标准是国际通用标准,该标准对家庭疾病较少患者数量有严格要求,不太适合小家庭疾病筛查并容易漏诊。日本标准比较适合亚洲人群,虽然没有得到国际认可,但其诊断准确率较高。日本标准更适用于我国遗传性非息肉病性结直肠癌的临床诊断,应用可提高检出率,为遗传性非息肉病性结直肠癌的筛查提供可靠依据。同时,有结直肠癌家族史的人患遗传性非息肉病性结直肠癌的风险较高并需定期检查。如果可能的话,可以终生跟踪。建议对25~55 岁的这类人要终生跟踪。遗传性非息肉病性结直肠癌的主要分子病理改变是由于MMR 基因(hMSH2、hMLH1、hMSH6、hpsm1、hMLH3 等)杂合度的丧失,MMR 基因杂合性缺失的重要表现是微卫星不稳定性(MSI)[3],阿姆斯特丹标准Ⅱ目前被广泛接受为遗传性非息肉病性结直肠癌的临床诊断标准,但由于标准完全依赖临床病史进行诊断且客观性差;如果历史记录集合不完整,则可能会丢失诊断依据,日本1992 年提出的遗传性非息肉病性结直肠癌诊断标准为:①大肠癌患者一级亲属中结直肠癌3 例(含3 例)以上。②患者一级亲属结直肠癌2 例。符合下列条件之一可能为遗传性非息肉病性结直肠癌:患者发病年龄<53 岁,左半结直肠癌,同时(或异时)结直肠癌,与直肠外遗传性非息肉病性结直肠癌相关。与阿姆斯特丹标准Ⅱ相比,日本标准减少了患者数量并不再强调连续两代发病,但仍反映了遗传性非息肉病性结直肠癌的临床特点,2002 年,国家遗传性结直肠癌合作组提出了中国标准遗传性非息肉病性结直肠癌,降低了大肠癌家族病例数的要求,将胃癌、肝胆癌等7 种非大肠癌纳入诊断标准并反映了中国人群的特点和肿瘤谱。国家遗传性结直肠癌合作组提出了中国标准遗传性非息肉病性结直肠癌标准不仅能反映遗传性非息肉病性结直肠癌的临床特点,而且适用于我国小家庭数量逐年增加的现实,比目前日本的标准更具针对性和合理性。由于遗传性非息肉病性结直肠癌在大肠癌中所占的比例差异很大,从2%到17%,在我国从3%到4%,差异较大的主要原因是参考标准不一致[4]。
本院结直肠癌患者占同期结直肠癌患者的4.9%。这组病例表明,典型的遗传性非息肉病性结直肠癌和非典型遗传性非息肉病性结直肠癌具有发病早、右半结肠癌、黏液腺癌、多原发癌和直肠外癌发病率高、远期预后好的特点,这与文献的基础是一致的。值得注意的是,欧美家庭大肠外的恶性肿瘤有子宫内膜癌、胃癌、小肠癌、肝胆癌及肾盂输尿管癌、胰腺癌等,而胃癌的危险性在中国和东亚国家最高,与全国肿瘤谱一致。遗传性非息肉病性结直肠癌具有肿瘤多,非典型性少,散发性少,典型组子宫内膜癌、胃癌较多,遗传性非息肉病性结直肠癌的预后优于散发性结直肠癌等特点,其原因是遗传性非息肉病性结直肠癌诊断时侵袭力弱且转移少。Dukes A 期和B 期是遗传性非息肉病性结直肠癌的主要病例,这也证实了这一理论。肿瘤侵袭转移过程涉及多种因素。发现TGFβ/Smad和Wnt/β-Catenin 可能在遗传性非息肉病性结直肠癌的生物学行为中起重要作用,MMR(主要是hMSH2 和hMLH1)的突变不仅引起遗传性非息肉病性结直肠癌的发生,而且引起tβR Ⅱ失活,这是TGF-β-Catenin的关键环节β/Smad 信息通路[5,6]。突变失活将使遗传性非息肉病性结直肠癌逃逸TGF-β1而抑制早期肿瘤的发生,这可能是遗传性非息肉病性结直肠癌发病早和病理分化差、出现多原发癌的原因之一,同时TGF-β/Smad 和Wnt/β-cat 也与肿瘤的发生有关tβR Ⅱ的突变失活也降低了TGF-β1对细胞膜E-cad和β-cat 的降解能力,从而增加了遗传性非息肉病性结直肠癌癌细胞间的粘附并降低血清中β-cat 的表达,诱导MMP-7 的表达,由于MMP-7、E-cad 和β-Cat与肿瘤的侵袭转移密切相关,且Wnt/β-Cat 下游靶基因产物减少,这可能是遗传性非息肉病性结直肠癌侵袭力弱、转移少且预后好的原因,具体细节值得进一步研究。从本试验可以看出,遗传性非息肉病性结直肠癌患者和散发性结直肠癌患者在性别方面比较,差异无统计学意义(P>0.05);遗传性非息肉病性结直肠癌患者和散发性结直肠癌患者的肿瘤部位、肿瘤分期和病理类型比较,差异有统计学意义(P<0.05)。遗传性非息肉病性结直肠癌患者3、5 年生存率均高于散发性结直肠癌患者,差异有统计学意义(P<0.05)。
综上所述,遗传性非息肉病性结直肠癌患者的病理特点显著,且预后比散发性结直肠癌要好,值得临床推广。但是研究纳入样本例数比较少,应该从多中心抽取样本,为临床治疗提供作证。

