Caveolin-1结合Cyclophilin A改善大鼠血管平滑肌细胞胆固醇蓄积
郭 琰,徐 琳,马 骏,向定成,阮云军,曾娅玲,黄建玉,廖端芳*
(1.中国人民解放军南部战区总医院心内科,广东 广州 510010;2.南方医科大学南方医院老年科,广东 广州 510515;3.湖南中医药大学,湖南 长沙 410208)
胆固醇蓄积是导致动脉粥样硬化性血管疾病最重要的危险因素,而机体胆固醇代谢与细胞内外蛋白转运密切相关。作为胆固醇转运的关键蛋白小凹蛋白-1(Caveolin-1,CAV-1)是富含于小凹结构的一种分子量为21kD的蛋白质,除此之外还具有维持细胞膜稳定、负性调节信号通路、介导炎症反应等多种生物学功能[1]。亲环素A(cyclophilin A,CYPA)是亲免素家族成员,分子量为18kD,其结构中含有一个CAV-1结合区[2]。有文献报道CAV-1与CYPA联合参与胆固醇转运[3]。环孢素A(cyclosporin A,CSA)是第一个发现的与CYPA具有高度亲和性,并具有抑制CYPA活性作用的多肽[4]。课题组前期工作发现血管平滑肌细胞(VSMCs)优势表达CYPA,且与CAV-1共存[5]。本研究拟在荷脂不同时间的VSMCs荷脂模型上,观察胆固醇转运复合物CYPA与CAV-1表达的变化,及其对细胞内胆固醇含量的影响;并应用传统的细胞内抑制CYPA活性药物CSA处理细胞,观察其对CYPA与CAV-1结合的影响,进而发现参与胆固醇转运的相关蛋白,探索动脉粥样硬化形成的病理生理机制。
1 材料与方法
1.1 实验材料
SD大鼠购自南华大学实验动物中心;优质胎牛血清购自北京四季清公司;DMEM购自美国GIBCO;胰蛋白购自美国Hyelone公司;Western Blot荧光检测试剂盒、CAV-1购自Santa Cruz(USA)公司;CYPA购自UpState(USA)公司;CSA、丽春红染色试剂、油红O染料购自Sigma(USA)公司;Trypsin 1∶250、Tween-20、SDS、Tris-Base、AmmoniμM Persulfate、Glycine、TEMED购自USA Amresco,Inc.;β-actin、辣根过氧化物酶标记的山羊抗兔、FITC荧光标记的山羊抗兔、Prestained Protein Marker、Mouse Anti-β-Actin购自北京中杉金桥生物技术有限公司。其余试剂均为进口或国产分析纯试剂。
1.2 方法
1.2.1 细胞提取及培养 取120~150 g SD大鼠,无菌条件下分离大鼠胸主动脉,将血管中膜平滑肌层剪成组织块进行培养,孵育箱中培养。胰蛋白酶消化传代。显微镜观察:细胞形态多样呈长梭形或梭形,细胞间有突起相连,呈典型的“峰-谷”样生长。实验用长势良好的3~10代细胞。将实验分为未加任何因素培养的正常平滑肌细胞作为空白对照组(control组)、用Ox-LDL 75 μg/mL孵育24、48、72 h组、Ox-LDL 75 μg/mL预孵育48 h后用CSA 1 μM处理1 h组(CSA组)、Ox-LDL 75 μg/mL预孵育48 h后DMSO处理组作为溶酶对照1 h组(DMSO组)。
1.2.2 低密度脂蛋白的氧化修饰及鉴定 参照课题组既往方法[5],取未加抗凝剂的健康人新鲜血液,提取出LDL进行氧化修饰。氧化修饰后的LDL(oxidized low density lipoprotein,Ox-LDL)经超滤除菌,BCA试剂定量蛋白,调蛋白浓度至lg/L用于实验。
1.2.3 油红O染色法检测细胞内脂质 将细胞接种于预先放有盖玻片的6孔培养板中,用含10%胎牛血清的DMEM培养基培养细胞至60%融合,换用含0.1%胎牛血清的DMEM培养基加不同的处理因素。处理结束后,用PBS冲洗3次,50%异丙醇固定1 min,油红O染色液染色10 min,去离子水冲洗3次,苏木素染色。分色和返蓝后,显微镜下观察,HPIS-1000型图象分析系统收集图像。
1.2.4 Western-blot法检测 CYPA,CAV-1和β-actin蛋白表达参照课题组既往方法[5],收集不同条件处理的VSMCs细胞,用Western blot荧光检测试剂盒显示结果于X光片。Epson1650photo扫描仪收集图像,以面积和光密度的乘积即积分光密度表示。
1.2.5 高效液相色谱法检测细胞内胆固醇 按文献方法[6],待VSMCs处理结束后,弃去培养基,PBS清洗,裂解细胞,BCA定量、离心,留上清进行胆固醇检测。以豆甾醇为内标并作标准曲线,取上清液加入氢氧化钾溶液,水解胆固醇酯后为细胞内总胆固醇(total cholesterol TC)样品,加NaOH为游离胆固醇样品。各样品分别与内标液混匀,用正己烷和无水乙醇抽提后,三氧化铬进行氧化衍生并真空干燥,乙晴-异丙醇溶解样品,上样于高效液相色谱仪。采用C-18柱,柱温4 ℃,流速1 mL/min,250 nm紫外光检测,胆固醇以峰面积定量,内标校准,以μg/mg细胞蛋白为单位。细胞内胆固醇酯(CE)含量为TC与游离胆固醇(FC)的差值。
1.2.6 间接免疫荧光方法检测CYPA和CAV-1的蛋白表达及定位 VSMCs接种于12孔板中,经分组处理后,用预热至37 ℃的PBS洗3遍,用10%甲醛固定(4 ℃,过夜)或(37 ℃,15分钟),弃去孔板内液体,加1 mL穿透液(放置37 ℃,20 min),弃去穿透液,加CYPA或CAV-1一抗(37 ℃孵育2 h),TBST洗3遍,弃去洗液,加FITC标记的羊抗兔二抗(37 ℃,避光孵育30 min),TBST洗3遍后穿透液清洗,荧光显微镜下观察。
1.2.7 免疫共沉淀检测细胞内CYPA和CAV-1的相互作用 参照课题组既往方法[5],提取细胞蛋白,部分进行定量等操作,用Western blot荧光检测试剂盒显示结果于X光片。Epson1650photo扫描仪收集图像,以面积和光密度的乘积即积分光密度表示。
1.3 统计学方法
实验数据用均数±标准差表示。用SPSS20.0进行统计处理,组间比较用单因素方差分析检验,后用最小有意义差异t检验进行均数间的多重比较,以P<0.05判定差异有无显著性意义。
2 结 果
2.2 Ox-LDL对VSMCs处理不同时间对CAV-1和CYPA表达的影响
用Western-blot检测发现:当细胞用75 mg/L Ox-LDL处理不同时间后,CAV-1蛋白表达与对照组相对密度比较,24 h由1.3±0.065下降到0.90±0.017,48 h下降到0.58±0.027,72 h下降到0.35±0.045,差异均有显著性(P<0.05);CYPA蛋白表达与对照组3.38±0.25相比,24 h为2.74±0.19,48 h为2.27±0.03,72 h为1.76±0.05。CAV-1和CYPA蛋白随荷脂时间延长,表达逐渐减低,差异均有显著性(P<0.05),见图1。
2.3 Ox-LDL处理不同时间对VSMCs内CAV-1与CYPA定位表达的影响
间接免疫荧光定位检测发现:用75 mg/L Ox-LDL对VSMCs处理不同的时间(24,48,72h),Ox-LDL显著抑制VSMCs中CYPA与CAV-1在胞膜、胞浆中的表达,与对照组相比,当细胞处理24,48,72h后荧光强度逐渐降低,见图2。

图1 Ox-LDL处理VSMCs不同时间对CAV-1和CYPA蛋白表达的影响与control组比较,a P<0.05;与24 h组比较,b P<0.05;与48 h组比较,c P<0.05(n=3)
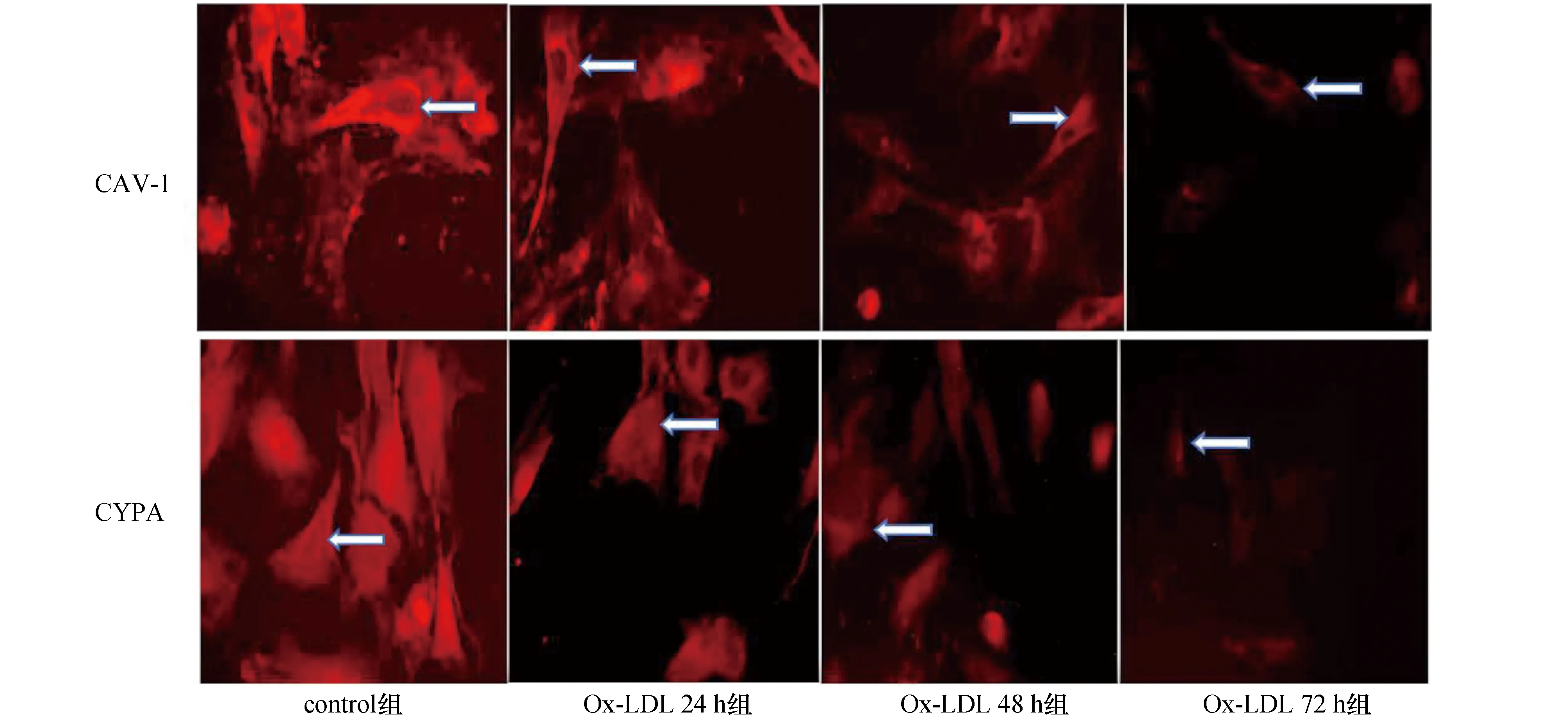
图2 Ox-LDL处理不同时间对VSMCs内CAV-1和CYPA定位表达的影响(200×)
2.3 Ox-LDL处理不同时间对VSMCs荷脂的影响
用75 mg/L Ox-LDL对VSMCs处理不同的时间(24,48,72 h),用油红O染色显微镜下观察细胞内脂质的变化,结果发现:随着Ox-LDL作用时间的延长,细胞内红色颗粒逐渐增加,当Ox-LDL处理细胞48及72 h后,胞浆内大量红色颗粒存在,细胞荷脂明显,见图3。

图3 Ox-LDL处理细胞不同时间对VSMCs内脂滴形成的影响(200×)
2.4 Ox-LDL处理不同时间VSMCs内脂质含量变化
用75 mg/L Ox-LDL对VSMCs处理不同的时间(24,48,72h),高效液相色谱法检测结果发现,随着Ox-LDL作用时间的延长,细胞内TC含量不断增加,由未处理组的133.82±5.62 μg/mg增加至24 h的291.01±8.36 μg/mg,48 h为425.91±2.22 μg/mg,72 h为532.79±3.45 μg/mg;细胞内游离胆固醇含量由124.46±6.35 μg/mg上升至24 h的227.62±7.66 μg/mg,48 h为285.92±6.18 μg/mg,72 h为320.54±2.11 μg/mg。CE/TC值与0 h 7.53±1.04%相比,24 h 19.95%±4.95%,48 h 34.16±1.32%,72 h 40.15±0.59%,差异均有显著性(P<0.05),见图4。
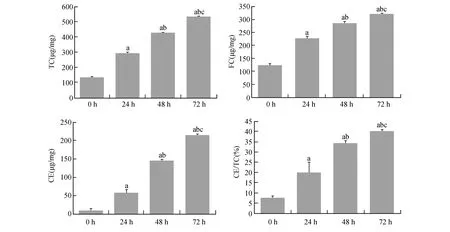
图4 Ox-LDL处理不同时间对VSMCs内胆固醇含量的影响(n=3)与0 h组比较,a P<0.05;与24 h组比较,b P<0.05;与48 h组比较,c P<0.05
2.5 CSA对CAV-1和CYPA的蛋白表达有无明显影响
Western blot检测:用75 mg/L Ox-LDL处理VSMCs48h后,对照组为未加CSA处理,另一组用1 μM CSA处理细胞1 h,结果显示:与对照组相比,蛋白表达无明显变化,差异无显著性,(P>0.05),见图5。
2.6 CSA对CYPA与CAV-1结合能力的影响
免疫共沉淀后发现:CYPA与CAV-1相互作用;用1 μM CSA处理细胞1h后抑制CYPA活性,CYPA与CAV-1的蛋白结合能力降低,差异有显著性(P<0.05),见图6。
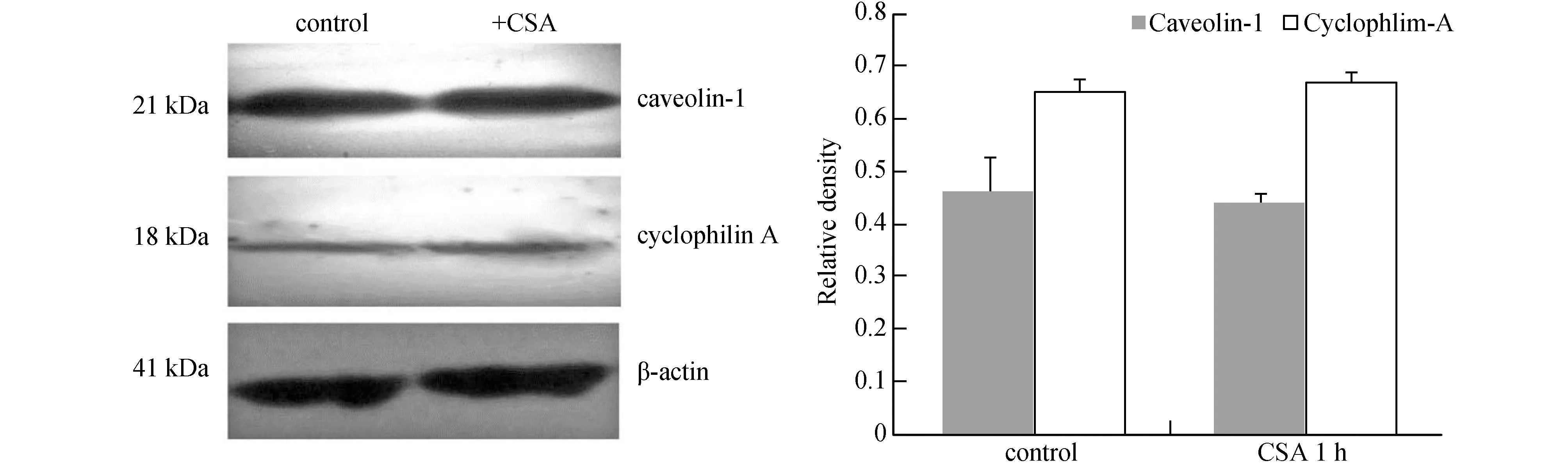
图5 用1 μM CSA处理荷脂细胞1 h对CYPA和CAV-1表达影响与control组比较,P>0.05

图6 CSA对CYPA与CAV-1结合能力的影响与control组比较,a P<0.01(n=3)
2.7 CSA对VSMCs荷脂的影响
实验分四组:control、Ox-LDL 48 h、Ox-LDL 48 h+DMSO 1 h和Ox-LDL 48 h+1 μM CSA 1 h。用油红O染色显微镜下观察,结果发现:与对照组相比,Ox-LDL 48 h组胞浆内红色颗粒增多,Ox-LDL 48 h组与DMSO组差别不明显,与DMSO及48h组相比,CSA组的VSMCs胞浆内红色颗粒明显增多,见图7。
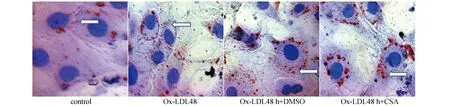
图7 Ox-LDL处理不同时间对VSMCs内脂质含量的影响(200×)
2.8 CSA抑制CYPA活性后对VSMCs内外胆固醇含量的影响
高效液相色谱法检测分析发现:与对照组相比,Ox-LDL处理48h后细胞外培养液中胆固醇含量由40.17±1.15 μg/mg下降至20.4±0.83 μg/mg,Ox-LDL48h组与DMSO组差别不明显,与DMSO组相比,处理了CSA的VSMCs外TC降至16.51±0.79 μg/mg,差异有显著性(P<0.05)。与DMSO组相比,细胞内TC由73.14±6.87 μg/mg增至145.90±9.80 μg/mg,差异有显著性(P<0.01),见图8。
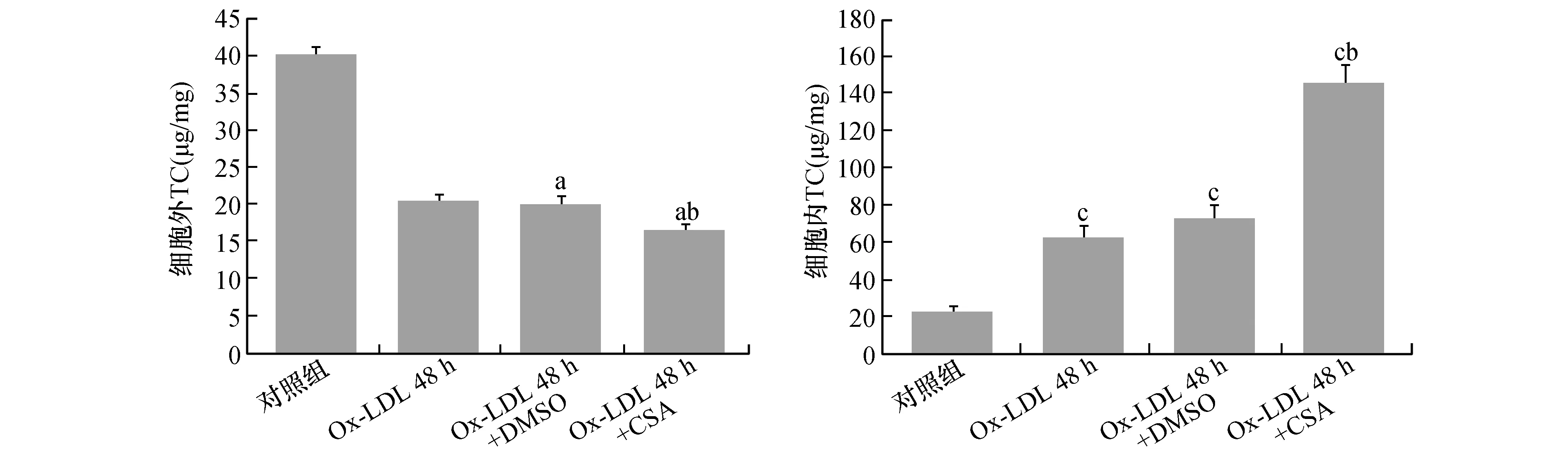
图8 CSA处理后对VSMC细胞内外胆固醇含量的影响与对照组比较,a P<0.05,c P<0.01;与Ox-LDL 48 h+DMSO比较,b P<0.05(n=3)
3 讨 论
随着社会生活水平提高,人口结构的老龄化,心血管疾病的数量在急剧增加,而动脉粥样硬化性血管疾病是最常见死因之一,严重威胁到人类生命健康[7-8]。动脉粥样硬化是一种多因素参与的慢性疾病[9-11],其中细胞摄取过多脂质泡沫化是动脉粥样硬化最危险的始动环节之一[12]。本实验用75 mg/L Ox-LDL与VSMCs细胞共同孵育不同的时间,油红O染色观察,在Ox-LDL处理细胞24,48及72h后,细胞内有大量脂滴的形成。这说明Ox-LDL损伤细胞内胆固醇自平衡机制,抑制细胞内胆固醇流出,与文献报道相符[13]。
CAV-1存在于心血管系统的大多数细胞类型中,是一种高亲和力的脂质结合蛋白,具有结合、运载胆固醇的功能并促进细胞内游离胆固醇的流出,对维持细胞胆固醇的稳态起着重要调节作用[14-15]。本实验中CAV-1的表达随着Ox-LDL处理时间的延长逐渐减弱,伴随细胞内胆固醇含量增加。结合文献及课题组前期结果:CAV-1高表达能抑制细胞内脂质蓄积[16-17]。说明CAV-1表达与Ox-LDL诱导的细胞胆固醇蓄积密切相关。
CYPA是亲免素家族成员之一,当VSMCs受到炎症刺激后能够分泌该蛋白[18]。研究报道CYPA不仅参与细胞内胆固醇转运复合物的形成,还可作为一种氧化应激诱导分泌的生长因子促进VSMCs增殖和炎症细胞的体外迁移[19]。本实验通过免疫共沉淀证明了CYPA和CAV-1在大鼠VSMCs内相互结合,与文献报道相符[3]。实验中发现随着Ox-LDL处理时间的延长,CYPA的蛋白表达逐渐减弱。提示Ox-LDL对细胞的氧化损伤,可能使CYPA与CAV-1的表达下调,从而部分抑制CYPA与CAV-1的胆固醇转运功能。
有文献报道CYPA的抑制剂CSA常作为免疫抑制剂治疗相关疾病同时可导致患者LDL-胆固醇水平升高,加重动脉粥样硬化[20]。因此本实验推测,CSA可能还可以通过抑制CYPA的活性来影响由CAV-1介导的胆固醇流出。实验通过Ox-LDL处理VSMCs 48 h,再用1 μM的CSA处理细胞1 h,免疫共沉淀结果显示处理组与对照组相比,蛋白结合减少。而CSA对该两种蛋白的表达并无明显影响,间接证明了CSA可能是通过抑制VSMCs内CYPA的活性而影响它与CAV-1的结合作用。并且当荷脂细胞用CSA处理后,与对照组相比,处理组胞浆内脂滴明显增加。同时用高效液相色谱分析细胞内外TC含量比值来推测CYPA活性受到抑制后对血管平滑肌细胞吞噬脂质或胆固醇流出的影响。结果发现与Ox-LDL诱导48 h组相比,处理CSA1h后,细胞外胆固醇比值降低,相应细胞内的TC含量比对照组要多。这两个实验都推测CSA处理VSMCs后可能通过抑制CYPA活性从而降低CYPA与CAV-1结合,而增加VSMCs内胆固醇的蓄积。
本研究结果提示Ox-LDL通过下调细胞内CYPA与CAV-1的表达,促进细胞内的胆固醇蓄积。如抑制细胞内CYPA活性可降低VSMCs内CYPA与CAV-1的相互作用,并促进细胞内的胆固醇蓄积。结合细胞实验,接下来的研究中我们将采用CYPA与CAV-1基因敲除小鼠开展相关工作,进一
步探讨胆固醇转运机制,寻找动脉粥样硬化性血管疾病治疗中的新靶点。

