miRNA-638对巨噬细胞内胆固醇外流的影响及其发生机制研究
韩婕,高登峰,王晓娜,曹瑞华,邓捷,叶平
生活方式、饮食结构等外部因素的改变与遗传因素相互作用导致人体脂代谢紊乱,表现为总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)及三酰甘油(TG)升高,高密度脂蛋白胆固醇(HDL-C)降低,并可进一步导致脂代谢紊乱的相关性疾病的发生,如冠状动脉粥样硬化性心脏病(ASCVD)等,加重医疗经济负担[1]。因此血脂管理是防治ASCVD的重要措施。脂质斑块形成的中心环节是富含大量脂质的泡沫细胞沉积于血管内皮下[2],其可通过摄取及外流胆固醇保持内外胆固醇稳态。研究表明,肝脏既分泌了能够负荷胆固醇的脂蛋白向外周运送胆固醇,也可通过高密度脂蛋白(HDL)转运外周多余的胆固醇至肝脏进行代谢[3-4]。研究也证实了microRNA(miRNA)能够参与调节胆固醇代谢的不同阶段[5-9]。笔者前期从普通人群血浆中miRNA的差异性表达入手,通过芯片技术筛查发现miRNA-638与HDL-C水平相关[10]。目前关于miRNA-638的研究多集中在肿瘤方面[11-12],其与胆固醇代谢的关系鲜有报道。本研究旨在探讨miRNA-638对巨噬细胞内胆固醇外流的影响及其发生机制,现报道如下。
1 材料与方法
1.1 主要试剂与仪器 人髓系白血病单核细胞(THP-1)购自美国ATCC,编号TIB202;佛波酯(PMA)、NBD-胆固醇、3K15高速冷冻离心机购自美国Sigma公司;miRNA-638模拟物及其阴性对照物及HiPerFect Transfection Reagent购自德国Qiagen公司;TRIzol购自美国Invitrogen公司;总RNA经反转录试剂盒、SYBR Green qPCR试剂盒、引物、蛋白抽提试剂、Bradford蛋白定量试剂盒及辣根过氧化物酶标记二抗购自SinoGene公司;抗三磷酸腺苷结合盒转运体A1(ABCA1)/三磷酸腺苷结合盒转运体G1(ABCG1)抗体购自美国Boster公司;抗极低密度脂蛋白受体(VLDLR)抗体购自北京博奥森生物技术有限公司;氧化型低密度脂蛋白(ox-LDL)及HDL购自北京协生生物科技有限责任公司;清道夫受体BI(SR-BI)抑制剂BLT-1购自美国Millipore公司;载脂蛋白AI(ApoAI)购自北京义翘神州科技有限公司;洁净工作台〔苏净安泰生产,型号:SW-CJ-2F(D)〕;倒置式生物显微镜(南京江南永新光学有限公司生产,型号:XD-101);低速台式大容量离心机(上海安亭科学仪器厂生产,型号:TDL-40B);二氧化碳(CO2)细胞培养箱(Sanyo,型号:MCO-15AC);JY-SPFT电泳槽、JY300C电泳仪、JY04S-3C凝胶成像系统购自北京君意东方电泳设备有限公司;生物分光光度计(Eppendorf,Biophotometer);荧光实时定量PCR仪(ABI,StepOnePLUS),荧光酶标仪(BioTek,Synergy2)。
1.2 细胞培养 实验完成于2016年9月—2017年9月。将THP-1以3×105cells/cm2的密度接种至24孔细胞培养板中,采用DMEM+10%胎牛血清(FBS)完全培养液培养,加入PMA 100 ng/ml,置于37 ℃、5%CO2、95%相对湿度的CO2细胞培养箱中培养48 h,诱导THP-1贴壁并分化为巨噬细胞。
1.3 转染 miRNA-638模拟物为化学合成的双链RNAs,在转染到细胞后可模拟内源成熟miRNA-638,该实验中miRNA-638模拟物为细胞培养级纯度(>90%纯度)。miRNA-638模拟物阴性对照物为化学合成的经修饰的单链RNA,与任何已知的哺乳动物基因无同源性。转染过程严格按照HiPerFect Transfection Reagent试剂盒说明书进行操作,具体方法如下:将干粉状miRNA-638模拟物及其阴性对照物离心后,经高压灭菌的双蒸水配制成浓度为20 μmol/L的miRNA-638模拟物及其阴性对照物储存液。根据预实验结果,在DMEM培养基中按比例配制浓度为20 nmol/L的miRNA-638模拟物及其阴性对照物-HiPerFect Transfection Reagent复合物,轻轻震荡混匀并于室温下孵育10 min,后吸走24孔细胞培养板中巨噬细胞培养液,转染12 h后,更换DMEM+10% FBS完全培养液,放入CO2细胞培养箱中继续培养,在转染48 h后观察细胞形态并收集细胞。
1.4 观察指标
1.4.1 NBD-胆固醇外流率 转染后在无血清DMEM培养基饥饿细胞8 h,更换100 μg/ml ox-LDL的DMEM+10% FBS完全培养液继续培养24 h,加入100 μmol/L BLT-1 2 h,在5 μmol/L的NBD-胆固醇孵育液孵育细胞4 h后,分别采用25 μg/ml ApoAI、50 μg/ml HDL和标准血清诱导外流液处理4 h,结束后收集诱导外流液及细胞裂解液。使用荧光酶标仪检测诱导外流液和细胞裂解液的荧光强度,激发光和发射光波长分别为469 nm和537 nm,计算NBD-胆固醇外流率即胆固醇外流率,NBD-胆固醇外流率=FI诱导外流液/(FI诱导外流液+FI细胞裂解液)×100%。
1.4.2 ABCA1、ABCG1、VLDLR mRNA相对表达量 转染后吸去旧培养液,加入经高压灭菌的磷酸盐缓冲液清洗细胞2~3次后吸干。加入适量TRIzol,用吸管反复吹打培养瓶壁,使巨噬细胞彻底脱离培养瓶壁后,将培养瓶内液体全部移入1.5 ml无RNA酶离心管中,剧烈震荡,室温静置2~3 min,加入200 μl氯仿,剧烈涡旋30 s,室温静置5 min,4 ℃ 13 000×g离心15 min,留取无色上清液置于新的1.5 ml无RNA酶离心管中,加入等体积异丙醇混匀,冰上静置10 min,4 ℃ 13 000×g离心10 min,弃上清液,加入1 ml 70%乙醇漂洗沉淀,4 ℃ 13 000×g离心5 min,弃70%乙醇,空气晾干RNA沉淀,加60 μl 焦炭酸二乙酯(DEPC)水溶解RNA沉淀。总RNA经反转录试剂盒合成cDNA,以β-actin为内参基因,采用实时荧光定量PCR法,经SYBR Green qPCR试剂盒分别检测ABCA1、ABCG1、VLDLR mRNA相对表达量,扩增条件:95 ℃预变性 10 min,95 ℃ 20 s,60 ℃ 30 s,共 40 个循环。反应结束后得到Ct值,根据公式2-ΔΔCt法计算目标基因相对表达量。各引物序列如下:β-actin上游引物:5'-ACTGCTCTGGCTCCTAGCAC-3',下游引物:5'-ACATCTGCTGGAAGGTGGAC-3';ABCA1上游引物:5'-AATTCTCAAGTGCAAACACTTCTGG-3',下游引物:5'-GAGGCATATGCTTGCGGTACA-3';ABCG1上游引物:5'-CTTGCAGTAGGGGCTTTCAG-3',下游引物:5'-GCAAGGCTAGAGGTGTGGAG-3';VLDLR上 游 引物:5'-TTCCAGTGCACAAATGGTCG-3',下游引物:5'-GGAACACACTGGCCATTGTT-3'。
1.4.3 ABCA1、ABCG1、VLDLR相对表达量 采用Western blotting 检 测 ABCA1、ABCG1、VLDLR 相 对表达量,具体如下:转染后加入含蛋白酶抑制剂的蛋白抽提试剂提取细胞蛋白,采用Bradford蛋白定量试剂盒进行蛋白定量,加入Loading buffer后煮沸蛋白并于-20 ℃保存。电泳分离蛋白:将封闭过的聚偏二氟乙烯(PVDF)膜加入一抗,于4 ℃摇床孵育过夜,使抗原抗体充分结合;加入辣根过氧化物酶标记的二抗,采用化学发光法检测ABCA1、ABCG1、VLDLR相对表达量。以β-actin为内参,将显影结果进行灰度数据结果分析。
1.5 统计学方法 采用SPSS 13.0及Prizm 5进行数据分析并作图。计量资料以(± s)表示,两组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 NBD-胆固醇外流率 转染miRNA-638模拟物巨噬细胞经ApoAI外流液介导的NBD-胆固醇外流率低于转染阴性对照物巨噬细胞,差异有统计学意义(t=2.524,P<0.05);转染miRNA-638模拟物巨噬细胞与转染阴性对照物巨噬细胞经HDL、标准血清外流液介导的NBD-胆固醇外流率比较,差异无统计学意义(t值分别为0.108、1.520,P值均>0.05,见图1)。
2.2 ABCA1、ABCG1、VLDLR mRNA相对表达量 转染miRNA-638模拟物巨噬细胞的ABCA1、ABCG1、VLDLR mRNA相对表达量低于转染阴性对照物巨噬细胞,差异有统计学意义(t值分别为2.491、2.011、2.210,P值均<0.05,见图2)。
2.3 ABCA1、ABCG1、VLDLR相对表达量转染miRNA-638模拟物巨噬细胞中ABCA1、ABCG1相对表达量低于转染阴性对照物巨噬细胞,差异有统计学意义(t值分别为2.663、2.145,P值均<0.05);转染miRNA-638模拟物巨噬细胞与转染阴性对照物巨噬细胞中VLDLR相对表达量比较,差异无统计意义(t=1.005,P>0.05,见图3)。转染miRNA-638模拟物巨噬细胞ABCA1、ABCG1、VLDLR相对表达量电泳图见图4。
3 讨论
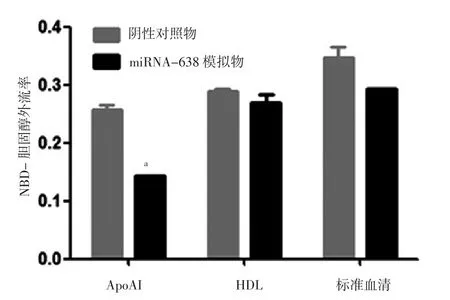
图1 转染miRNA-638模拟物及其阴性对照物巨噬细胞经ApoAI、HDL及标准血清外流液介导的NBD-胆固醇外流率Figure 1 NBD-cholesterol efflux rate by ApoAI,HDL and standard serum in macrophage transfected with miRNA-638 mimics and its negative control

图2 转染miRNA-638模拟物及其阴性对照物巨噬细胞中ABCA1、ABCG1、VLDLR mRNA相对表达量Figure 2 Relative expression levels of ABCA1,ABCG1 and VLDLR mRNA in macrophages transfected with miRNA-638 mimics and its negative control

图3 转染miRNA-638模拟物及其阴性对照物巨噬细胞中ABCA1、ABCG1、VLDLR相对表达量Figure 3 Relative expression levels of ABCA1,ABCG1 and VLDLR proteins in macrophages transfected with miRNA-638 mimic and its negative control
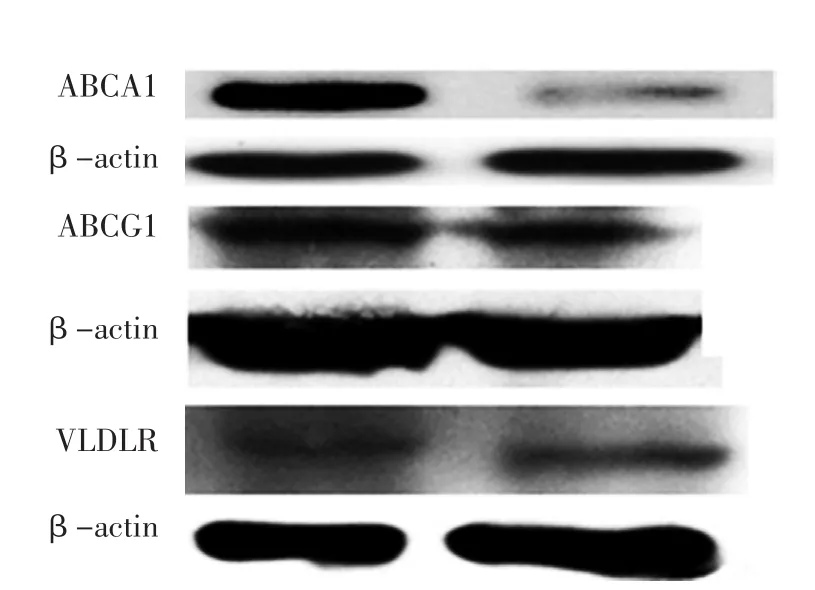
图4 转染miRNA-638模拟物巨噬细胞ABCA1、ABCG1、VLDLR相对表达量的电泳图Figure 4 Electrophoretogram of relative expressions of ABCA1,ABCG1 and VLDLR proteins in macrophages transfected with miRNA-638 mimic
胆固醇在构成细胞膜、合成胆汁酸及激素、参与机体内多种物质代谢等生理过程中发挥着重要作用[13]。目前研究认为,动脉粥样硬化斑块形成的核心是吞噬了大量胆固醇的泡沫细胞在血管内皮下沉积,而哺乳动物体内细胞大多不具备胆固醇的分解代谢能力[14]。因此,细胞内胆固醇的外流能够有效防止胆固醇在外周组织器官中的蓄积。HDL能够介导细胞内多余的胆固醇向肝脏转运,经肝脏分解代谢后形成胆汁外排,从而维持机体内胆固醇稳态,这一过程又被称为胆固醇逆转运(RCT)。RCT过程较复杂,目前研究认为,其主要依靠ABCA1/ABCG1、ApoAI、SR-BI等介导[15]。细胞内胆固醇通过细胞膜上ABCA1流出至循环中ApoAI,形成新生HDL颗粒,而新生HDL颗粒可继续接受由ABCG1介导的胆固醇外流,直至形成成熟HDL颗粒,后被肝脏SR-BI选择性摄取,最终将胆固醇分解代谢[16-20],因此机体内RCT被认为是重要的抗动脉粥样硬化斑块形成的过程。前瞻性流行病学研究证实,HDL-C每升高1 mg/dl,ASCVD发病风险可降低2%~3%,并独立于其他传统心血管疾病的危险因素[21]。RCT中每一个步骤的效率均会影响整体过程[22-23],而关键限速步骤为细胞内胆固醇外流[24],其并不是依赖浓度梯度的简单扩散,而是受到严格调控的膜转运蛋白介导的主动耗能过程[25]。
虽然RCT的过程容易理解,但过程中每一个步骤的具体调控机制仍需进一步探索。现有的治疗策略可能会导致较多不良反应[26-27]。目前研究发现,miRNA展现出了精确调节脂代谢的潜力,可能会成为减少不良反应的治疗靶点[28]。笔者前期对普通人群循环miRNA筛查的结果提示,低HDL-C水平人群血浆中miRNA-638表达量高于正常HDL-C水平人群[10]。miRNA-638在人类及灵长类动物细胞中均有表达,而目前关于miRNA-638的研究多集中在肿瘤方面,提示其可能参与肿瘤细胞的增殖及转移[11-12]。但miRNA-638与RCT的关系尚不明确。笔者前期发现为深入探讨其在胆固醇代谢过程中可能发挥的作用提供了依据。
通过检测细胞内胆固醇外流率可以明确miRNA-638对RCT过程有无影响。目前同位素氚标记的胆固醇(3H-胆固醇)是检测胆固醇外流率的“金标准”,但因辐射污染问题无法广泛应用。本研究采用NBD-胆固醇是将荧光基团标记于胆固醇烷基基团,而激发后的荧光强度与胆固醇水平呈正比[29]。本研究结果显示,转染miRNA-638模拟物巨噬细胞经ApoAI外流液介导的NBD-胆固醇外流率低于转染阴性对照物巨噬细胞;转染miRNA-638模拟物巨噬细胞与转染阴性对照物巨噬细胞经HDL、标准血清外流液介导的NBD-胆固醇外流率间差异无统计学意义,可能是miRNA-638能够影响细胞内胆固醇外流,且其调控具有选择性,主要抑制细胞内胆固醇流出至ApoAI形成新生HDL颗粒过程。进一步研究结果表明,转染miRNA-638模拟物巨噬细胞中ABCA1、ABCG1相对表达量低于转染阴性对照物的巨噬细胞;转染miRNA-638模拟物巨噬细胞与转染阴性对照物巨噬细胞中VLDLR相对表达量间差异无统计意义,提示miRNA-638能够降低巨噬细胞中ABCA1、ABCG1 相对表达量,但对主要参与胆固醇摄取的VLDLR相对表达量无明显影响。而生物信息学分析未能证实ABCA1及ABCG1基因调控序列中存在miRNA-638结合靶点[10],笔者推测miRNA-638可能通过间接影响ABCA1、ABCG1的表达量从而发挥对RCT过程的调控作用。虽然ABCG1和ABCA1能够协同介导细胞内胆固醇外流,但既往研究表明,高脂饮食喂养的外周巨噬细胞ABCG1特异性敲除LDL受体基因小鼠的动脉粥样硬化斑块发生率仅从33%提高至36%,且斑块大小与时间、ABCG1基因型密切相关,而外周巨噬细胞ABCA1特异性敲除LDL受体基因小鼠的动脉粥样硬化斑块发生率可增长2倍,故ABCA1对动脉粥样硬化斑块的影响更为明显[30]。
目前血脂管理指南将HDL-C视为评估ASCVD发生风险的重要指标,但因缺乏相关临床证据支持,尚未将其作为主要的药物干预靶点[21]。而关注HDL本身的功能及其相关的调控机制,尤其是HDL介导的RCT过程,或许比单纯提高HDL-C更有意义。
综上所述,miRNA-638可减少体外实验中ApoAI介导的巨噬细胞内胆固醇外流,其可能是通过调控ABCA1/ABCG1表达实现的,而miRNA-638调控ABCA1/ABCG1表达的具体机制以及对体内RCT的影响仍需进一步研究。
作者贡献:叶平进行文章的构思与设计,对文章整体负责、监督管理;韩婕、高登峰、邓捷进行研究的实施与可行性分析;韩婕进行数据收集,撰写论文;韩婕、王晓娜进行数据整理;王晓娜进行统计学处理;韩婕、曹瑞华进行结果的分析与解释;高登峰、邓捷、叶平进行论文的修订;高登峰、叶平负责文章的质量控制及审校。
本文无利益冲突。

