乙酰胆碱酯酶纳米胶囊的合成与稳定性研究
涂诚昭,雷美玲,陈庆平,叶 霖,3
1.北京理工大学材料学院,北京 100081;2.国民核生化灾害防护国家重点实验室,北京 102205;3.北京市结构可控先进功能材料与绿色应用重点实验室,北京 100081
乙酰胆碱酯酶(AChE)是生物神经传导中的一种关键性酶,能降解乙酰胆碱,终止神经递质对突触后膜的兴奋作用,保证神经信号在生物体内的正常传递。乙酰胆碱酯酶参与细胞的发育和成熟,能促进神经元发育和神经再生。有机磷化合物例如农药和化学武器在进入体内后能够迅速与体内的胆碱酯酶结合,使其丧失水解乙酰胆碱的功能,通过胆碱积聚引起严重的神经功能紊乱,特别是引起呼吸功能障碍,从而影响生命活动[1-3]。研究者利用这一特异性制备了非常灵敏的AChE 生物传感器,用于各类有机磷化合物的检测[4-5]。此外,还有学者利用AChE 修饰金纳米颗粒,将其与核酸适配体修饰的磁性纳米粒子组装,得到了用于检测Hg2+和Pb2+的生物传感检测器[6]。
相对于包括高效液相色谱法、气相色谱法、酶联免疫法和酶抑制法等在内的传统检测方法,基于AChE 的生物传感器检测技术因其快速、高效和低成本等优点,在有机磷化合物的检测领域具有良好的应用前景[7]。但是,和其他酶类似,AChE 也存在环境敏感、极易失活等缺点。因此,必须通过各种手段提高AChE 的稳定性,才能制备出可应用的AChE 生物传感检测器[8-12]。通过原位自由基聚合技术来制备蛋白纳米胶囊是一种固定化酶的新思路[13-15]。2006 年YAN 等[16]最先报道了以辣根过氧化物酶(HRP)作为目标蛋白,在蛋白表面原位聚合形成聚合物外壳,得到具有“核-壳”结构的酶纳米胶囊来提高酶稳定性的策略。随后,WEN 等[17-18]制备了有机磷水解酶(OPH)纳米胶囊,证明了纳米胶囊化可大大提高OPH 的热稳定性和有机溶剂稳定性。
本工作采用N-丙烯酰氧基琥珀酰亚胺(NAS)修饰AChE 并在其表面引入双键,然后再引发丙烯酰胺和N-(3-氨丙基)甲基丙烯酰胺的原位自由基聚合制备AChE 纳米胶囊,大大提高了AChE 的稳定性,非常适合应用于制备生物传感检测器。
1 实验部分
1.1 纳米胶囊化AChE 的制备
以下反应和处理如无特殊说明均在0~4 ℃的冰水浴中进行。将AChE 溶解在Tris 缓冲溶液(pH值为8.5,50 mmol/L)中,浓度为1 mg/mL,之后加入N-丙烯酰氧基琥珀酰亚胺(NAS)和1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDCI),磁力搅拌反应2 h,AChE,EDCI和NAS 投料质量比2:1:1。将反应后的溶液放入截流分子量为500 的透析袋中透析2 d,透析液为Tris 缓冲溶液。随后,按照表1 所示的投料比向已经丙烯酰化处理的酶溶液中加入单体丙烯酰胺(AAM)和N-(3-氨基丙基)甲基丙烯酸盐酸盐(APM),向溶液中缓慢通入氮气除氧,然后依次加入交联剂N,N'-亚甲基双丙烯酰胺(BIS)、引发剂过二硫酸铵(APS)和四甲基乙二胺(TEMED),引发自由基聚合反应,反应2 h。将反应溶液用Tris 缓冲溶液透析2 d,得到有机磷水解酶纳米胶囊。再透析2 d 除去未反应的原料,每隔6~8 h 换一次透析液,透析液为Tris-HCl 缓冲液(pH 值为8.5)。

表1 AChE 纳米胶囊的质量投料比Table 1 Feeding mass ratios of the AChE nanocapsules
1.2 动态光散射分析
将AChE 或nAChE 用Tris 缓冲液稀释至0.1 mg/mL。然后,各取1 mL 装入测试Zeta 电位专用的一次性样品池中,放入粒度分析仪和Zeta 电位分析仪中进行粒径和Zeta 电位测试。具体测试条件设置如下:温度25 ℃,选择测试样品为蛋白模式,采用系统默认最优化测试方式获取数据点,测试3次,取平均值。
1.3 酶活测定
称取0.04 g 5,5'-二硫代双(2-硝基苯甲酸)(DTNB)溶于10 mL Tris-HCl 缓冲液中,待DTNB 完全溶解后遮光保存。取0.5 mL DTNB 溶液,定容至50 mL 后混匀遮光保存。为防止溶液变质,要求现配现用。称取0.216 9 g 碘代硫代乙酰胆碱(底物,75 mmol/L)溶于10 mL 去离子水中,混合均匀。
准确称取0.012 g(0.1 mmol)L-半胱氨酸,定容至100 mL 得到L-半胱氨酸标准液。在试管中加入不同量的L-半胱氨酸标准液和Tris 缓冲液,总体积为2 mL。然后每管再加入2 mL 浓度为0.1 mol/mL的DTNB 溶液,用紫外分光光度计在412 nm 处测定L-半胱氨酸标准曲线。
吸取200 μL 酶液加入3 mL Tris 缓冲液中,混合均匀后在30 ℃下保温10 min。然后在混合液中加入600 μL 浓度为0.1 mol/mL 的DTNB 溶液与200 μL 浓度为75 mmol/L 的碘代硫代乙酰胆碱溶液,在412 nm 处每30 s 测一次吸光度变化,连续测试3 min,得到酶分解底物的动力学曲线。酶活定义为每分钟释放出1 μmol 半胱氨酸所需要的酶的物质的量。酶活性计算公式如式(1):
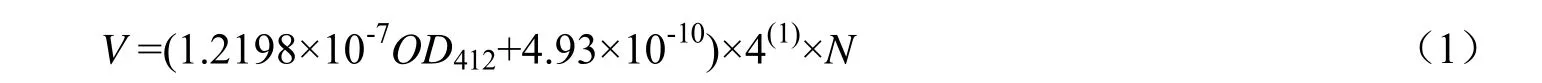
其中:V为酶活性,mol/(mg·min);OD412为412 nm紫外吸光度;4(1)为反应总体积,mL;N为酶液稀释倍数。
1.4 稳定性测试
将AChE 原酶和AChE 纳米胶囊分别用Tris-HCl 缓冲液配制成浓度为1 mg/mL 的酶液,每个样品分装装至已预热的离心管中,置于53 ℃烘箱。分别在20,40,60,80 和100 min 5 个时间点取样,按1.4 节的方法检测AChE 原酶和AChE 纳米胶囊的热稳定性。配制质量体积比为20%的DMSO(二甲基亚砜)的酶液,混合均匀后静置。分别在20,40,60,80 和100 min 5 个时间点取样,按1.3 节的方法检测AChE 原酶和AChE 纳米胶囊在含有机溶剂的溶液中的稳定性。
2 结果与讨论
2.1 AChE 纳米胶囊的制备与表征
AChE 表面含有大量胺基,通过NAS 可以将双键引入。随后,加入AAM 和APM 2 种单体和BIS交联剂引发其原位自由基聚合可以在AChE 表面形成聚合物外壳,即得到AChE 纳米胶囊。由于聚合物外壳的保护作用,所得到的AChE 酶具有包括热稳定性和有机溶剂稳定性在内的更好的环境稳定性,更适合在生物传感检测器中应用。
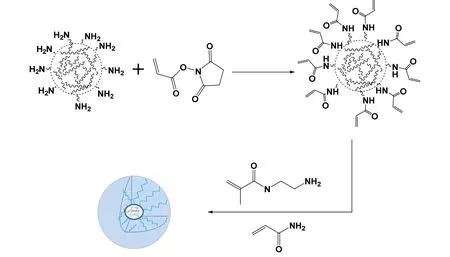
图1 原位自由基聚合制备AChE 纳米胶囊Fig.1 Preparation of AChE nanocapsules by in-situ radical polymerization
在纳米胶囊的制备过程中,随着聚合的进行,单体逐渐在酶表面聚合成分子链,通过交联剂的作用将分子链连接成三维网络结构,最终在酶表面形成一个聚合物外壳,使得酶的粒径变大。取10 μL AChE和AChE 纳米胶囊酶液滴于铜网上,自然风干后用磷钨酸染色,再次风干后置于透射电镜(TEM)下观察微观形貌,照片如图2 所示。从TEM 照片来看,AChE 原酶的尺寸在30 nm 左右,纳米胶囊包覆后AChEn1 的尺寸增长到70 nm 左右。在AChEn1 的图中能观察到外围浅、内核深的核壳结构,说明在AChE 的表面形成了聚合物外壳。且每个纳米胶囊中,颜色较深的内核尺寸约为30 nm,说明每个胶囊中只含有一个AChE 分子。
图3 为DLS 测得的AChE 和AChE 纳米胶囊的粒径尺寸和表面电势。由图可知,AChE 原酶的粒径在55 nm 左右,而各组AChE 纳米胶囊的粒径均增长至100 nm 左右。相比于TEM 结果,AChE 和AChEn1 的尺寸都相应的增大一些,原因可能是在铜网上制样风干后,聚合物外层干燥收缩严重,测得的尺寸比在水溶液中的尺寸小。但两个结果都能说明纳米胶囊化后AChE 的尺寸有所增大。从AChEn1 到AChEn3,两种单体和交联剂的投料比逐渐增加,增加单体投料量会同步增加纳米胶囊外壳的分子量,即增厚外壳;而增加交联剂投料量则会增加外壳的交联程度。交联程度的增加会使得外壳越来越致密并影响外壳在水溶液中的溶解性和舒展程度。较高的交联程度使得AChEn3 的外壳在水溶液中比较致密而不舒展,导致DLS测得其粒径相对于AChEn1和AChEn2更小一些。AchEn3,AchEn4和AchEn5 之间总单体投料比相同但单体组成不同。图3(a)中AchEn3 和AchEn5 的数据非常接近,相互之间并不存在统计学差异。AchEn4 尺寸稍大则可能与其中APM 投料比最高有关。APM 分子尺寸较大且水溶性良好,因此APM 含量较多的纳米胶囊具有较厚和舒展的外壳,DLS 测得的粒径也会相对大一些。

图2 AChE(a)和AChE 纳米胶囊(b)的TEM 照片Fig.2 TEM images of AChE (a) and AChE nanocapsules (b)

图3 AChE 和AChE 纳米胶囊的尺寸(a)和表面电势(b)Fig.3 Size (a) and surface potential (b) of AChE and AChE nanocapsules
在碱性的Tris 缓冲液中,溶液pH 值大于AChE 的等电点,抑制其表面氨基吸收质子,促进羧基电离,使得表面电势为负值。而由于在纳米胶囊化的过程中所加入的两种单体AAM 和APM 带正电,聚合完成后其外壳也应该是带正电的。因此,AChE 纳米胶囊的表面应该为正电势。由此,图3(b)中AChE 纳米胶囊的正电势也进一步证明了聚合物外壳的形成和纳米胶囊的成功制备。
2.2 AChE 纳米胶囊的酶活测定
AChE 纳米胶囊的酶活测定结果见图4。从图中可以看出,与AChE 原酶[酶活225 nmol/(mg·min)]相比,各组纳米胶囊化的酶活保留率达到91.6%以上。由于酶的环境敏感性,纳米胶囊化过程会造成一定酶活的损失。导致酶活损失的环境因素可分为两大类,一类是由温度和溶液状态等非反应因素,纳米胶囊化过程中的反应温度是0~4 ℃,AChE 始终处于溶液而非冻存状态下,会导致一定的酶活损失;另一类则是纳米胶囊化的反应因素,包括加入的各种试剂以及透析、搅拌等反应操作。为进一步理清这两大类环境因素对酶活的影响,设置了一个对照组AChE-c,将其与参加反应的AChE置于相同的环境下但不向其中加入任何的反应试剂,测定AChE-c 的酶活可以反映出非反应因素对酶活的影响。由图可知,AChE-c 的酶活保留率约为92%[207 nmol/(mg·min)]。这一数值与各组纳米胶囊化的酶活保留率基本相当。说明本工作采用的纳米胶囊化过程十分温和,反应本身对酶活的影响很小,各组AChE 纳米胶囊的酶活损失主要是由温度和溶液状态等纳米胶囊化过程中的非反应因素所导致的。较小的酶活损失可以保证AChE 纳米胶囊在生物传感检测领域的广泛应用。
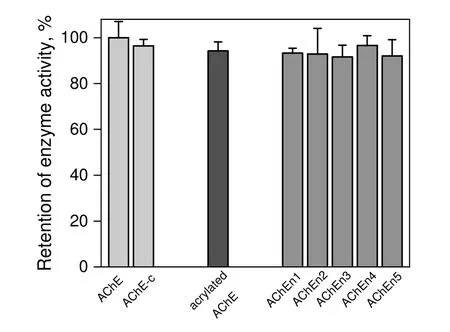
图4 AChE 纳米胶囊的酶活保留率Fig.4 Retention of enzyme activity of AChE nanocapsules
2.3 AChE 纳米胶囊的稳定性
生物传感检测器在实际应用中会遇到许多包括高温、有机溶剂在内的严苛环境。为了保证其能够在严苛环境下正常使用,要求酶在严苛环境中具有相当高的稳定性。分别考察了AChE 纳米胶囊的热稳定性和有机溶剂稳定性,结果如图5 和6 所示。

图5 不同单体投料量(a)和不同单体投料比(b)的AChE 纳米胶囊在53 ℃环境中酶活的变化Fig.5 Changes of enzyme activity of AChE nanocapsules with different monomer feeding amount (a) and feed ratios (b) at 53 ℃
图5(a)给出了不同单体投料量的AChE 纳米胶囊的热稳定性。从AChEn1 到AChEn3,两种单体和交联剂与AChE 的投料比逐渐增加,这也就意味着这3 种纳米胶囊外壳的厚度和致密程度都在不断增加。从图中可以看出,未包覆的AChE 在53 ℃的环境中,酶活随时间的变化下降迅速,60 min内下降至原始酶活的82%,100 min 后已下降至66%。而经过包覆后的酶的活性下降较为平缓,在40 min内酶活下降很小,酶活保留率仍为95%左右。在100 min 后,AChEn1,AChEn2 和AChEn3 的酶活分别为为161,176 和189 nmol/(mg·min),酶活保留率分别为75%,83%和89%。
在加热条件下,AChE 纳米胶囊的酶活远高于AChE 原酶,说明纳米胶囊的聚合物外壳起到了保护作用,使得加热时蛋白质的结构不被破坏。说明相对于AChE 原酶,AChE 纳米胶囊具有更好的热稳定性。此外,图中还可以看出,从AChEn1 到AChEn3,酶活保留率随着聚合物外壳的的厚度和致密程度不断提高,表明更厚和更致密的聚合物外壳具有更好的热稳定性。图5(b)给出了不同组成的AChE 纳米胶囊的在加热条件下的酶活保留率,从图中可以看出,3 种不同组成的AChE 纳米胶囊AChEn3,AChEn4 和AChEn5 在不同时间点的酶活保留率都远高于AChE 原酶,但相互之间数值接近,几乎无差异。这也从另一个角度说明AChE 纳米胶囊热稳定性的提高主要来自其聚合物外壳的隔热作用。因为当总投料比一致的情况下,组成的变化对聚合物外壳致密程度影响不大。
图6(a)为不同单体投料比的AChE 纳米胶囊在DMSO 中的有机溶剂稳定性考察结果。由图可知,在20%DMSO溶液中静置100 min后AChE原酶的酶活保留率可降至初始值[139 nmol/(mg·min)]的60%,而AChE 纳米胶囊的酶活保留率明显高于AChE 原酶。AChEn1,AChEn2 和AChEn3 的酶活分别为143,157 和177 nmol/(mg·min),酶活保留率为初始值的67%,74%和83%。说明AChE 纳米胶囊相比AChE 原酶具有更高的有机溶剂稳定性。而与热稳定性的规律相似,随着投料比的增加,从AChEn1到AChEn3,酶活保留率不断提高,说明更致密的聚合物外壳具有更好的有机溶剂稳定性。图6(b)为不同组成的AChE 纳米胶囊AChEn3,AChEn4 和AChEn5 在20%DMSO 中的酶活保留率,可看到3 种不同组成的AChE 纳米胶囊在不同时间点的酶活保留率都远高于AChE 原酶,但相互之间数值几乎无差异,说明了AChE 纳米胶囊有机溶剂稳定性的提高主要来自其聚合物外壳的物理隔绝作用,组成的变化对有机溶剂稳定性的影响不大。
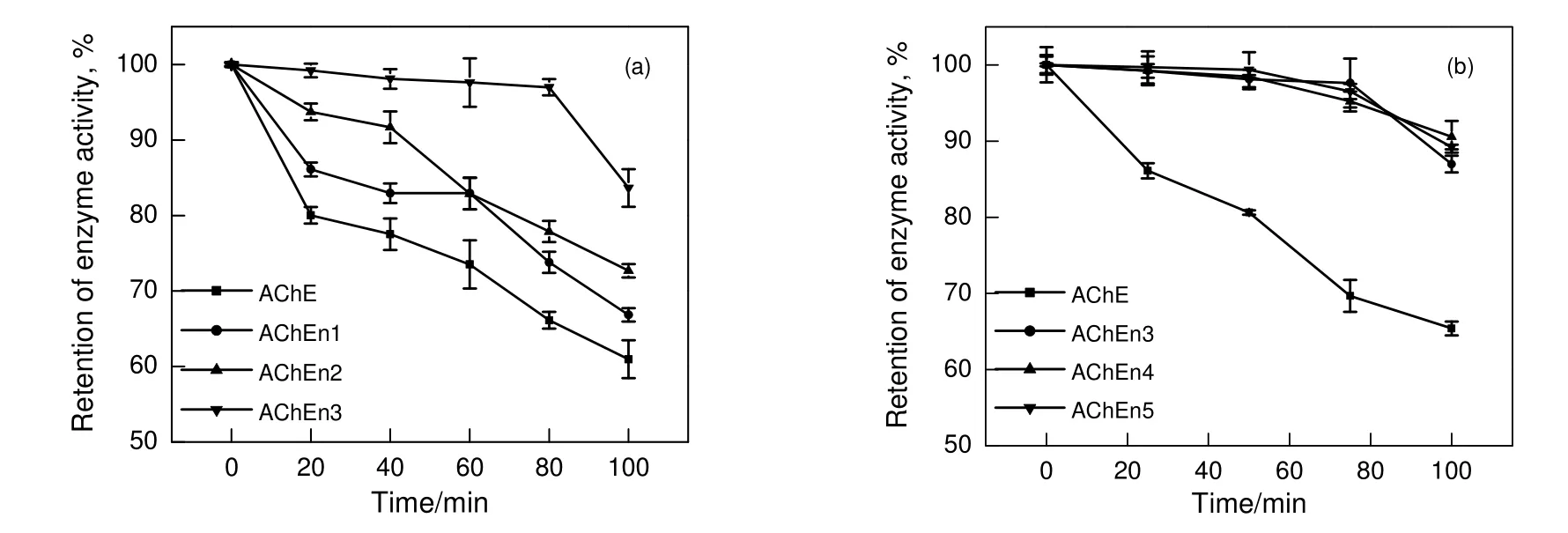
图6 不同壳层厚度(a)和不同单体投料比(b)的AChE 纳米胶囊在20%DMSO 中酶活的变化Fig.6 Changes of enzyme activity of AChE nanocapsules with different shell thickness (a)and monomer feed ratios (b) in 20%DMSO
3 结 论
本工作通过两步法,即先对AChE 进行丙烯酰化修饰,然后再采用原位自由基聚合的方式,制备了具有聚合物外壳的AChE 纳米胶囊。动态激光光散射结果表明AChE 尺寸明显增大,其表面电势也由负转正,证明了AChE 纳米胶囊的成功制备。酶活测试结果表明,AChE 纳米胶囊的酶活保留率可以达到AChE 原酶的90%以上。而稳定性实验则显示,AChE 纳米胶囊具有远高于AChE 原酶的热稳定性和有机溶剂稳定性。以上结果表明,AChE 纳米胶囊在生物传感检测领域具有应用的良好前景。

