临床前类风湿关节炎人群肠道菌群对造血和免疫系统影响的研究①
胡 丹 罗玉斌 赵 毅 刘 毅 (西南医科大学附属医院风湿免疫科,泸州 646000)
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性系统性自身免疫性疾病,全球发病率为0.5%~1%[1],目前发病机制尚不十分明确。许多研究学者认为主要与针对自身细胞结构的自身抗体生成相关,且这些抗体可在未出现关节炎临床症状之前数年出现于患者血液中,提示触发类风湿关节炎自身免疫的首发部位可能存在于关节外的其他黏膜部位,比如胃肠道或呼吸道[2]。欧洲抗风湿病联盟2012年提出将RA相关遗传风险因素阶段、RA相关环境因素阶段、RA相关系统性自身免疫阶段、无临床关节炎症状阶段总称为RA临床前期,即Pre-RA[3]。有研究表明Pre-RA在无自身免疫性组织损伤情况下已存在免疫反应异常,如自身抗体(抗CCP抗体)水平异常,在遗传和环境因素相互作用下启动自身免疫反应,最终导致组织炎症和损伤[4,5]。近年抗CCP抗体在黏膜免疫中的作用也受到人们的广泛关注。有研究表明RA的始动源于机体黏膜系统,可在患者唾液中检测到IgA型抗CCP抗体,表明口腔黏膜可能发生了局限性的抗环瓜氨酸肽反应(ACPA)[6,7]。故本实验拟探究抗CCP抗体增加的人群其肠道菌群是否会影响肠道黏膜屏障和免疫系统。
1 材料与方法
1.1材料
1.1.1试剂 FITC-conjugated dextran购于Sigma,SYTOTMBC Green Fluorescent Nucleic Acid Stain购于Thermo Fisher Scientific,PE anti-mouse IgA Antibody、Anti-Mouse CD19 APC、Ly6G:PerCP/cy5.5、BV421 Anti-Mouse CD127、PERCP-CY5.5 Anti-Mouse CD16/CD32、Anti-Mouse CD34 APC、PE CD117(ckit)mouse、Anti-Mouse Lineage FITC、PECY7 Anti-Mouse LY-6A/E(SCA-1)等抗体购于eBioscience公司。
1.1.2仪器 多功能荧光酶标仪购于BioTek公司,TCL-16高速离心机购于湘仪公司,流式分析分选仪购于BD公司,Leica病理图像定量分析系统购于Leica。
1.1.3小鼠 6~8周龄DBA雌性小鼠,体重18~20 g,来源于四川大学华西临床医学动物实验中心。
1.2方法
1.2.1菌液制备 2017年 11月至 2018年3月间在四川大学华西医院风湿免疫科共收集45份粪便标本,其中 RA 患者组25份,ACPAs阳性健康人群组10份,健康对照组10份; 采样时尽量做到早晨空腹收集标本,并保证环境清洁干燥,存放于-80℃冰箱。从-80℃冰箱取出粪便,放置于超净台,称取0.6 g于5 ml EP管中。取1 ml 1×PBS于EP管中溶解粪便。向其中加入已消毒的磁珠,放置于振荡器上充分振荡搅匀。800 g离心3 min,取上清液用70 μm 的滤网过滤。得到的上清液用1×PBS稀释成呈3 ml。
1.2.2抗生素处理小鼠 菌群移植前3 d,灌胃给予每只小鼠200 μl抗生素 (Vancomycin HLC、Neomycin sulfate、Metronidazole、Ampicillin),连续处理3 d。
1.2.3菌群移植小鼠的建立 ①将29只抗生素处理过的DBA雌性小鼠分成三组,分别记为A组、B组、C组。A组(9只)为健康对照菌群移植组,B组(9只)为Pre-RA菌群移植组,C组(11只)为RA菌群移植组。②菌液保存在-80℃冰箱中,移植过程中需保存在冰袋中,移植当天记为第1天。③抗生素处理连续处理3 d后,每组分别灌胃给予菌液100 μl,隔一天移植一次。④在第14天,将A组、B组、C组禁食禁水4 h后灌胃给予FITC-conjugated dextran(0.6 g/mg)。4 h后小鼠进行麻醉,腹腔注射水合氯醛约150~200 μl/只。⑤留取标本:外周血用于检测中性粒细胞比例,而血清用于检测肠道通透性,脾脏用于B细胞检测。骨髓细胞用于骨髓干细胞、B细胞、中性粒细胞检测;小肠用于HE染色;粪便用于流式检测肠道细菌包裹的SIgA;肠系膜淋巴结、腹股沟淋巴结、派氏淋巴结用于检测B细胞。
1.2.4多功能荧光酶标仪检测血清中FITC荧光强度(肠道通透性) 取100 μl的血清加入黑色96孔板,每组2个复孔,避光,每孔加入100 μl的PBS,轻轻吹打混匀,上机检测血清中FITC荧光强度。
1.2.5粪便中肠道菌群IgA检测 取1.2.2中50 mg 粪便标本于5 ml EP管中,加1 ml含有1%BSA的PBS溶液,4℃孵育1 h。将磁珠放入EP管中,放在振荡器上振荡搅匀,运行30 s,待其充分搅匀后离心10 min,吸取上清液,至新的离心管中。加入含有1%BSA的PBS溶液使样品总体积为 1 ml,800 g离心5 min,弃去上清液,重复1次。再将1∶20 稀释好的抗小鼠IgA抗体或同型对照50 μl样品悬液中,避光4℃孵育20 min。加入1 000 μl含有1%BSA的PBS溶液,800 g 离心5 min,洗2次。然后将1∶400稀释好的SYTO BC加入100 μl样品悬液中,避光室温孵育5 min。加入1 000 μl含有1%BSA的PBS溶液,800 g 离心5 min,洗1次。加入100 μl 含有1%BSA的PBS溶液和100 μl 8%多聚甲醛重悬样品后上流式仪检测。
1.2.6流式细胞术检测不同部位淋巴结B细胞 将取出的淋巴结置于盛有PBS的培养皿中。淋巴结转移到70 μm的筛网上,将筛网置于50 ml的离心管口,用5 ml注射器芯轻轻研磨淋巴结,不断从培养皿中吸取PBS冲洗筛网。3 000 r/min离心5 min,弃上清。加入PBS轻轻吹打重悬细胞,分别取100 μl的细胞悬液于2管流式管中。抗体CD19检测B细胞,4℃孵育20 min。BSA 200 μl/管,打匀,1 400 r/min离心5 min,倒掉上清,剩余50 μl,上机检测。
1.2.7流式检测骨髓干细胞、B细胞、中性粒细胞 分别取100 μl的骨髓细胞悬液于3管流式细胞管中,2 000 r/min离心5 min,弃上清。用Lin、Scal、c-kit、CD127、CD16/32、CD34检测骨髓干细胞。用CD19检测B细胞,Ly6G检测中性粒细胞,避光4℃ 20 min。加入BSA 200 μl 清洗抗体,2 000 r/min 离心5 min,倒掉上清,剩余50 μl,上机检测。
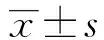
2 结果
2.1菌群移植后肠黏膜屏障及肠道通透性的改变 移植Pre-RA和RA人群菌液组小鼠肠道通透性明显高于健康对照组,差异具有统计学意义(P<0.05)(图1A)。同时,组织学HE染色发现移植Pre-RA和RA人群菌液组小鼠肠道黏膜受损,绒毛发育不良,且绒毛间间隙增宽,进一步证实肠道黏膜屏障被破坏(图1B),可致菌群及其代谢毒素可易位,影响机体健康。
2.2菌群移植后肠道SIgA包裹细菌的变化情况 肠内容物中SIgA的含量越高表明肠道中需要被中和的细菌就越多。实验结果显示,移植Pre-RA和RA人群菌液后,小鼠肠内容物中SIgA包裹细菌的含量不断增加,且与移植健康对照组人群菌液相比差异具有统计学意义(P<0.05)。如图2。
2.3菌群移植后骨髓造血干细胞及前体细胞的改变情况 结果表明,Pre-RA和RA人群肠道菌群主要影响髓系祖细胞(CMP)和粒单核细胞系祖细胞(GMP)。移植菌群后,移植Pre-RA和RA人群菌液组小鼠CMP和GMP均高于健康对照组,且移植RA人群菌液组差异具有统计学意义(P<0.05)。如图3。
2.4菌群移植后外周血中性粒细胞的表达水平 由图3可知Pre-RA和RA菌群移植组小鼠骨髓中粒单核细胞系祖细胞(GMP)增多,进一步观察GMP分化成熟后的重要细胞类型即中性粒细胞的变化情况结果如图4所示,移植Pre-RA和RA人群菌液组与健康对照组相比,小鼠外周血中性粒细胞也呈现相应增加的趋势,且移植RA人群菌液组差异具有统计学意义(P<0.05)。

图1 肠道通透性和小肠结构变化Fig.1 Intestinal permeability and small intestine struct-ure of miceNote: A.Fluorescence intensity.B.HE staining of small intestine.*.P<0.05.

图2 小鼠粪便中SIgA包裹细菌的表达Fig.2 Expression of SIgA-encapsulated bacteria in mice fecesNote: *.P<0.05.

图3 造血干细胞及各类前体细胞在骨髓中的比例Fig.3 Proportion of hematopoietic stem cells and various precursor cells in bone marrowNote: *.P<0.05.

图4 小鼠外周血中性粒细胞比例Fig.4 Peripheral blood neutrophil ratio in miceNote: *.P<0.05.
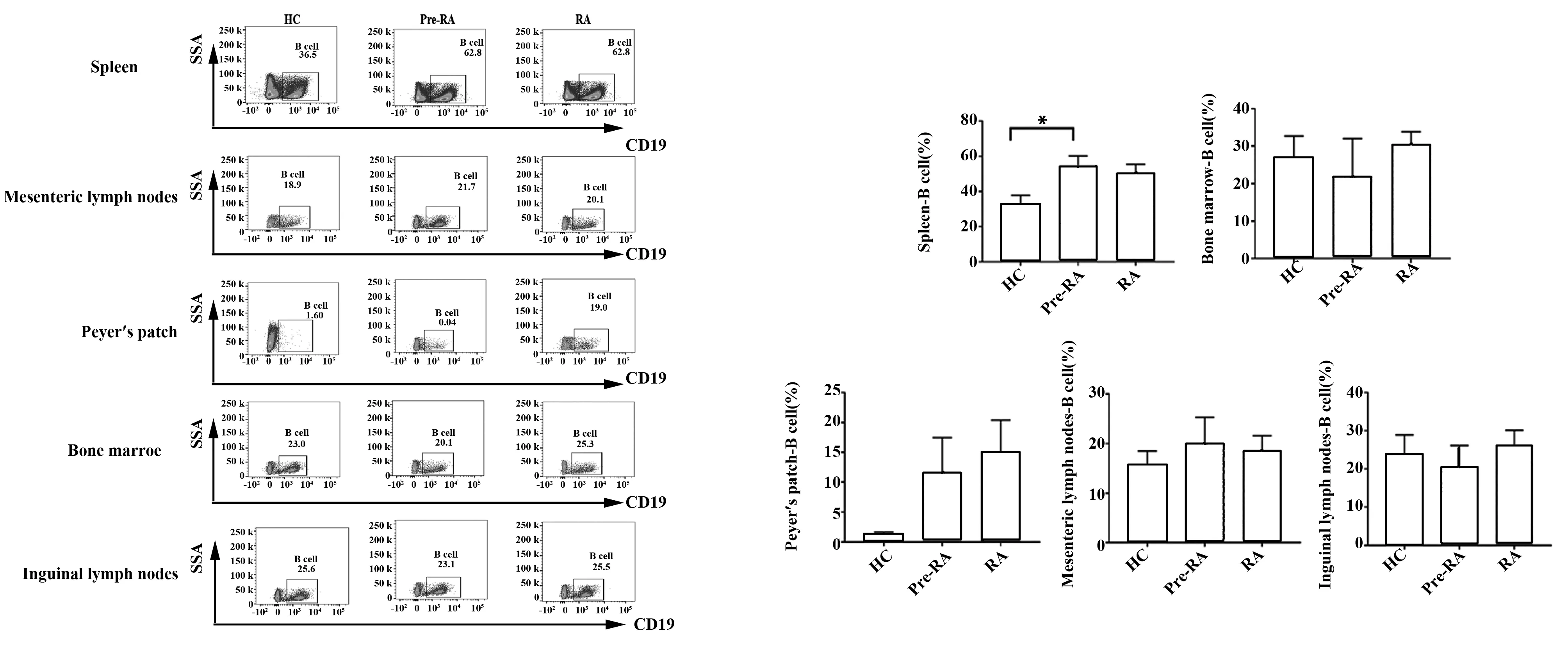
图5 不同免疫器官中B淋巴细胞的表达Fig.5 Expression of B lymphocytes in different immune organsNote: *.P<0.05.
2.5菌群移植后不同免疫器官中B细胞的表达情况 对脾脏、骨髓、派氏淋巴结、肠系膜淋巴结、腹股沟淋巴结等部位B淋巴细胞的比例进行了检测。与移植健康人群菌液对照组小鼠相比 ,移植Pre-RA和RA人群菌液组小鼠脾脏B淋巴细胞增加,且差异有统计学意义(P<0.05)。而在小鼠派氏淋巴结部位,移植Pre-RA和RA人群菌液组小鼠B淋巴细胞较移植健康人群菌液对照组小鼠有升高趋势,但差异无统计学意义(P>0.05),如图5。
3 讨论
在易患RA的个体中,环境因素是诱发RA的重要因素之一。作为抗原来源的细菌和病毒成分可能诱导RA的发生,因此近年来它们作为潜在的致病因子备受人们关注。然而,迄今为止还没有确凿的证据表明微生物与RA的因果关系。
多种基因测序技术证实,RA患者肠道嗜血杆菌减少,乳杆菌丰度增加且这种改变与疾病的活动度以及自身抗体滴度相关,提示肠道菌群在RA发病中起着重要的作用[8]。抗CCP抗体或RF阳性在RA发病前十年即可检出,而体外研究发现肠道菌群紊乱持续刺激机体可导致RF分泌增加[9],表明抗CCP抗体或RF因子阳性而无关节炎症状的个体中,肠道菌群紊乱可持续存在并可能通过影响机体免疫系统反应,介导RA的发生[10]。前期研究证实在RA组、Pre-RA组、健康对照组三组中,肠道菌群发生了变化,在RA组普雷沃氏菌丰度增加,其中 Peptococcaceae、Gastranaerophilales、Coriobacteriaceae 等菌是和Pre-RA组共有的,两组的益生菌属Lachnoclostridium 菌属丰度明显低于健康对照组。
本研究发现来自Pre-RA和RA人群的肠道微生物导致小鼠肠道黏膜通透性增加及黏膜免疫反应失衡,说明可能RA相关的自身免疫和生物标志物的改变可能起源于黏膜部位,进而引起免疫系统失衡。有研究显示特定黏膜位点的改变表明微生物因子可能会影响黏膜免疫反应,这在RA的早期发病机制中起着重要作用[11]。黏膜造成一定的破坏,使肠道黏膜通透性增加,引起菌群移位,在疾病的发展过程中起着诱导作用。
在内外源性不同抗原刺激肠道黏膜时,肠道黏膜会产生大量的分泌型SIgA,抑制病原体黏附于肠上皮的表面,阻止病原体与肠黏膜穿透进入肠道屏障,中和毒素且包裹有害病原体抗原。AS大鼠模型中肠道菌群失调,粪便中SIgA是由肠道中大量的细菌持续刺激肠黏膜后产生的,因此SIgA包裹细菌的表达能间接反映出肠道致病菌的数量[12]。本实验与此结论相同,发现与健康对照组相比,移植Pre-RA人群肠道菌群的小鼠肠道屏障中SIgA的分泌增加,且RA组SIgA更高,因此失调的肠道菌群可通过一系列适应性反应激活产生SIgA的B淋巴细胞,最终导致SIgA的分泌增加,分泌的SIgA会进一步包裹肠道中致病菌,阻止其与肠道黏膜接触定植,避免对免疫系统的激活,故肠内容物中SIgA包裹细菌的表达量增加。同时本实验发现RA人群的菌群移植后CMP和GMP水平增加,外周血中性粒细胞增多,说明肠道菌群可通过影响造血干细胞及其前体细胞的发育而影响免疫细胞的早期发育。
Pre-RA阶段自身反应性B淋巴细胞是免疫系统最明显的改变,因为由其分泌的ACPA在Pre-RA阶段即有异常[13]。B淋巴细胞存在于肠道相关淋巴组织中,包括派氏淋巴结、肠系膜淋巴结等。肠道微生物抗原和微生物代谢产物(SCFAs)会促进黏膜及其他部位浆细胞的分化,促进IgA的分泌[14]。在一项随机双盲试验中发现单次向RA高风险人群注射1 000 mg利妥昔单抗,造成B淋巴细胞的耗竭可延缓RA疾病的发展过程,说明B淋巴细胞在临床前阶段(Pre-RA)发病机制中发挥重要作用[15]。而本实验结果与此实验结论相符,Pre-RA和RA组脾脏和派氏淋巴结部位B淋巴细胞明显增加。 抗CCP抗体阳性的Pre-RA和RA人群的肠道菌群不断刺激小鼠肠道黏膜,引起黏膜免疫反应,可通过外来抗原激活B淋巴细胞活化相关受体及其代谢产物直接调节B淋巴细胞活化,也可通过肠道上皮细胞、T淋巴细胞、骨髓细胞间接调节B淋巴细胞分化,导致派氏淋巴结和脾脏中B淋巴细胞增加。
此外,由于本实验样本量较少,还需扩大样本进一步研究肠道菌群对外周免疫器官T细胞及T细胞亚型的影响,本研究只是初步探讨肠道菌群在Pre-RA阶段发展为RA阶段的发病机制。
综述所述,Pre-RA和RA人群肠道菌群使小鼠肠道黏膜通透性增加,引起肠道局部黏膜免疫反应,导致肠内容物中SIgA的分泌增加,且派氏淋巴结和脾脏中B淋巴细胞增加。肠道微生物已被证明在RA中发挥重要作用,尽管它们之间关联的机制仍不明确,但本实验说明肠道微生物在RA早期起着促进疾病发展的作用,为今后治疗RA提供了新的思路。

