鹿血晶增强巨噬细胞抗黑色素瘤作用及其机制研究①
潘宇晨 李京蔓 李 丹 窦 环 侯亚义 (南京大学医学院,南京 210093)
恶性黑色素瘤是最严重的一种皮肤癌,难以根治。尽管免疫检查点的发现推动了肿瘤免疫疗法的进步,但肿瘤免疫疗法仍有很多不足之处[1,2]。个体化的肿瘤疫苗提高了肿瘤的治疗效果,并有效地防止其复发[3],但由于制备时间久、成本较高,其应用受到较大限制。因此,开发更有效更经济的方法来辅助治疗黑色素瘤是非常重要的。
巨噬细胞是固有免疫系统中被广泛研究的具有异质性的细胞,是机体抵抗感染的重要组成部分。巨噬细胞通过分泌炎症因子[如肿瘤坏死因子(TNF-α)]、产生氧化应激反应(如产生一氧化氮、活性氧等)能够抑制肿瘤的生长、转移,并通过吞噬作用消除恶性肿瘤细胞[4]。先前的实验发现,活化巨噬细胞并促进其向促炎的M1型极化有利于黑色素瘤小鼠的治疗[5]。
鹿血晶(deer blood crystal,DBC)由鹿血制得,富含多糖、氨基酸、微量元素等。近年来发现鹿血具有治疗贫血、调节免疫、抗肿瘤、延缓衰老、改善记忆、抗疲劳、改善性功能等多种治疗保健作用[6]。本文旨在研究鹿血晶对巨噬细胞杀伤黑色素瘤的影响及潜在的分子机制,为临床中药联合肿瘤治疗的应用提供参考。
1 材料与方法
1.1材料 鹿血晶冻干粉来自苏州红冠庄国药股份有限公司(批号:S1810012);B16F10细胞株和Raw264.7细胞株购自中国科学院细胞库;DMEM高糖培养基、胎牛血清、胰酶、双抗均购自上海基峰生物科技有限公司;CCK8试剂盒购自日本同仁化学研究所;凋亡试剂盒、RNA反转录试剂盒购自南京诺唯赞生物科技有限公司;Trizol、qRT-PCR mix购自赛默飞世尔科技有限公司(Thermo Fisher Scientific);NO试剂盒购自碧云天生物技术有限公司;IL-1β、IL-6、TNF-α ELISA检测试剂盒购自达科为生物技术有限公司;β-actin、p-S6、S6、p-4EBP、4EBP抗体购自CST公司(Cell Signaling Technology);兔二抗购自碧云天生物技术有限公司,流式抗体F4/80购自福麦斯生物技术有限公司。
1.2方法
1.2.1细胞培养 Raw264.7及B16F10细胞均种于90% DMEM+10% 胎牛血清的培养基中,5% CO2、37℃培养箱中培养。
1.2.2CCK8检测 取100 μl 细胞悬液加至96孔板,培养过夜。细胞贴壁后加不同浓度的鹿血晶溶液或巨噬细胞培养上清培养,24 h后弃上清并用无菌PBS洗板3次,每孔加90% DMEM+10% CCK8溶液100 μl,培养箱中培养至颜色变橙,酶标仪测定450 nm处吸光值(A450)。细胞活力计算方式:细胞活力指数=[A450(加药)-A450(空白)]/[A450(未加药)-A450(空白)]。
1.2.3RNA提取与qRT-PCR 根据说明书使用Trizol法提取总RNA,按照反转录试剂盒说明书进行反转录。以β-actin为内参,各基因相对表达量由公式2-ΔΔCt计算得出。
1.2.4流式细胞术 B16F10-GFP与Raw264.7以2∶1比例铺板,贴壁后加不同浓度鹿血晶处理24 h,胰酶消化并收集细胞,4℃,1 500 r/min离心5 min,弃上清,PBS洗2次,加F4/80抗体避光孵育15 min,加1 ml PBS清洗1遍,上机检测。凋亡检测按照试剂盒说明书进行操作。
1.2.5蛋白印迹实验 收集细胞,加RIPA细胞裂解液,冰上裂解15~30 min,4℃,12 000 r/min离心10 min,取上清。BCA法检测上清总含量,加相应体积5×蛋白上样缓冲液,混匀后,99℃金属浴10 min。蛋白保存至-80℃冰箱或冷却至室温上样。等量蛋白样品使用15%聚丙酰胺凝胶电泳分离,转移至PVDF膜,5% BSA-TBST缓冲液室温封闭1 h,一抗4℃摇床孵育过夜,二抗室温孵育2 h,TBST洗膜3次,每次10 min。移至曝光仪中,加曝光液显影并拍照。
1.2.6ELISA实验 收集不同组细胞上清,按照ELISA试剂盒说明书步骤操作,酶标仪检测各孔450 nm处吸光度值,利用标曲计算出NO和各炎症因子的含量。
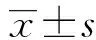
2 结果
2.1鹿血晶处理巨噬细胞后其上清降低黑色素瘤细胞活力 单加鹿血晶低(250 mg/ml)、中(500 mg/ml)、高(1 000 mg/ml)三个浓度均略微增强B16F10的细胞活力,不加鹿血晶的巨噬细胞培养上清对B16F10细胞活力影响不大,而加了鹿血晶之后巨噬细胞的培养上清能够显著抑制B16F10的细胞活力(P<0.05)(图1)。
2.2鹿血晶处理巨噬细胞后其上清促进黑色素瘤细胞凋亡 流式细胞术结果表明,单独鹿血晶能够促进B16F10早期凋亡,不影响其晚期凋亡(图2A~C),而中、高浓度鹿血晶处理后的巨噬细胞上清显著提高B16F10的早期凋亡和晚期凋亡(P<0.05)(图2D~F)。
2.3鹿血晶促进巨噬细胞吞噬黑色素瘤细胞 巨噬细胞Raw264.7与带GFP荧光标签的B16F10共培后,流式细胞术结果显示,不同浓度鹿血晶处理组巨噬细胞(F4/80+)的绿色荧光平均荧光强度高于对照组,结果显示鹿血晶能够显著促进巨噬细胞对黑色素瘤细胞的吞噬作用,且呈剂量依赖性(P<0.05)(图3)。
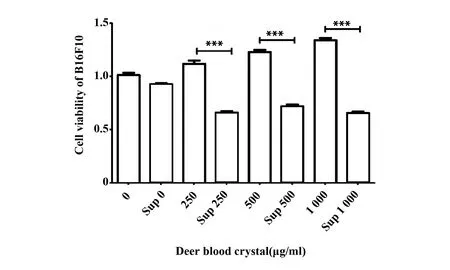
图1 鹿血晶处理后巨噬细胞培养上清抑制B16F10细胞活力Fig.1 Supernatant of Raw264.7 treated with Deer blood crystal inhibits the cell viability of B16F10Note: Sup.Supernatant of Raw264.7 cells.Data are shown as
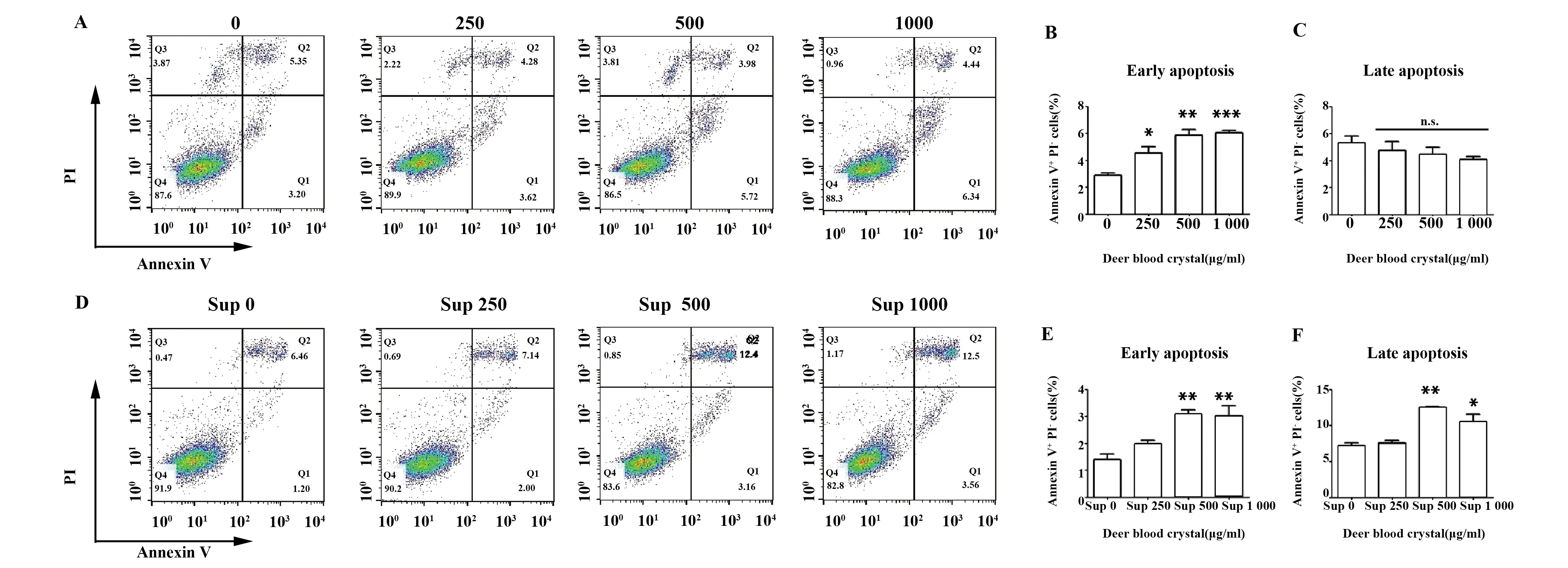
图2 鹿血晶处理后巨噬细胞培养上清促进B16F10细胞凋亡Fig.2 Supernatant of Raw264.7 treated with Deer blood crystal promotes apoptosis of B16F10Note: Sup:supernatant of Raw264.7 cells.Data are shown as (n=3).*.P<0.05;**.P<0.01;***.P<0.001.

图3 鹿血晶促进巨噬细胞吞噬B16F10细胞Fig.3 Deer blood crystal promotes phagocytosis of Raw264.7 to B16F10Note: Data are shown as
2.4鹿血晶促进巨噬细胞分泌炎症因子 结果显示,低、中、高浓度的鹿血晶均能够显著上调巨噬细胞活力(图4A)。鹿血晶处理后的巨噬细胞形态发生了变化,胞体增大、伪足伸长、呈树突状,且随鹿血晶浓度的增高巨噬细胞形态变化越明显(图4B),说明鹿血晶能够激活巨噬细胞向炎症形态变化。流式细胞术结果显示,鹿血晶不会促进巨噬细胞发生凋亡(图4C)。
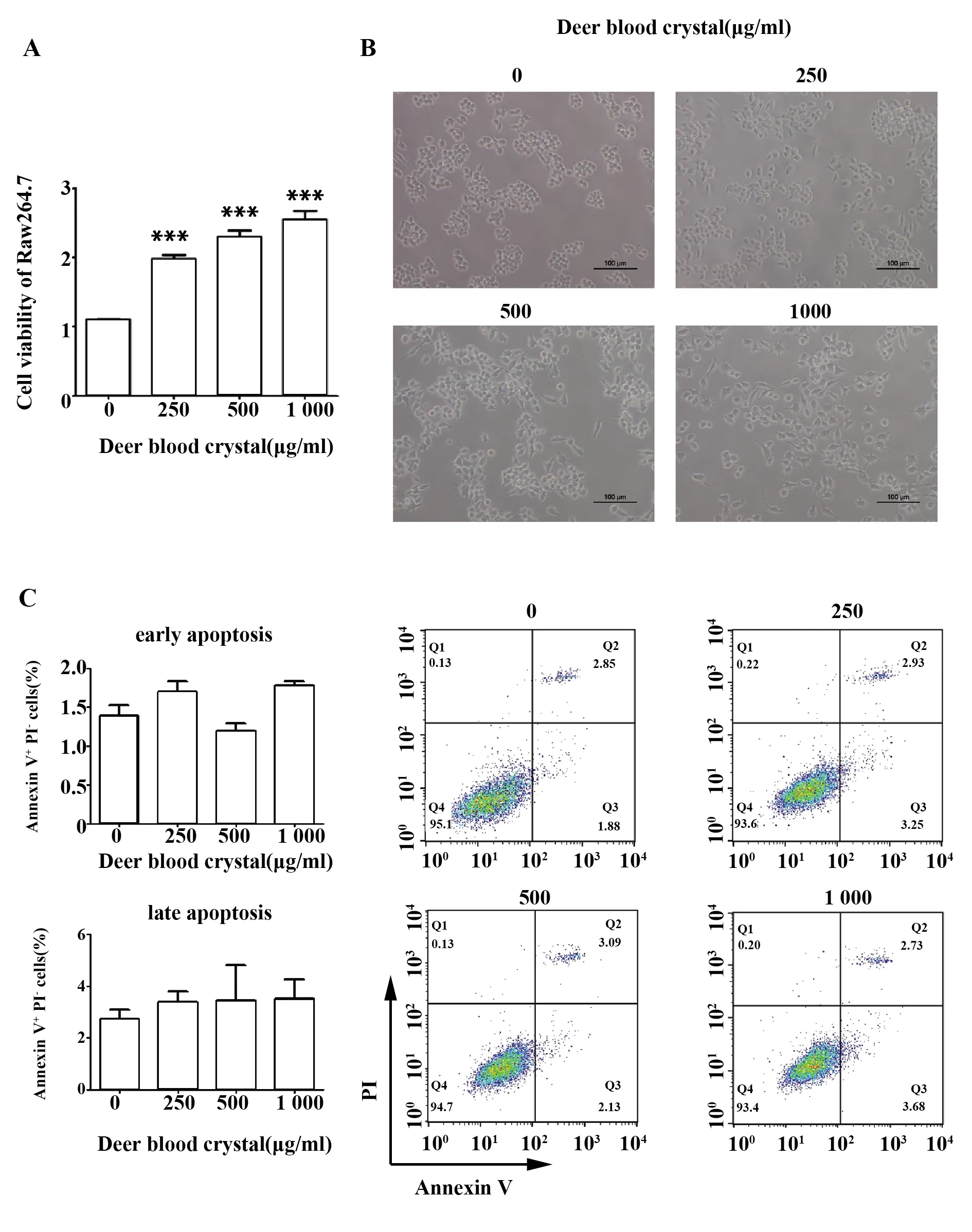
图4 鹿血晶增强巨噬细胞活力Fig.4 Deer blood crystal promotes cell viability of Raw264.7 cellsNote: Data are shown as
有文献表明[7,8],增强巨噬细胞的抗肿瘤活性,增强TNF-α、IL-6等炎症因子的分泌有利于肿瘤的治疗。本研究发现,低、中、高三个浓度的鹿血晶处理3 h后均能够上调巨噬细胞促炎因子iNOS、IL-1β、TNF-α的表达,而IL-6则在高浓度处理12 h时才显著上调(图5A~C)。此外,不同浓度鹿血晶均能够促进巨噬细胞分泌TNF-α和IL-6,而仅有高浓度鹿血晶促进巨噬细胞分泌一氧化氮(NO)和IL-1β(图5D)。这些促炎因子均为M1型巨噬细胞高表达基因,也是M1型巨噬细胞主要分泌的炎症因子。上述结果说明鹿血晶能够促进巨噬细胞产生炎症因子从而杀伤肿瘤细胞。
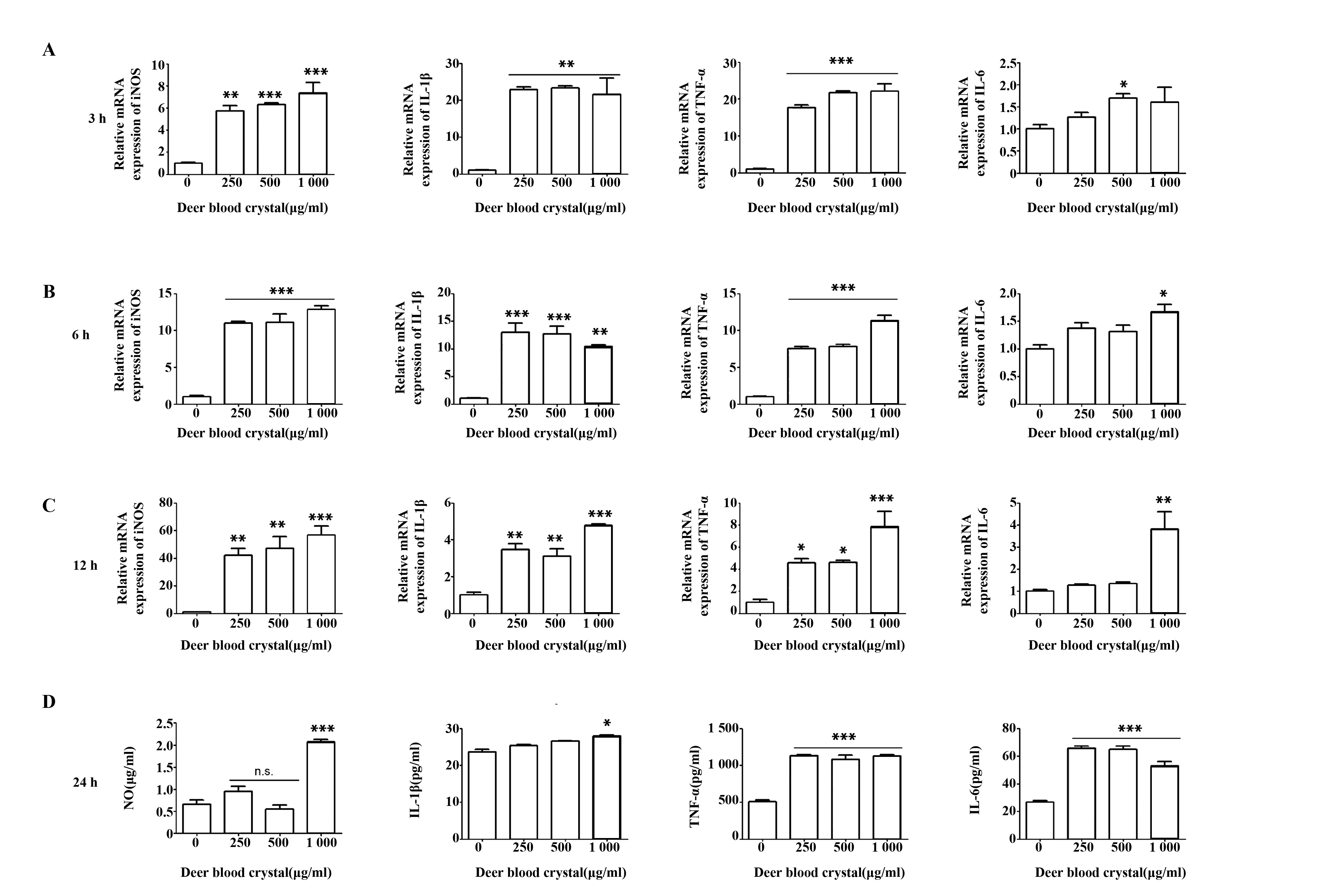
图5 鹿血晶促进巨噬细胞分泌炎症因子Fig.5 Deer blood crystal promotes expressions and secretion of inflammatory cytokinesNote: Data are shown as
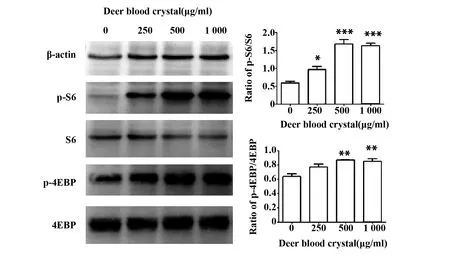
图6 鹿血晶活化巨噬细胞mTOR信号通路Fig.6 Deer blood crystal promotes phosphorylation of S6 and 4EBPNote: Data are shown as (n=3).*.P<0.05;**.P<0.01;***.P<0.001.
2.5鹿血晶活化巨噬细胞mTOR信号通路 文献报道NO、IL-1β、TNF-α等炎症因子的表达均与mTOR信号通路的活化有关[9,10]。本次实验结果则表明鹿血晶能够显著上调mTOR下游4EBP和S6的磷酸化水平(P<0.05)(图6)。综上,鹿血晶能够活化巨噬细胞mTOR信号通路。
3 讨论
巨噬细胞是肿瘤免疫疗法的重要成员,近年来针对肿瘤相关巨噬细胞(tumor-associated macroph-age,TAM)的研究层出不穷,诱导TAM向M1型极化、恢复巨噬细胞吞噬能力、增强巨噬细胞对肿瘤细胞的细胞毒作用均有利于肿瘤的治疗[11,12]。由于巨噬细胞移植到体内后无法扩增,所以如何调控患者自身体内的巨噬细胞以对抗肿瘤显得十分重要。
中药广泛应用于肿瘤化疗后患者恢复和化疗相关症状的治疗。有文献报道,鹿血晶能够治疗乳腺浸润导管癌患者化疗后白细胞减少症[13],改善消化道肿瘤化疗后骨髓功能[14]。但鹿血晶对机体免疫的直接作用尚不清楚,中药在黑色素瘤方面的研究也非常匮乏。
在哺乳动物细胞中,mTOR具有多种功能,是细胞代谢的中心调控因子[15,16],肿瘤免疫抑制和抗增殖治疗中也常靶向mTOR信号通路。有文献报道,抑制mTOR信号通路能够抑制LPS诱导巨噬细胞产生炎症因子如IL-1β、IL-6、TNF-α等[17]。
体外实验中,我们发现鹿血晶不仅能够增强巨噬细胞活力,还能够活化mTOR信号通路,上调mTOR下游4EBP和S6的磷酸化水平,提高巨噬细胞中炎症因子的表达水平,促进炎症因子TNF-α、IL-6、IL-1β和一氧化氮的分泌。含有上述炎症因子的细胞上清能够降低黑色素瘤细胞活力,促进肿瘤细胞发生凋亡。此外,鹿血晶还能提高巨噬细胞对肿瘤细胞的吞噬作用,增强巨噬细胞清除肿瘤细胞的能力。
综上所述,本文通过实验发现鹿血晶能够活化巨噬细胞mTOR信号通路,促进巨噬细胞产生促炎因子,提升巨噬细胞对肿瘤细胞的吞噬、杀伤能力,为临床应用中药调节免疫抵抗肿瘤提供了理论基础。

