一次性力竭运动致大鼠骨骼肌氧化应激的机制*
刘 姣,周 刚,梅 雨,谢文杰,李鹏飞,杨 帆
(湖南大学体育学院,长沙 410082)
运动诱导骨骼肌活性氧(reactive oxygen species, ROS)的研究已有数十年的历史,早期的研究表明骨骼肌细胞的线粒体是ROS的主要生成场所,超氧阴离子的生成与线粒体耗氧有关。然而,最近十余年越来越多的证据表明,ROS的生成与骨骼肌细胞的酶系统有关,尤其是NADPH氧化酶(NADPH oxidase, NOX),被认为是运动刺激骨骼肌ROS生成的主要途径[1]。
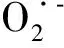
最近有研究表明用电刺激骨骼肌导致ATP释放,激活P2Y1受体,从而激活蛋白激酶C(protein kinase C, PKC),使NADPH氧化酶活性升高[5]。PKC被激活后可引起一系列靶蛋白的丝氨酸/苏氨酸残基发生磷酸化反应,是一种常见的信号传导途径。基于最近的研究成果,本研究重点关注一次性运动对NOX活性与表达的影响,及PKC是否参与了运动诱导的NADPH氧化酶源的ROS生成的调控。研究假设:运动诱导骨骼肌ROS增高的机制可能是通过PKC/NOX/ROS这条途径实现的。
1 材料与方法
1.1 实验器材与试剂
实验动物跑台(ZH-PT,安徽正华生物仪器设备有限公司),多功能酶标仪(QM40-NIR,奥地利),电泳系统(北京百晶生物技术有限公司),高速冷冻离心机(H1850R,湘仪),10-095匀浆机(宁波新芝生物科技有限公司),超低温冰箱(中科美菱),白屈菜红碱(上海羽朵生物科技有限公司),Apocynin(美国Sigma-aldrich公司),DCFH-DA荧光探针(美国Sigma-aldrich公司),NADPH、SOD、PMSF、DTT、BCA蛋白定量试剂盒(碧云天生物技术研究所),GAPDH抗体(杭州贤至生物科技有限公司),PKC抗体(圣克鲁斯生物技术公司(Santa Cruz),NOX2、NOX4抗体、二抗抗体(武汉博士德生物工程有限公司),3-NT(3-nitrotyrosine)抗体(美国Sigma-aldrich公司),Western blot常规生化试剂(碧云天生物技术研究所)。
1.2 实验动物与研究方案
雄性SD大鼠40只,体重240~260 g,购于湖南斯莱克景达实验动物有限公司,动物许可证号SCXK(湘)2016-0002。分笼饲养,每笼4只,饲养环境温度为24℃±2℃,自由饮食、饮水,自然昼夜变化光照。
本研究分为两个实验。实验一:30只大鼠随机分为3组,每组10只,分别为对照组(C组)、力竭运动组(E组)、运动+PKC抑制剂组(EC组),其中EC组腹腔注射PKC抑制剂白屈菜红碱(Chelerythrine),剂量5 mg/kg体重,C组和E组注射同等剂量生理盐水,观察抑制PKC活性对力竭运动大鼠骨骼肌NOX的活性与表达的影响。实验二:30只大鼠随机分为3组,每组10只,分别为对照组(C组)、力竭运动组(E组)、运动+NOX抑制剂组(EA组),EA组腹腔注射NADPH氧化酶抑制剂Apocynin,剂量10 mg/kg体重,C组和E组注射同等剂量生理盐水,观察抑制NOX活性对力竭运动大鼠骨骼肌过氧亚硝酸阴离子(peroxynitrite, ONOO-)生成的影响。
运动模型[6]为中等强度的大鼠跑台一次性力竭运动,整个动物实验持续8 d,具体过程如下:动物购入后静养3 d;第4~6日,除C组外,其他组的大鼠进行3 d跑台适应性运动,5 m/min,1次/日,无坡度;第7日,休息,并且各组分别注射抑制剂或生理盐水;第8日,在运动前1 h,动物被第二次注射抑制剂或生理盐水,然后进行一次性力竭运动。运动以5 m/min开始,无坡度,按每5 min增加5 m的节奏,逐渐增加至终强度25 m/min,直到力竭。在运动过程中用1 mA以下电流强度刺激,必要时增加锐光和声音刺激,进行强迫运动。最后,在大鼠经反复声光电刺激及人工驱赶也不能继续运动,并且观察到大鼠四肢瘫软,眼神无光,翻转后无法进行翻正反射,即确定为达到力竭状态,终止运动,平均运动时间约为120 min。
1.3 采样与样品处理
末次运动后,立即将大鼠腹腔注射10%水合氯醛水溶液(0.35 ml/100 g),心脏取血后处死大鼠。固定大鼠后肢,分离出左右腿的跖肌,置于样品管后立即液氮冷冻,然后保存在-80℃超低温冰箱中以备匀浆。
匀浆:称取组织100 mg左右放于冰上剪碎,按10%(1 mg∶10 μl)比例加入生理盐水或PBS匀浆液(PH 7.4、5 mmol/L磷酸、250 mmol/L蔗糖、0.1 mmol/L EDTA、1 mmol/L PMSF和1 mmol/L DTT)。匀浆后,生理盐水匀浆管以3 000 r/min离心10 min,取上清液分装后-80℃保存,用于ROS和蛋白定量测定;PBS匀浆管以12 000 r/min离心25 min,取上清液分装,-80℃保存,用于Western blot检测。
1.4 NADPH氧化酶活性的测定
骨骼肌NADPH氧化酶活性检测的蛋白定量采用BCA蛋白定量法。
1.5 Western blot
前述PBS匀浆液被用于Western blot实验,检测骨骼肌NOX2、NOX4、3-NT、GAPDH。步骤如下:(1)制备12%丙烯酰胺PAGE胶;(2)上样量30 μg/30 μl;(3)电泳;(4)转膜,PVDF膜;(5)5%脱脂奶粉封闭;(6)一抗孵育,过夜;(7)TBS-T漂洗;(8)二抗孵育1 h;(9)TBS-T漂洗;(10)ECL显色;(11)洗片;(12)扫描分析,采用ImageJ软件分析Western blot 图片条带的灰度值,用GAPDH作为内参,蛋白表达水平=目标蛋白条带灰度值/GADPH条带灰度值。
1.6 免疫沉淀
采用共免疫沉淀法检测PKC-NOX是否形成复合物。步骤如下:(1)100 mg跖肌+1 000 μl NP-40裂解液(含1 mmol/L PMSF),匀浆;(2)12 000 r/min离心25 min,取上清;(3)500 ml上清液+5 μl PKC抗体,4°C摇动过夜;(4)加入20 μl protein-A/G beads, 4°C摇动过夜;(5)离心、洗涤,留沉淀用于Western blot 分析;(6)常规Western blot,步骤见上,抗体为NOX2、NOX4;(7)扫描分析,采用ImageJ软件分析Western blot 图片条带的灰度值,蛋白表达水平=NOX2(或NOX4)条带灰度值/PKC条带灰度值。
1.7 统计学处理
2 结果
2.1 一次性力竭运动对骨骼肌NADPH氧化酶活性的影响
Tab. 1 Effects of Chelerythrine on NADPH oxidase active and protein expression in skeletal muscle of exhausted exercise rats
C: Control group; E: Exhaustive exercise group; EC: Exhaustive exercise plus chelerythrine group; AU: Arbitrary units
*P<0.05,**P<0.01vsC;# #P<0.01vsE
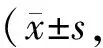

GroupSuperoxideproduction(AU/mgprotein)3-NT/GADPHC8.19±2.182.39±0.92E13.67±2.91∗∗5.03±0.11∗∗EA9.14±1.43##2.86±0.65#
EA: Exhaustive exercise plus apocynin group
**P<0.01vsC;#P<0.05,##P<0.01vsE
2.2 PKC对力竭大鼠骨骼肌NOX表达的调节
NOX家族中的NOX2和NOX4被报道在骨骼肌细胞中有较高表达,并且受骨骼肌收缩调节。但是,在运动刺激下,NOX2和NOX4的上游调节机制并不清楚。
本研究观察到,安静状态下,NOX2和NOX4表达均不高,但在一次性力竭运动后,如表1、图1所示,与C组相比,NOX2和NOX4的表达均显著增高(P<0.01,P<0.05)。与E组相比,在施加PKC抑制剂的EC组,NOX2的表达显著下降(P<0.01),但NOX4表达无显著性差异(P>0.05),提示力竭运动状态下,NOX2的蛋白表达受PKC调控,而NOX4的蛋白表达不受PKC的影响。
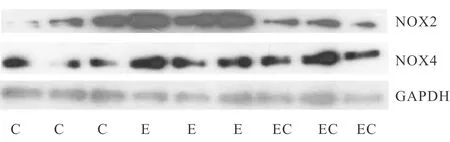
Fig. 1 Effects of exhaustive exercise on the expressions of NOX2 and NOX4 in skeletal muscles
C: Control group; E: Exhaustive exercise group; EC: Exhaustive exercise plus chelerythrine group
2.3 骨骼肌PKC-NOX2/NOX4免疫共沉淀分析
我们采用PKC-NOX2/NOX4免疫共沉淀方法进一步验证PKC与NOX2或NOX4是否形成复合物。实验先进行PKC的免疫沉淀,然后采用Western blot分析沉淀物中的NOX2、NOX4。结果如表1、图2所示,与C组相比,NOX2、NOX4在力竭状态下均显著增加(P<0.01,P<0.05),而施加抑制剂的EC组均无显著性差异(P>0.05),提示一次性力竭运动导致了PKC-NOX2、PKC-NOX4复合物的形成。
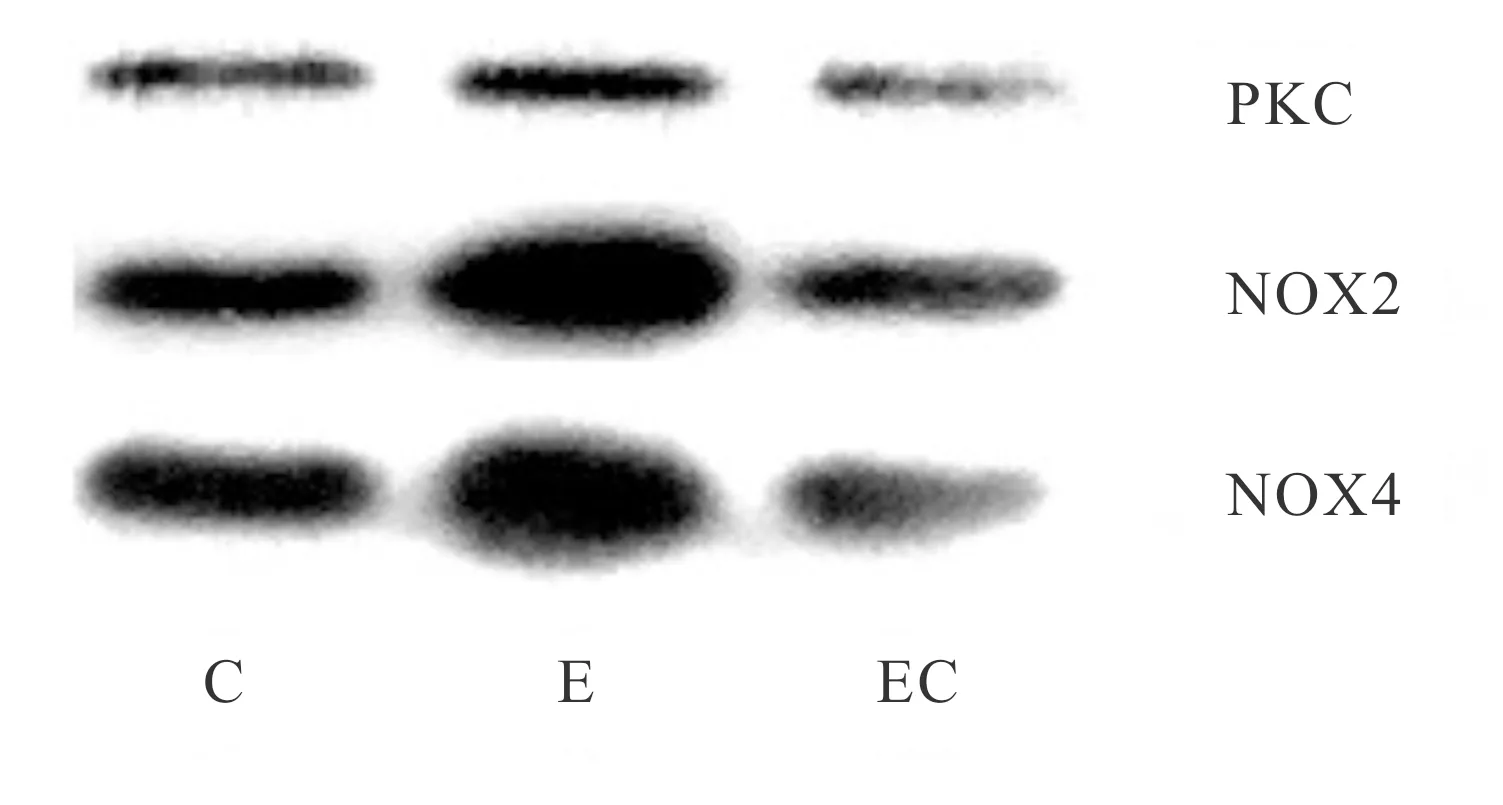
Fig. 2 Analysis of PKC-NOX2, PKC-NOX4 co-immunoprecipitation in skeletal muscle
C: Control group; E: Exhaustive exercise group; EC: Exhaustive exercise plus chelerythrine group
2.4 力竭运动诱导骨骼肌过氧亚硝酸阴离子生成
运动诱导骨骼肌细胞生成的过量ROS可与一氧化氮合酶催化生成的一氧化氮(nitric oxide, NO)快速反应,生成具有更强氧化作用的 ONOO-。骨骼肌中ONOO-半衰期极短,ONOO-可使蛋白质酪氨酸硝化,生成3-NT,可通过检测3-NT间接反映ONOO-生成量。由表2、图3可见,与C组相比,E组3-NT生成量显著上升,而施加NADPH氧化酶抑制剂的EA组较E组3-NT生成量减少,提示NADPH氧化酶途径生成的ROS后续导致了ONOO-的增加。
3 讨论
本研究旨在探明一次性力竭运动诱导的骨骼肌ROS的来源,了解NADPH氧化酶的不同亚型在运动诱导的骨骼肌ROS生成中的作用,并研究运动激活骨骼肌NADPH氧化酶的上游信号。本研究的主要发现有:一次性力竭运动增加骨骼肌NOX2和NOX4的蛋白表达;PKC介导了运动诱导的NOX2源的ROS增加。
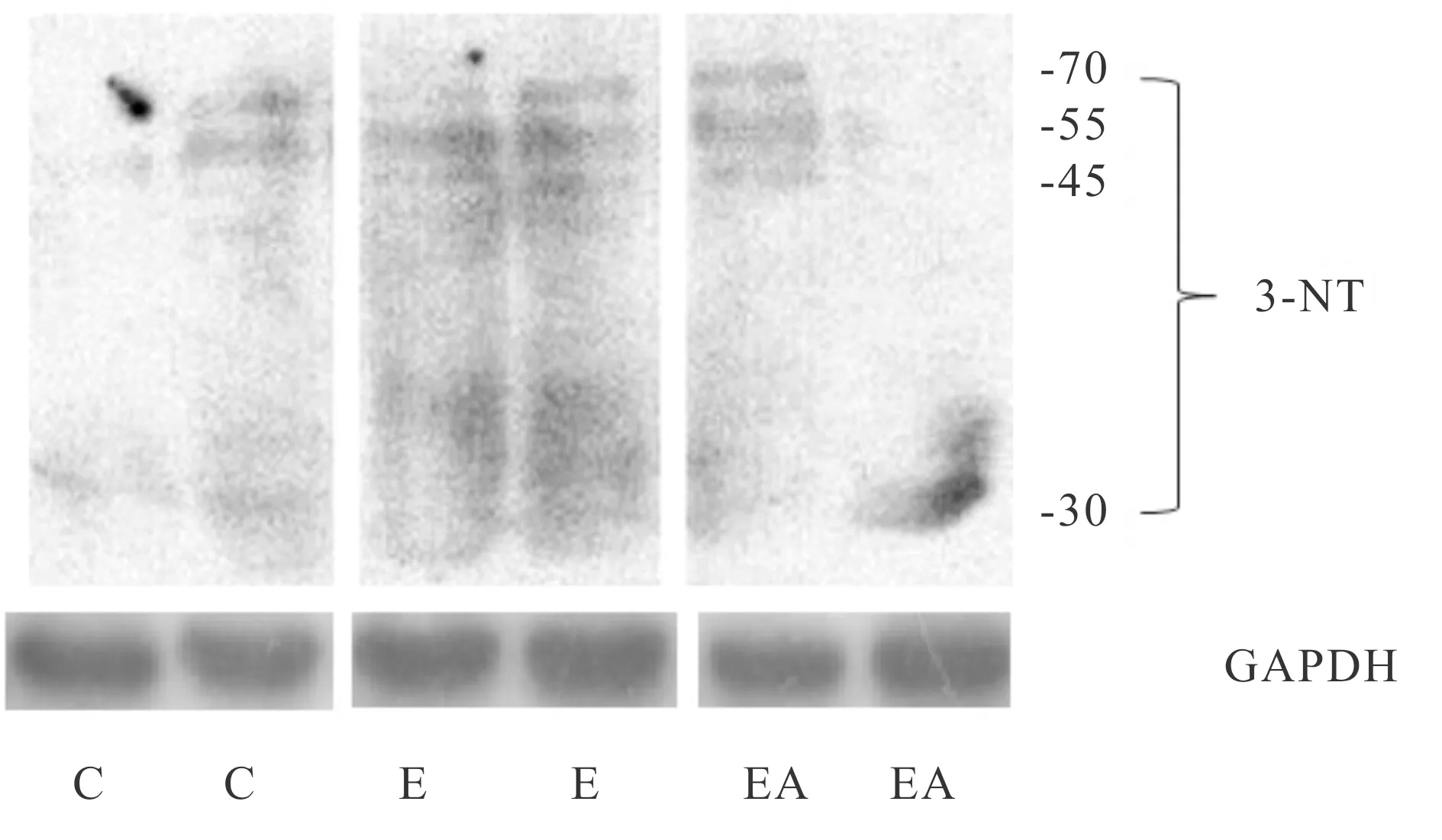
Fig. 3 Exhaustive exercise induces skeletal muscle peroxynitrite production
C: Control group; E: Exhaustive exercise group; EA: Exhaustive exercise plus apocynin group
我们的研究发现,一次性力竭运动显著提升了骨骼肌ROS水平,但施加NADPH氧化酶抑制剂apocynin后,ROS生成量未见增高,说明运动诱导的骨骼肌ROS源于NADPH氧化酶。这一发现与近年的一些研究结论一致,即骨骼肌中的NADPH氧化酶途径是运动诱导的骨骼肌中ROS的主要来源[1]。然而,运动对骨骼肌中存在的NADPH氧化酶两种亚型NOX2和NOX4的蛋白表达与活性的影响并不清楚。
骨骼肌中的NOX2由两个催化亚基和四个调节亚基组成,催化亚基gp91phox和p22phox主要定位于细胞膜和横管,而调节亚基p47phox、p67phox、p40phox和Rac主要存在于细胞浆[8],在细胞受到刺激后,胞质亚基易位至膜,组装成完整的酶,进而催化功能被激活,导致ROS生成[9]。Carlos等[10]采用apocynin作NADPH氧化酶抑制剂的小鼠急性60 min游泳实验,发现运动导致趾短屈肌中调节亚基p47phox磷酸化水平显著上调,并且共免疫沉淀检测到gp91phox-p47phox复合物形成,提示NOX2的活化在急性运动引起氧化应激反应中起到重要作用。最近一项大鼠跑台实验,发现一次较大强度的力竭性运动诱导gp91phox和p22phox mRNA的表达,进而NADPH氧化酶活性增加,催化生成过量ROS,并且NOX2受上游信号分子PKCδ的调控[11]。
PKC是一类使底物蛋白分子内丝氨酸/苏氨酸残基发生磷酸化的蛋白激酶家族,其中PKCα、β、δ和ζ被报道与NOX2的调节亚基p47phox磷酸化有关[12]。我们的研究中,给力竭运动大鼠施加PKC抑制剂白屈菜红碱后,跖肌ROS生成显著减少,并且,白屈菜红碱可抑制力竭运动导致的PKC-NOX2复合物生成增加,说明NOX2的激活与PKC的调控有关。关于力竭运动对PKC的影响,已有研究显示[13],力竭运动可增加大鼠心肌PKCα、δ和ζ蛋白表达水平,以及PKCα和PKCδ的磷酸化水平,提示PKC的表达与活化可能是力竭运动导致心肌损伤重要调控因素。进一步的研究显示,电刺激可以增强PKC-NOX2途径的ROS生成[5]。因此,通过我们的研究及已有研究报道可以推论,力竭运动通过PKC-NOX2途径促进骨骼肌ROS生成。
本研究还发现,一次性力竭运动增强了跖肌NOX2的蛋白水平,并且施加PKC抑制剂后,NOX2表达降低,提示PKC介导了力竭运动增强的NOX2表达,但其机制有待进一步研究。已有研究表明,NOX2和NOX4在骨骼肌的活性和表达存在纤维类型差异,并且运动可以增强NOX2和NOX4在骨骼肌中的活性和mRNA表达[4]。
一些病理性研究表明,骨骼肌的NOX4mRNA和蛋白水平在某些疾病状态下增加,如心脏病、肿瘤、老年性肌肉萎缩症等[14]。最新的一项研究显示,高糖培养上调施旺细胞NOX4mRNA及蛋白表达,降低施旺细胞活性,增加细胞内ROS含量,通过增加 Caspase3mRNA及蛋白表达促进细胞凋亡[15]。我们的实验发现,一次性力竭运动导致骨骼肌NOX4蛋白水平也显著增加,其变化与ROS的增高一致,说明非病理性的运动刺激也能导致NOX4表达增加。Matthew等[16]的一项小鼠急性跑台运动实验发现,一次性运动后,普通运动小鼠线粒体NOX4mRNA和蛋白水平均显著升高,而采用NOX4敲除小鼠做力竭运动实验,NOX4敲除鼠的运动距离和运动时间均显著低于正常小鼠。说明NOX4表达增加从而产生ROS是运动刺激后细胞的正常生理反应。一些细胞因子或激素可以上调NOX4的蛋白表达[14],包括IGF-1、血管紧张素II、TNF-α、TGF-β等。而运动实验表明,这些因子均可因受到运动刺激而上调,因此,骨骼肌NOX4蛋白表达的增加,可能与运动诱导的这些因子的增加有关。
此外,PKC也被发现对NOX4有调节作用,如PKCα可上调NOX4的表达[17]。有研究表明,PKC介导NOX4过度表达参与肾小球硬化和细胞外基质的重建,最终诱导糖尿病肾病的发生[18]。在我们的研究中,尽管检测到力竭运动使骨骼肌NOX4蛋白水平上升,但施加PKC抑制剂的力竭组NOX4表达依然高于安静组,与普通运动组无显著性差异,说明PKC并不直接介导运动导致的骨骼肌NOX4的蛋白表达。我们进一步研究PKC与NOX4共免疫沉淀发现,力竭运动使骨骼肌形成PKC-NOX4复合物,说明二者间一定发生了相互作用。而在PKC抑制剂组,并未观察到PKC-NOX4复合物增加。据此可以推测PKC激活了NOX4,从而产生ROS。尽管与NOX2的激活需调节亚基p47phox的磷酸化激活不同,NOX4具有自发活性,它的催化能力受转录水平调节,但仍然存在诱导活性的方式,已经显示有几种蛋白可以调节其活性[19]。与NOX2一样,NOX4也需要与p22phox结合构成功能基团才能起到催化产生ROS的作用。因此,p22phox可能是PKC被激活的适宜位点。p22phox表达的缺失使Nox4在其表达水平没有显著变化的情况下失活,而增加p22phox的表达也可以刺激增加的NOX4活性[19]。运动刺激下,PKC可能通过激活p22phox从而激活NOX4。尽管还没有NOX4被直接磷酸化的证据,但NOX4氨基酸序列的分析表明,NOX4存在众多磷酸化位点[19]。
综上所述,本研究通过力竭运动与施加NADPH抑制剂或PKC抑制剂的实验动物模型,发现一次性力竭运动可通过激活NADPH氧化酶,产生过量ROS;力竭运动可使骨骼肌中的NADPH氧化酶的两种亚型NOX2和NOX4的表达显著上升,PKC通过调控NOX2活性与表达介导骨骼肌ROS的生成。研究提示一次性力竭运动主要通过PKC/NOX2/ROS途径介导了骨骼肌氧化应激反应。此外,基于力竭运动也导致骨骼肌PKC-NOX4复合物的增加,也不排除PKC对NOX4活性具有调控作用,这是未来进一步研究需要关注的。

