白藜芦醇对成年期追赶生长大鼠体成分的影响及机制*
王素星,魏金刚,邵伟华,吕彩霞,苑晓烨△
(1.河北省人民医院老年病二科,石家庄 050051;2.石家庄市第五医院外科,河北 石家庄 050000)
追赶生长是机体在营养、疾病等不利因素影响下出现生长抑制,在相关因素解除后出现的快速生长现象,可出现在胎儿期、婴幼儿期、青少年期和成年期[1,2]。随着经济的发展,人民生活水平的提高,孕期保健的重视,低体重儿的出生率大大降低,普遍意义上的幼年追赶生长现象在逐步减少,而成年期追赶生长现象更为常见。在神经性厌食症、各种消耗性疾病、刻意的减重过度等所致体重下降后体重恢复的成年人中观察到了追赶生长现象[3,4]。成年期追赶生长在限制饮食后的重饲过程中,热卡摄入量发生了显著变化。众所周知,饮食变化会对身体成分产生重要影响[5]。白藜芦醇是一种存在于红酒中的多酚,以往的研究表明,白藜芦醇可以抑制脂肪生成,刺激脂肪分解,增加脂肪酸氧化和热生成[6],同时白藜芦醇也能诱发肌管肥大,影响肌肉代谢[7]。然而,目前尚未发现白藜芦醇对成年期追赶生长模型中体成分的影响。本文以限制热卡,进而恢复正常饮食的成年大鼠为模型,观察成年期追赶生长过程中大鼠的体成分发生了怎样的变化,白藜芦醇的干预效应及其可能的机制。
1 材料与方法
1.1 实验动物及实验设计
36只8周龄雄性SD大鼠适应性喂养1周后,按随机数字表法分为6组(共2个时间点),即4周时间点3组:正常饮食4周(NC4)组、热卡限制4周(R4)组,热卡限制同时白藜芦醇治疗(R4E)组;12周时间点3组:正常饮食12周(NC12)组,追赶生长(CUG)组,追赶生长白藜芦醇治疗(CUGE)组。每组含6只大鼠,具体分组见图1。其中,R4E组为限食同时予以白藜芦醇治疗4周,追赶生长CUG组为限食4周+8周正常饮食,追赶生长+白藜芦醇干预CUGE组为限食4周+8周(正常饮食+白藜芦醇治疗)。动物及普通饲料均购自河北医科大学实验动物学部。NC组自由进食,限食期间予以60%NC 组体重匹配大鼠进食量,追赶生长期间给予100% NC组体重匹配大鼠进食量。白藜芦醇(Sigma,St Louis,MO)用生理盐水配制成一定浓度悬浊液,用时混匀,按100 mg/(kg·d)剂量予实验动物灌胃治疗。分别于4和12周末进行实验指标检测。

Fig. 1 The experimental design
NC4/NC12: Normal chow for 4 w or 12 w; CUG: Catch-up growth; R4: Caloric restriction for 4 w; E: Resveratrol treatment
1.2 体重及能量摄入量
电子秤称取实验动物每日食物摄入重量及体重(精确至0.1 g),以“周”为单位计算动物每周平均每天能量摄入量。
1.3 体成分测定
大鼠禁食过夜,选用美国GE Lunar公司生产的双能X线吸收测量仪(Dual Energy X-ray Absorptiometry,DEXA)行躯干及全身的体成分测定。分析不同部位脂肪含量、肌肉含量及躯干与全身脂肪比例。
1.4 标本收集
实验结束后以致死量戊巴比妥钠腹腔注射(150 mg/kg)处死大鼠,迅速剥离附睾脂肪和胫骨前肌标本,置-80℃冰箱冻存留作Western blot检测沉默信息调节因子1(silent information regulator 1, SIRT1)及过氧化物酶体增殖剂激活受体γ(peroxisome proliferators-activated receptor γ, PPARγ)。附睾脂肪和肾周脂肪组织作为内脏脂肪的重要组成部分,鉴于课题组既往留取附睾脂肪组织较多,技术娴熟,故选取附睾脂肪组织作为内脏脂肪的代表。
1.5 Western blot
参照文献[8]方法提取并定量组织蛋白。取40 g蛋白样品行SDS-PAGE电泳、转膜、封闭,分别用SIRT1(1∶2 000,Abcam公司)、PPARγ(1∶2 500,Abcam公司)、β-actin(1∶1 000,SantaCruz公司)4℃孵育过夜;次日洗膜、二抗(1∶4 000,Pierce公司)孵育1 h、ECL化学发光试剂凝胶显影。实验以β-actin为内参, Western blot条带用Quantity One软件进行图像灰度分析。
1.6 统计学处理
2 结果
2.1 实验大鼠体重比较
限制饮食4周后,R4组实验动物体重明显低于正常对照NC4组(P<0.01);开放饮食后,CUG组体重表现为快速增长,但至实验结束仍较正常对照NC12组低(P<0.05);白藜芦醇干预后,R4E组、CUGE组体重轻度下降,但分别与R4组及CUG组相比无统计学差异(P>0.05,表1)。
2.2 躯干体成分的变化
与NC4组相比,R4组躯干肌肉含量及脂肪含量无明显变化(P>0.05,表1)。12周末,CUG组的躯干肌肉含量较NC12组显著下降,躯干脂肪含量明显升高(P<0.01)。相对于R4组,CUG组在追赶生长过程中躯干肌肉及脂肪含量改变较明显。白藜芦醇干预后,热卡限制组和追赶生长组的躯干脂肪含量较未干预组均显著下降(P<0.01),CUGE组的躯干肌肉含量明显升高,达到NC组水平(P> 0.05)。白藜芦醇对热卡限制组的躯干肌肉含量无明显影响。
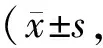
GroupTrunkmusclecontent(%)Trunkfatcontent(%)Bodyweight(g)(a)NC470.955±0.4667.985±0.667264.83±8.78R469.093±0.3298.117±0.204174.75±6.89R4E69.073±0.2847.525±0.261##165.45±7.61##(b)NC1269.343±0.4159.198±0.569379.57±9.59CUG66.275±0.373△△11.890±0.337△△359.43±8.99△CUGE68.612±0.353▲▲8.955±0.399▲▲350.12±9.43▲
NC4/NC12: Normal chow for 4 w or 12 w; R4: Caloric restriction for 4 w; CUG: Catch-up growth; E: Resveratrol treatment
##P<0.01vsR4 group;△P<0.05,△△P<0.01vsNC12 group;▲▲P<0.01vsCUG group
2.3 全身体成分的变化
R4组全身肌肉含量、脂肪含量及躯干与全身脂肪比例与NC4组相比无明显变化(P>0.05)。12周末,CUG组的全身肌肉含量较NC12组显著下降,全身脂肪含量明显升高(P<0.01),同时躯干与全身脂肪比例较NC12组亦明显升高(P<0.05)。与R4组相比,CUG组在追赶生长过程中以上三指标的改变较为显著。白藜芦醇使全身脂肪含量显著下降(P<0.05,P<0.01),躯干与全身脂肪比例亦呈明显降低趋势(P<0.01,P<0.05),恢复至正常对照组水平(P>0.05)。同时CUGE组的全身肌肉含量明显升高,达到NC12组水平(P>0.05),R4E组全身肌肉含量无明显变化(表2)。
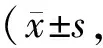
GroupWBmusclecontent(%)WBfatcontent(%)TrunktoWBfatratio(a)NC486.845±0.60411.243±0.6110.662±0.020R485.343±0.31812.045±0.3230.692±0.025R4E85.717±1.38310.110±0.443#0.640±0.002##(b)NC1285.402±0.60311.963±0.6150.703±0.015CUG81.942±0.211△△15.802±0.249△△0.748±0.012△CUGE85.793±0.624▲▲11.878±0.646▲▲0.702±0.007▲
NC4/NC12: Normal chow for 4 w or 12 w; R4: Caloric restriction for 4 w; CUG: Catch-up growth; E: Resveratrol treatment
#P<0.05,##P<0.01vsR4 group;△P<0.05,△△P<0.01vsNC12 group;▲P<0.05,▲▲P<0.01vsCUG group
2.4 Western blot检测SIRT1、PPARγ蛋白质的表达
追赶生长结束时,CUG组附睾脂肪和骨骼肌SIRT1表达均低于NC12组(P均<0.01),附睾脂肪PPARγ表达高于NC12组(P<0.01)。白藜芦醇干预后,CUGE组附睾脂肪和骨骼肌SIRT1表达较CUG组明显升高(P均<0.01),与NC12组无明显统计学差异(P>0.05),附睾脂肪PPARγ表达较干预前明显降低,且低于NC12组(P<0.05,图2,表3)。
Fig. 2 SIRT1 and PPARγ protein expressions in 12-week group
NC12: Normal chow for 12 w; CUG: Catch-up growth; E: Resveratrol treatment
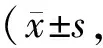
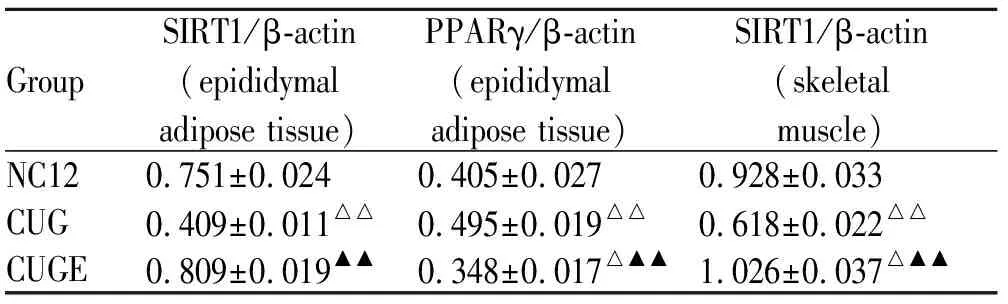
GroupSIRT1/β-actin(epididymaladiposetissue)PPARγ/β-actin(epididymaladiposetissue)SIRT1/β-actin(skeletalmuscle)NC120.751±0.0240.405±0.0270.928±0.033CUG0.409±0.011△△0.495±0.019△△0.618±0.022△△CUGE0.809±0.019▲▲0.348±0.017△▲▲1.026±0.037△▲▲
NC12: Normal chow for 12 w; CUG: Catch-up growth; E: Resveratrol treatment
△P<0.05,△△P<0.01vsNC12 group;▲▲P<0.01vsCUG group
3 讨论
近年来,研究发现白藜芦醇具有改善胰岛素抵抗、降低血糖、调节脂代谢等作用[9,10]。本研究显示白藜芦醇在追赶生长的不同阶段均可显著降低躯干和全身的体脂含量,同时降低腹部脂肪与全身脂肪的比例,减轻腹部脂肪堆积。我们亦发现白藜芦醇在降低体脂成分的同时,可以增加追赶生长大鼠的肌肉含量。诸多研究也显示白藜芦醇与脂质和肌肉代谢密切相关。白藜芦醇能够增加腓肠肌和肩胛棕色脂肪两大产热组织能量消耗,从而起到调控生热作用[11]。它亦可影响内脏脂肪组织RBP4 蛋白表达,降低脂质含量,并增加脂解酶的表达,增加脂肪组织的脂解作用,从而降低体脂含量,增强胰岛素敏感性[11,12]。
追赶生长是能量改变的过程,而沉默信息调节因子1(silent information regulator 1, SIRT1)是体内重要的能量代谢感受器,可感知机体的能量代谢状态,通过改变下游分子的基因表达或活性调节机体能量代谢[13]。SIRT1作为白藜芦醇的主要作用靶点,通过脱乙酰作用抑制脂肪生成相关基因过氧化物增殖物激活受体γ(peroxisome proliferator activated receptor, PPARγ)转录活性,从而抑制脂肪细胞分化,降低脂肪沉积,促进脂肪动员[14]。我们的研究发现,在追赶生长结束时附睾脂肪组织SIRT1的表达明显减少,进而对PPARγ的抑制作用减低,使PPARγ在追赶过程中表达增加,促使脂质合成增加,躯干部脂肪比例增加。而白藜芦醇可提升附睾脂肪组织SIRT1的表达,后者表达的增加抑制了PPARγ的表达,进而使脂质合成减少,体脂含量降低。
众多研究显示,白藜芦醇与肌肉代谢密切相关,它可诱发肌管肥大,促进受损肌管的生长,有助于维持肌肉细胞功能和再生[15,16]。Wang等人[6]发现白藜芦醇可以激活AMPK/SIRT1途径,抑制肌细胞凋亡,改善肌肉质量,预防肌萎缩[6]。本研究亦显示,成年期追赶生长大鼠骨骼肌组织SIRT1的表达下降,肌肉含量降低,经白藜芦醇治疗后,大鼠骨骼肌SIRT1的表达显著增加,同时肌肉含量增加。由此我们推测,白藜芦醇对成年期追赶生长大鼠肌肉代谢的影响通过激活SIRT1途径实现的。
值得注意的是,在本研究中,我们发现白藜芦醇增加肌肉含量作用的发挥与能量供应相关。在热卡限制期间,白藜芦醇对肌肉含量无明显提升作用,开放饮食后,白藜芦醇显著增加躯干及全身的肌肉含量。对于这种不一致性,我们推测其一,由于饮食限制,骨骼肌合成所需的基本原料很少,从而抑制了骨骼肌细胞的活性。其次,相对严重的食物缺乏(减少40%的食物摄入)激活了能量守恒机制,能量被优先分配到关键器官,以确保生命的基本代谢活动。因此,白藜芦醇对热量限制期间促进骨骼肌生成的作用无法发挥,但一旦营养供应充足,这种促进骨骼肌合成的作用得以呈现。本研究中,我们未观察SIRT1在该模型骨骼肌中表达的动态改变,尚不确定SIRT1途径是否在此过程中起了主导作用,亦或有其他调控因素参与,需进一步验证。
综上,白藜芦醇可以显著降低成年期追赶生长大鼠体脂含量,增加肌肉含量,降低躯干与全身脂肪比例,其机制可能与增加骨骼肌及内脏脂肪组织SIRT1表达,抑制内脏脂肪PPARγ的表达有关。白藜芦醇可能为治疗成年期追赶生长模型在营养变迁过程中体脂成分增加、肌肉成分丢失提供新策略。

