Dickkopf-3在非小细胞肺癌组织中的表达及意义*
刘利玲,杨岳峰,李 帅,李 娟
1.成都医学院 生物科学与技术学院(成都 610500);2.成都医学院 公共卫生学院(成都 610500); 3.成都医学院第一附属医院 病理科(成都 610500);4. 成都医学院 基础医学院(成都 610500)
肺癌是目前全球最常见的恶性肿瘤,也是我国发病率和病死率最高的恶性肿瘤。肺癌的组织学类型主要分为小细胞肺癌(small cell lung cancer, SCLC)和非小细胞肺癌(non-small cell lung carcinoma, NSCLC)两大类。其中,NSCLC占80%~85%[1]。临床上,NSCLC患者由于早期症状不典型、易复发转移,导致预后差,5年生存率<20%。因此,探索新的治疗靶点对NSCLC的早期诊断、治疗具有重要的意义。Dickkopf-3基因,也被称作REIC (reduced expression in immortalized cells)[2]。研究[3]表明,Dickkopf-3是一种抑癌基因。作为Wnt信号通路的拮抗性基因,Dickkopf-3在鼻咽癌[4]、前列腺癌[5]和结直肠癌[6]等众多肿瘤中表达下调,而在食管癌[7]、口腔鳞状细胞癌[8]等极少数肿瘤中表达上调。目前,NSCLC组织中Dickkopf-3蛋白的表达国内外少有文献报道。本研究利用免疫组织化学染色和蛋白质印迹技术检测Dickkopf-3蛋白在NSCLC肿瘤组织、癌旁正常肺组织和淋巴结转移癌组织中的表达,并探讨其临床意义,以期为NSCLC诊断治疗提供依据。
1 材料与方法
1.1 组织标本和资料
收集2017年1月至2017年12月西部战区总医院收治的接受手术治疗、临床资料完整、尚有石蜡标本的NSCLC共 81例进行免疫组化实验。收集2018年7月至2019年2月西部战区总医院收治的接受手术治疗、确诊为NSCLC新鲜肺癌组织共11例,所取组织在手术标本离体20 min内置于液氮中保存,随后于-80 ℃冰箱中保存备用,用于蛋白质印迹技术实验。纳入标准: 1)所有组织标本均经病理科高级职称医师复阅切片,确诊为NSCLC(2015年WHO肺肿瘤组织学分类标准); 2)入组患者术前均未行放、化疗或其他治疗;3)一般情况尚可,无严重肝肾疾病。收集的81例NSCLC病例中,伴有转移灶37例,实际收集淋巴结转移癌组织病例37例。其中,男47例,女34例;有吸烟史者43例,不吸烟者38例;年龄34~77(56.0±17.6)岁;参照2015年国际抗癌联盟TNM分期标准(第8版):Ⅰ期19例,Ⅱ期38例,Ⅲ期24例;组织学类型:鳞状细胞癌32例,腺癌47例,大细胞癌2例;病理分级:高分化21例,中分化43例,低分化17例。纳入NSCLC新鲜组织标本共11例,其中男6例,女5例;发生淋巴结转移5例,未转移6例。
1.2 主要试剂
Dickkopf-3兔抗人多克隆抗体购于美国Proteintech Group 公司。辣根酶山羊抗鼠、山羊抗兔IgG(H+L) 以及免疫组化检测试剂盒购于北京中杉金桥生物技术有限公司。GAPDH内参蛋白购于Santa Cruz Biotechnology。BCA蛋白定量试剂盒购于Thermo scientific。ECL 化学发光检测试剂盒购于美国Millipore。
1.3 主要方法
免疫组织化学法(SP法):准备厚度为3~4 μm石蜡组织切片,采用SP法进行染色。一抗使用1∶200浓度的Dickkopf-3兔抗人多克隆抗体,4 ℃中孵育过夜。生物素标记的兔二抗37 °C孵育30 min,DAB显色,镜下观察,固封。以PBS代替一抗作为阴性对照,以癌旁正常肺组织作阳性对照。蛋白质印迹技术检测法:原发癌灶、淋巴结转移灶、癌旁正常肺组织分组后,标号。组织经RIPA裂解液裂解后,提取总蛋白并定量。每孔100 μg总蛋白进行SDS-PAGE凝胶电泳,PVDF膜转印,封闭。一抗Dickkopf-3(1∶1 000)于4 ℃过夜。山羊抗兔或鼠二抗(1∶5 000)于37 ℃摇床2 h。ECL显色,采集图像。以GAPDH(1∶5 000)作为内参蛋白。
1.4 判断标准
免疫组化:所有标本均无杂染,置于10×40倍光学显微镜下观察,Dickkopf-3阳性染色为棕黄色颗粒,定位于细胞质内。每张标本随机选取10个视野(表1)。将上述阳性细胞数评分与阳性染色程度评分相乘即为该标本的染色强度值。根据免疫反应评分(immunoreactive score,IRS)将标志物的表达情况分为4类。IRS 0分阴性(-),IRS 1~4分弱阳性(+),IRS 5~8分中等阳性(++),IRS 9~12分强阳性(+++)。在不明确的情况下或两人判定不一致的情况下,使用Leica多视图系统(Leica Microsystems,Inc.,Buffalo Grove,IL,USA)评估最终得出结果。蛋白质印迹技术检测法:实验重复3次取均值,以每次试验内参蛋白GAPDH表达量一致为前提,比较分析Dickkopf-3蛋白表达趋势。

表1 免疫组化评分标准(分)
1.5 统计学方法
采用SPSS 21.0统计软件进行数据分析。免疫组化数据:定量资料比较采用独立样本t检验,各组间阳性率等定性资料比较采用2检验,多因素分析应用Logistic回归模型。蛋白质印迹技术数据:均通过3次独立重复试验获得,两组之间的数据分析采用不配对Student′st检验进行方差分析,以Image J、GraphPad Prism 5为辅助工具作图。检验水准α除特别说明外均设定为0.05。
2 结果
2.1 Dickkopf-3蛋白表达结果
Dickkopf-3蛋白在NSCLC癌旁正常肺组织(图1)、原发癌组织(图2)、转移癌组织(图3)中的阳性表达逐渐减弱,分别为100.0%(81/81)、55.6%(45/81)、40.5%(15/37),差异有统计学意义(P<0.05)。2检验显示,在NSCLC组织中,Dickkopf-3蛋白在原发癌组织中和淋巴结转移癌组
织阳性表达率均低于癌旁正常肺组织(P<0.01)。11例蛋白质印迹技术检测结果提示,相对于正常肺组织,在有转移组中,原发癌组织和转移癌组织中Dickkopf-3蛋白的表达明显下调(P<0.05);在未转移组中,原发癌组织中Dickkopf-3蛋白的表达也明显下调(P<0.05)(图4)。
注:A:Dickkopf-3蛋白在NSCLC转移组中的电泳条带;B:转移组Dickkopf-3蛋白条带的灰度分析;C:Dickkopf-3蛋白在NSCLC未转移组中的电泳条带;D:转移组Dickkopf-3蛋白条带的灰度分析
2.2 Dickkopf-3蛋白表达与临床病理特征的单因素分析
Dickkopf-3蛋白表达与是否发生癌转移、肿瘤大小、TNM分期有关(P<0.05),发生癌转移、肿瘤体积大、TNM分期晚的NSCLC患者Dickkopf-3蛋白阳性表达率明显低于未发生转移、肿瘤体积小、TNM分期早的患者(P<0.05)。Dickkopf-3蛋白表达与NSCLC患者的年龄、性别、吸烟史、病理组织学类型、是否侵犯被膜、分化程度的差异无关(P>0.05)。但蛋白质印迹技术法检测有转移组中,Dickkopf-3蛋白表达在原发癌组织和转移癌组织中差异无统计学意义(P>0.05)(表2)。
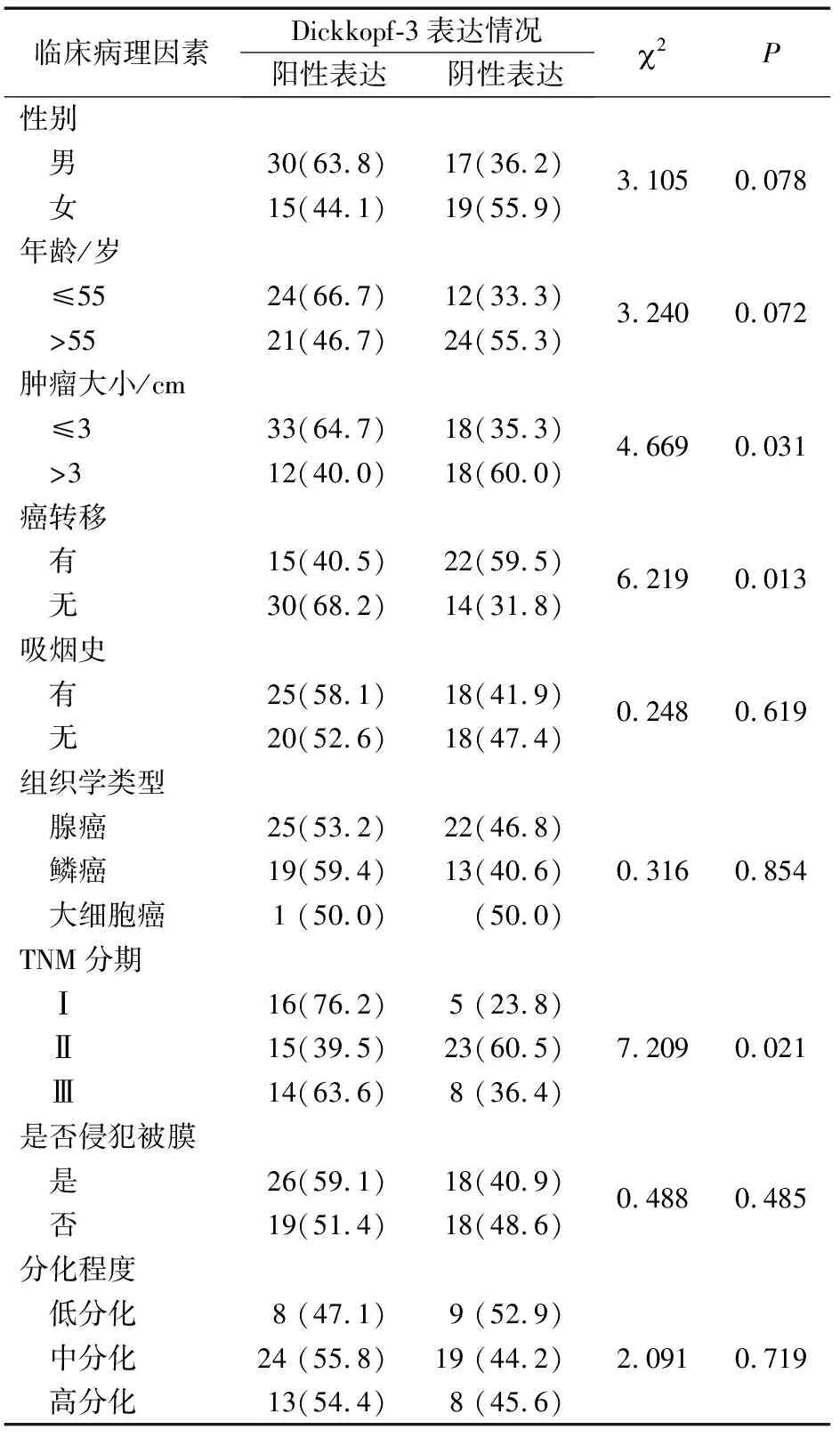
表2 81例非小细胞肺癌临床病理因素单因素分析[n(%)]
2.3 Dickkopf-3蛋白表达与临床病理因素多因素分析
将单因素分析结果提示与Dickkopf-3蛋白表达有关的临床病理因素作为解释变量,Dickkopf-3蛋白表达程度作为反应变量,纳入Logistic回归中分析。Logistic回归分析显示,肿瘤大小是影响Dickkopf-3蛋白表达的独立危险因素(OR=0.279,P=0.021)(表3)。
3 讨论
肺癌的发生发展是一个多阶段性过程,常伴有基因突变或蛋白异常表达,导致细胞内复杂信号通路的异常激活[9]。Wnt参与机体多种病理生理过程,是调节信号转导途径的重要组成部分,该信号通路被异常激活与肿瘤形成密切相关。Dickkopf-3作为经典Wnt信号通路的拮抗性基因,其启动子中CpG岛甲基化导致游离β-catenin在胞浆内逐渐累积,经转位于细胞核,启动cyclinD1、c-myc等癌基因的转录,进而促进肿瘤的形成[7]。
Dickkopf-3基因是Dickkopf基因家族中的一员,位于人染色体11p5.1,长度约为4 7100 bp,由 9个外显子和2个启动子构成,编码产生分泌型糖蛋白分子量约为38 390,由350个氨基酸组成[10]。目前,新型软件的开发以及多种蛋白模型的构建成为成功建立Dickkopf-3三维结构的基础[11]。
Dickkopf-3蛋白在众多肿瘤的发生发展中扮演重要角色,其在不同肿瘤组织中的表达情况,对肿瘤的诊断、治疗及预后具有一定的作用。Sawahara等[12]研究发现,在肝癌组织中Dickkopf- 3基因甲基化明显高于癌旁组织及正常组织。癌组织和癌旁组织的Dickkopf- 3基因mRNA 表达量明显低于正常组织,说明Dickkopf- 3基因对原发性肝癌的发生发展有着重要的作用。Kawasaki等[13]在具有多重耐药性的MCF/ADR 乳腺癌细胞研究中发现,Dickkopf-3蛋白的表达不但能抑制乳腺癌细胞的生长,且能够提高乳腺癌细胞对多柔比星的敏感性。Lorsy等[14]证实,与正常的细胞系和组织相比,Dickkopf- 3的mRNA表达水平在癌细胞系和癌组织中更低,提示Dickkopf- 3的甲基化可作为乳腺癌患者无病生存率和总体生存率的预测指标。Wang等[15]研究了食管腺癌患者肿瘤组织中Dickkopf-3的表达,RT-PCR结果显示表达上调。实验[16]证实,腺病毒载体转染Dickkopf-3基因,使其在肿瘤细胞中高表达后可诱导肿瘤细胞的凋亡。基于此,改良型腺病毒(Ad)REIC / Dickkopf- 3载体,即 Ad-C-T-REIC载体,在癌症基因治疗中显示出更高的应用价值[17],由于其显著的、强大的基因表达能力,有望成为肺癌治疗中的创新工具[18]。
本研究显示,Dickkopf-3蛋白在NSCLC原发灶和淋巴结转移灶中的表达相对癌旁正常肺组织显著下调,与文献[19]报道一致。另发现,Dickkopf-3在NSCLC癌旁正常肺组织、原发癌组织、转移癌组织中的阳性表达率逐渐减弱。此外,Dickkopf-3在45例NSCLC中的阳性表达与肿瘤大小、TNM分期及淋巴结转移有关(P<0.05),而与患者的性别、年龄、吸烟史、病理组织学类型、是否侵犯被膜、分化程度无关(P>0.05)。多因素统计分析结果表明,肿瘤大小是NSCLC的独立危险因素,差异有统计学意义(P<0.05)。本实验结果提示,Wnt信号通路拮抗剂Dickkopf-3蛋白在NSCLC中表达降低,Dickkopf-3蛋白可能具有促进肿瘤细胞发生发展及转移的作用,但此结果尚待进一步研究证实。此外,本实验运用蛋白质印迹技术检测Dickkopf-3蛋白在原发癌组织、淋巴结转移癌组织、癌旁正常肺组织中的表达情况。统计分析结果表明,Dickkopf-3蛋白的表达相对量在原发癌组织和淋巴结转移癌组织中差异无统计学意义(P>0.05),提示该蛋白的表达与是否发生转移无相关性,与免疫组化结果不一致。笔者认为,原因可能是用于蛋白质印迹技术检测的标本数量太少,不足以支撑其结果,今后将补充标本、完善临床资料进一步探索,并探究Dickkopf-3蛋白表达与NSCLC患者预后的影响。
综上所述,在NSCLC中Dickkopf-3蛋白表达下调与肿瘤大小、TNM分期及淋巴结转移有关,且肿瘤大小是影响NSCLC中Dickkopf-3表达的独立因素。因此,Dickkopf-3有望成为NSCLC诊断治疗的潜在靶点。

