MPTP诱导帕金森模型大鼠的血液学及临床病理评价*
曾朝蓉,岳 冬,孙 伟,胡力文,石 真,符 杰,龚玉来,姚晓梅,熊义英,陈正礼△,胡延春△
1. 成都中医药大学附属四川省八一康复中心(成都 611135);2.动物疫病与人类健康四川省重点实验室 四川农业大学动物医学院(成都 611130)
帕金森病(Parkinson′s disease, PD)是继阿尔兹海默症后的第二常见的神经退行性疾病。PD的主要临床特征为运动障碍,其中包括静止性震颤、运动减少、迟缓、肌强直和姿势步伐不协调等[1-2]。主要病理特征为黑质致密部多巴胺(dopamine, DA)能神经元细胞的变性死亡,导致黑质-纹状体通路退化,从而使纹状体内的多巴胺含量明显减少,黑质残存的神经元胞质内出现嗜酸性包涵体,即路易小体(Lewy body, LB)[3-6]。
随着对PD发病机制的进一步研究,人们逐渐对PD有所认识,PD动物模型的研究也在不断发展。最常用的方法是利用神经毒素MPTP建立PD动物模型,其无论是在神经病理特征或运动行为方面都与人类PD酷似[7]。MPTP不具有神经毒性,使用后出现PD症状的原因是MPTP在B型单胺氧化酶(MAO-B)的作用下转化为MPP+,随后由多巴胺转运体(dopamine transporter, DAT)转运进入神经细胞,在神经细胞中形成自由基对黑质纹状体进行破坏,导致多巴胺(DA)含量减少[8-9]。因此,本研究利用MPTP建立PD大鼠模型,期望能从血液学及病理学角度揭示PD发病机制,为临床诊疗提供依据。
1 材料与方法
1.1 材料
1.1.1 试验动物 SPF级雄性SD大鼠,体重280~320 g,10~12周龄[成都达硕实验动物股份有限公司,许可证号:SCXK(川)2015-030]。
1.1.2 仪器及试剂 主要仪器:RM2235石蜡切片机(德国Leica公司)、DM1000徕卡显微成像系统(德国Leica公司)。主要试剂:1-甲基-4-苯基-1,2,3,6-四氢吡啶(北京诺其雅盛生物科技有限公司)、乙醚(上海展云化工有限公司)、苏木素染液、兔抗大鼠酪氨酸羟化酶(中国Boster公司)。
1.2 方法
1.2.1 大鼠分组及PD模型制作 挑选出爬杆试验得分为0分的大鼠16只进行试验,随机抽取6只作为对照组,10只作为模型组。将MPTP用生理盐水配制成质量浓度为30 g/L的溶液,以30 mg/kg进行腹腔注射,1次/d,连续注射 7 d,第7天注射结束1 h后立即用爬杆实验的方法对大鼠进行筛选,评分在 1.5~2.0分的视为PD模型制作成功的大鼠,并在第14天再次进行行为学检测,判断模型稳定性。
1.2.2 行为学检测 1)旷场试验:将大鼠放置在开阔箱的正中格内,5 min内观察大鼠的活动行为。测定的指标包括:①方格间穿行次数(3只爪以上跨入邻格的次数);②竖起次数(两前肢离地 1 cm 以上的次数); 2)爬杆试验:爬杆试验使用直径为35 mm、高1 000 mm 的光滑不锈钢管,将不锈钢管垂直竖立,使大鼠头向下放置在不锈钢管杆的顶部,让大鼠从金属杆顶部沿着杆自然爬至杆底,在大鼠下行时观察其行为,按照评分标准进行计分,每只大鼠爬杆两次,最终计算平均分。爬杆实验评分标准如下:四肢并用,一次顺利从杆上爬下为 0 分;一步一步螺旋向下爬行但兼有后肢滑行行为的为0.5 分;上杆后间歇停顿数次后趴下,但可抱紧金属杆为1分;滑行后掉落为1.5分;不能抓杆,直接掉落为2.0分。
1.2.3 样品采集 对大鼠禁食8 h,不禁水。乙醚麻醉后进行腹主动脉采血,随后断颈取脑,放入4%多聚甲醛固定1周。
1.2.4 血液学检测 用采集的血液处理后进行血生化和血常规指标测定。
1.2.5 大鼠黑质病理检测 1)HE 染色:石蜡包埋后切片,选黑质部组织切片常规脱蜡至水,苏木素和伊红染色,中性树胶封片。显微镜下观察组织病理学变化。2)免疫组化检测:选黑质部组织切片常规脱蜡至水,抗原修复后用山羊血清封闭,滴加一抗后4 ℃过夜。次日,磷酸缓冲盐溶液(PBS)洗 3 次后滴加二抗,PBS 洗后使用 DAB 试剂盒显色;最后苏木素复染、脱水、透明及封片。
1.3 统计学方法
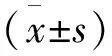
2 结果
2.1 行为学检测结果
通过旷场试验和爬杆试验分别检测了各组大鼠运动功能的变化。旷场试验显示,MPTP模型组大鼠第7天与第14天,与对照组相比,方格间穿行的次数和竖立次数均明显性下降(P<0.05);爬杆试验显示,MPTP模型组大鼠第7天与第14天,与对照组相比,爬杆得分明显增加 (P<0.05)(表1~2)。

表1 各组大鼠爬杆试验评分(分)
注:与同时间对照组相比,*P<0.05;与给药前MPTP模型组相比,#P<0.05
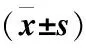
表2 各组大鼠旷场试验运动变化
注:与同时间对照组相比,*P<0.05;与给药前MPTP模型组相比,#P<0.05
2.2 血液学结果
血生化结果显示,与对照组相比,MPTP模型组大鼠的直接胆红素明显降低(P<0.05);血常规结果显示,各组各项血常规检测指标均未超出正常值范围,但模型组的血红蛋白、红细胞、白细胞、中性粒细胞、淋巴细胞、单核细胞数均明显或极明显高于对照组(P<0.05,P<0.01)。其他血液指标差异无统计学意义(P>0.05)(表3~4)。
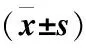
表3 各组大鼠血生化指标
注:与对照组相比,*P<0.05
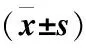
表4 各组大鼠血常规指标
注:与对照组相比,*P<0.05,**P<0.01
2.3 中脑黑质病理检测结果
2.3.1 中脑黑质病理改变 对照组多巴胺能神经元细胞结构完整、分布均匀,神经元细胞数量未见明显的改变。MPTP模型组多巴胺能神经元细胞数量明显减少,细胞皱缩,细胞核固缩浓染,细胞周围间隙增宽(图1)。
2.3.2 中脑黑质区TH阳性细胞表达 对照组黑质区的TH阳性细胞表达无明显变化,神经元形态结构正常,平均光密度值为0.26±0.06。与对照组比较,MPTP模型组黑质中TH阳性细胞表达明显降低,平均光密度值明显降低0.02±0.01(P<0.05) (图2)。
3 讨论
PD是一种神经内科运动障碍疾病,其主要表现为锥体外系运动障碍,如肌僵直、静止性震颤、运动迟缓及步态异常等[10-11]。在行为学试验中发现,利用MPTP诱导的大鼠均出现后肢无力、震颤、被毛竖立、尾僵直、暴躁等典型PD临床症状,其运动行为明显减少。在爬杆试验中大鼠抱杆能力变差,评分明显增高。这与狄荣科等[12-13]得出的结果相同。且本研究在注射MPTP后观察到随着时间的变化其行为学数据前后无差异,说明PD模型稳定。PD病理变化最基本的核心为中枢神经多巴胺能神经元丢失,而DA能神经元主要集中在大脑黑质致密部[14]。有研究[15]表明,MPTP可通过血脑屏障进入脑中形成MPP+,形成的MPP+与DA高度亲和,随后被DAT转运到DA能神经元从而选择性破坏黑质DA能神经元。通过中脑黑质组织 HE 染色,可看到神经元细胞皱缩、数量减少、核浓缩、部分胶质细胞增生。因此,笔者认为连续7 d腹腔注射MPTP会对黑质多巴胺能神经元造成慢性不可逆损伤。TH是多巴胺合成过程中重要的限速酶,有研究[16-17]表明,PD患者黑质纹状体系统中TH蛋白表达减少,其(hTH1~hTH4) mRNA的表达也明显减少。本研究结果也印证了这一点,在MPTP诱导的PD模型大鼠其TH神经元数量明显减少,因此TH 阳性神经元的含量可能与 PD 病情呈正相关。
目前PD只能通过病史、临床症状进行诊断,Doty等[18]发现,由于嗅觉功能障碍是特发性PD的首发症状之一,因此嗅觉测试也可以作为早期这种疾病的诊断。华键等[19]对PD患者进行血生化指标的评估发现,PD患者的尿酸、总胆红素、低密度脂蛋白胆固醇均有所下降与PD的发生呈独立相关。本研究中,MPTP模型组大鼠尿酸含量与总胆固醇含量与对照组相比虽有所下降,但差异无统计意义(P>0.05)。模型组直接胆红素含量相对于对照组降低,差异有统计意义(P<0.05)。有研究[20]表明,PD患者会出现肝肾阴虚的非运动症状,因此直接胆红素降低可能与PD对肝脏的损伤有一定关系。Barcia等[21]研究发现,PD的改变与炎症有关。PD患者黑质部的活化小胶质细胞促进炎症反应,损伤多巴胺能神经元,促炎细胞因子进而在纹状体内表达,从而诱发PD。在本研究试验中MPTP模型组大鼠白细胞、淋巴细胞、中性粒细胞、单核细胞数量均明显增加,且从HE染色病理切片结果看出确有部分胶质细胞增生出现,推测应与PD的炎症反应有一定关系。综上所述,腹腔注射MPTP可使大鼠出现PD运动障碍,行为学试验证实了模型复制成功,血液学及病理学诊断结果也为判定早期PD提供了理论基础。

