高效、快速提取高质量稻曲病菌基因组DNA方法
张俊华,马 玥,杨明秀,宋 爽,刘连夫,杨 硕
(东北农业大学农学院,哈尔滨 150030)
水稻稻曲病(Rice false smut,RFS)是由稻绿核菌[Ustilaginoidea virens(Cooke) Takahashi]引起的世界性水稻病害[1],降低水稻产量与品质,稻粒被稻曲病菌污染后所含毒素可抑制人、动物细胞分裂及μ管蛋白功能,对人畜健康造成安全隐患[2-3]。因此,加强稻曲病菌分子生物学研究,对制定有效的水稻稻曲病防控策略具有重要意义,快速提取高质量DNA 是稻曲病菌基因克隆、精细定位及群体遗传多样性分析等分子生物学研究的关键。
目前从稻曲病菌中分离基因组DNA 方法主要有:十六烷基三甲基溴化铵法(Cetyl trimethyl ammonium bromid,CTAB)[4]、十 二 烷 基 硫 酸 钠 法(Sodium dodecyl sulfate,SDS)[5]、试剂盒法[6]和改良脲素法[7]。CTAB法利用CTAB阳离子去污剂将细胞中DNA 溶解后经有机溶剂抽提去除蛋白、多糖等杂质。SDS法中SDS阴离子去污剂在高温下裂解细胞膜使染色体离析、蛋白质变性,与蛋白质多糖结合释放核酸。改良脲素法与SDS试剂配合提取基因组DNA 方法得到的稻曲病菌基因组DNA 量大且质量较好。但CTAB 法、SDS 法和改良脲素法操作步骤繁琐、耗时长、易造成DNA 链断裂,需接触有毒试剂,危害操作者健康。当涉及群体遗传多样性、分子标记等需快速大量获取基因组DNA 的研究时,CTAB 法、SDS 法和改良脲素法工作量大,试剂盒提取成本高,均无法满足快速高效、低成本获取稻曲病菌基因组DNA 的需要。一步式提 取 法(Rapid one-step extraction, ROSE)由Steiner 等首次报道[8]。传统ROSE 法采用“一步一管”方式,即磨碎组织后加入ROSE 提取缓冲液90 ℃温浴后置于冰上,使组织和PVPP 沉淀后4 ℃保存备用即可。该方法简单、提取快速、成本低廉、无污染,但DNA 浓度与质量偏低、保存时间短,不适用于对DNA 质量有较高要求的研究,如基因克隆、基因敲除等。将ROSE法用于提取稻曲病菌基因组DNA尚未见报道。
国内外学者根据不同试验样本改良DNA 提取方法以满足不同分子试验要求[9-10]。本试验对ROSE法改进后形成“改良ROSE法”,对比传统稻曲病菌基因组DNA 提取方法,旨在寻找一种可在短时间内快速、高效提取高质量稻曲病菌DNA 的方法,满足稻曲病菌遗传图谱构建及基因克隆等高质量DNA分子试验要求。
1 材料与方法
1.1 材料
1.1.1 供试菌株
水稻稻曲病菌[Ustilaginoidea virens(Cooke)Takahashi]UV-WC-1,UV-AC-1,UV-FZ-1 菌株均由东北农业大学农学院植物病理教研室提供。
1.1.2 供试药剂
CTAB 裂解缓冲液(2%CTAB、1%PVP、1.4 mol·L-1NaCl、pH 8.0 20 mmol·L-1EDTA、pH 8.0 100 mmol·L-1Tris-HCl);SDS 裂解缓冲液(500 mmol·L-1NaCl、pH 8.0 50 mmol·L-1EDTA、pH 8.0 50 mmol·L-1Tris-HCl);脲素裂解缓冲液(1%SDS、7 mol·L-1urea、62.5 mmol·L-1NaCl、pH 8.0 50 mmol·L-1Tris-HCl);ROSE 裂解缓冲液(1%SLS、1%PVPP、pH 8.0 10 mmol·L-1Tris-HCl、pH 8.0 312.5 mmol·L-1EDTA);TE 缓冲液(10 mmol·L-1Tris-HCl、pH 8.0 1 mmol·L-1EDTA);NaAc(3 mol·L-1pH 5.2);KAc(5 mol·L-1pH 4.8);70%乙醇;10%SDS;RNaseA;氯仿/异戊醇(24∶1);苯酚/氯仿/异戊醇(25∶24∶1);康为真菌DNA 提取试剂盒(产品目录号CW0531S)。
1.1.3 供试培养基
马铃薯蔗糖固体培养基(PSA):用于稻曲病菌固体培养;马铃薯蔗糖液体培养基(PS):用于稻曲病菌震荡培养。
1.2 方法
1.2.1 菌丝收集
将UV-WC-1、UV-AC-1、UV-FZ-1 稻曲病菌株经马铃薯蔗糖固体培养基(PSA)培养7 d 后在菌落边缘取3 块直径为5 mm 菌碟置于马铃薯蔗糖液体培养基(PS)中28 ℃、150 r·min-1培养7 d,过滤洗涤菌丝后置于-80 ℃冷冻保存备用。
1.2.2 稻曲病菌DNA提取方法
1.2.2.1 CTAB法
参照Ladhalakshmi 等方法,略改进[4]。称取0.1 g 稻曲病菌菌丝于研钵中,迅速用液氮研磨至粉末状转入1.5 mL 离心管中。加入600 μL CTAB裂解缓冲液(预热)65 ℃水浴40 min,平均每10 min震荡摇匀1 次充分裂解菌丝。水浴后加入100 μL KAc 冰浴30 min。加入等体积苯酚/氯仿/异戊醇(25∶24∶1)抽提两次。12 000 r·min-1离心10 min 取上清液加入等体积异丙醇(预冷)-20 ℃冷冻45 min,12 000 r·min-1离心10 min,弃上清液收集沉淀,70%无水乙醇洗涤沉淀2 次,室温条件下风干10 min,加50 μL TE缓冲液和2 μL RNaseA 37 ℃水浴10 min后置于-20 ℃保存。
1.2.2.2 SDS法
称量0.1 g 稻曲病病菌菌丝于研钵中,液氮冷却研磨至粉末状转入1.5 mL 离心管中。离心管中加 入400 μL SDS 裂 解缓 冲液 和80 μL 10%SDS(65 ℃预热),65 ℃水浴40 min,每10 min上下颠倒混匀1 次。水浴后加入100 μL KAc 冰浴30 min后加入500 μL 氯仿/异戊醇(24∶1)摇晃混匀12 000 r·min-1离心10 min,取上清液于新离心管中加入等体积氯仿/异戊醇(24∶1)12 000 r·min-1离心10 min。取上清液于新离心管中加入等体积异丙醇(预冷)-20 ℃冷冻45 min,12 000 r·min-1离心10 min 弃上清液留下底部DNA 沉淀,70%无水乙醇洗涤沉淀两次,室温条件下风干10 min,加50 μL TE 缓冲液和2 μL RNaseA 37 ℃水浴10 min 后迅速放置于-20 ℃保存备用。
1.2.2.3 试剂盒法
真菌DNA 试剂盒提取使用康为世纪生物科技有限公司生产的DNA 提取试剂盒(目录号CW0531S),提取步骤参照试剂盒说明书。
1.2.2.4 改良脲素法
参照李竞生方法,略改进[7]。0.1 g菌丝在研钵中用液氮研磨至粉末状,加入1 mL 脲素裂解缓冲液(65 ℃预热),上下颠倒混匀,使菌丝细胞充分裂解。12 000 r·min-1离心5 min,取上清液700 μL于新离心管中加入等体积苯酚/氯仿/异戊醇(25∶24∶1)摇晃混匀。12 000 r·min-1离心5 min后取上清液500 μL 加入等体积异丙醇(预冷)和1/10 体积的NaAc(预冷)-20 ℃冷冻沉淀DNA 45 min。12 000 r·min-1离心10 min 后弃上清液留下DNA 沉淀,70%无水乙醇洗涤沉淀2 次,室温条件下风干10 min,加50 μL TE缓冲液和2 μL RNaseA,37 ℃水浴10 min后迅速放置于-20 ℃保存备用。
1.2.2.5 改良ROSE法
参照Steiner 等方法并增加两步操作形成“改良ROSE法”[8]。0.1 g菌丝液氮速冻磨碎后加入500 μL ROSE 裂解缓冲液(预热)摇晃混匀,90 ℃温浴20 min后置于冰上10 min。12 000 r·min-1离心10 min取上清液于新离心管中加入等体积异丙醇(预冷)和1/10体积NaAc(预冷)-20 ℃放置30 min。取出后12 000 r·min-1离心10 min,弃上清留下底部DNA沉淀用70%无水乙醇洗涤沉淀两次,室温下风干10 min,加50 μL TE缓冲液和2 μL RNaseA,37 ℃水浴10 min,迅速放置-20 ℃保存备用。
1.2.3 紫外光分光光度计检测
取不同方法提取的DNA 样品及TE 缓冲液(空白对照)各1 μL 利用核酸蛋白分析仪NanoDrop 2000 检测稻曲病菌DNA 样品OD260/OD280及OD260/OD230波长处紫外吸收比值、浓度并计算得率。
1.2.4 DNA琼脂糖凝胶电泳检测
取4 μL稻曲病菌DNA样品经1%琼脂糖凝胶电泳检测DNA质量。
1.2.5 PCR检测
PCR 扩增引物为稻曲病菌特异性引物[11]:US1-5(5' CCG GAG GAT ACA ACC AAA AAA ACT CT 3')和US3-3(5'GCT CCA AGT GCG AGG ATA ACT GAA T 3')。目的产物片段长度380 bp。
PCR 反应体系:2×PCR Mix 10 μL,ddH2O 7.4 μL,上下游引物各0.8 μL,DNA模板1 μL,总体系20 μL。
PCR反应程序:96 ℃预变性2 min;96 ℃变性20 s,58 ℃退火30 s,72 ℃延伸30 s,共30 个循环;72 ℃延伸7 min。取4 μL 扩增产物经1%琼脂糖凝胶电泳,紫外凝胶成像。
1.2.6 Eco RⅠ限制性内切酶酶切反应
反应体系:10×Buffer 2 μL,Eco RⅠ限制性内切酶1 μL,稻曲病菌DNA 样品1 μL,加入ddH2O补足体系至20 μL。37 ℃水浴1 h,酶切反应结束后取4 μL反应产物经1%琼脂糖凝胶电泳检测。
2 结果与分析
2.1 不同方法提取步骤、成本、毒性、耗时比较
不同DNA提取方法比较结果见表1。
由试验结果可见,在提取步骤上,CTAB 法和SDS法需多次震荡加热,操作过程较为剧烈,易造成DNA 断裂及降解,而改良ROSE 法操作简单快捷,不需抽提、水浴、震荡等复杂步骤。在试验成本上,试剂盒价格昂贵,提取大量DNA 样本作分子标记及遗传图谱建立等分子生物试验时,成本较高,改良ROSE法仅需通过配制简单化学试剂即可提取大量样本。在毒性方面,CTAB 法、SDS法、改良脲素法需利用苯酚、氯仿、异戊醇等有毒试剂抽提,释放大量有毒气体。改良ROSE法无需有机试剂抽提,环保无毒。在耗时方面,传统CTAB 法、SDS 法 提 取DNA 时 长 达3.5 h,改 良ROSE 法仅需1.5 h 便可快速提取DNA。综上所述,改良ROSE 法较其他提取方法具有操作简便快速、成本低、环保无毒、节约时间等优势。

表1 5种方法提取步骤、成本、毒性、耗时比较结果Table 1 Comparison results of extraction procedure,cost,toxicity and time consumption of five methods
2.2 不同方法提取DNA质量比较
检测指标OD260、OD280、OD230分别表示核酸、蛋白质、糖类多酚等杂质吸光度。高纯度DNA OD260/OD280约为1.8,当OD260/OD280>1.9 时,表明有RNA 污染,OD260/OD280<1.6 时,表明有蛋白质污染。高纯度DNA OD260/OD230<2.0,当OD260/OD230>2.0时,表明DNA有多糖、酚类物质污染。利用核酸蛋白分析仪NanoDrop 2000 检测稻曲病菌DNA 样品OD260/OD280及OD260/OD230波长处紫外吸收比值,并根据DNA 检测浓度计算5 种方法DNA 得率(见表2)。
由试验结果可知,CTAB法、试剂盒法和改良ROSE 法提取得到的稻曲病菌基因组DNA OD260/OD280≈1.8,且OD260/OD230>2.0,表明3 种方法可提取高质量稻曲病菌DNA。而SDS 法和改良脲素法提取到的稻曲病菌基因组DNA OD260/OD280≤1.6,OD260/OD230<2.0,表明DNA 存在轻微蛋白质和多糖及酚类物质污染。在稻曲病菌基因组DNA 纯度上,改良ROSE法可得到高纯度DNA,与传统CTAB法稻曲病菌DNA纯度相当,且优于其余4种方法稻曲病菌DNA 纯度。在稻曲病菌基因组DNA 得率上,CTAB 法DNA 得率最大为446.28 μg·g-1,其次改良ROSE法为360.35 μg·g-1。而试剂盒和改良脲素法DNA 得率较低,分别为155.80 和200.26 μg·g-1。改良ROSE法DNA得率仅次于CTAB法,且显著高于改良脲素法和试剂盒法,表明该方法可高效提取稻曲病菌基因组DNA。
2.3 DNA琼脂糖凝胶电泳检测
5种方法提取的稻曲病菌DNA琼脂糖凝胶电泳检测结果见图1。
表2 5种方法提取的DNA质量结果比较Table 2 Comparison results of total DNA isolated by five methods

图1 5种方法提取的DNA琼脂糖凝胶电泳检测结果Fig.1 Test results of agarose gel electrophoresis detection of genomic DNA obtained by five methods
由图1 可见,CTAB 法和SDS 法提取的DNA 条带清晰明亮但存在条带拖尾现象,说明DNA 轻度降解。SDS 法和改良脲素法提取DNA 点样孔不同程度发亮,表明提取的DNA 有较多蛋白质、多糖及其他次生代谢产物污染,其中SDS 法提取得到的DNA 污染最为严重,与紫外分光光度计检测结果一致。改良脲素提取法和试剂盒提取的DNA 条带较弱,可见这两种提取方法稻曲病菌DNA 得率低。改良ROSE 法提取的DNA 条带单一明亮,无拖带现象,且点样孔无发亮现象。综合紫外分光光度计对DNA 质量的定量检测与琼脂糖凝胶电泳对DNA 的定性检测,5 种方法中改良ROSE法提取稻曲病菌基因组DNA 的纯度最高、质量最好。
2.4 PCR检测
稻曲病菌特异性引物US1-5/US3-3对5种DNA提取方法得到的稻曲病菌基因组DNA 作PCR 特异性扩增,PCR 扩增产物经1%琼脂糖凝胶电泳检测,结果见图2。可见,5 种方法提取得到的稻曲病菌DNA 均扩增得到稻曲病菌380 bp 特异性条带,且整齐单一,无非特异性条带。除试剂盒和改良脲素法提取得到的DNA PCR 扩增特异性条带较弱,其余3 种方法提取得到DNA PCR 扩增条带均明亮整齐。SDS和CTAB法提取到的DNA中蛋白质、多糖、酚类等杂质也未对其DNA PCR 特异性扩增产生影响。综上所述,改良ROSE法与其他4种DNA 方法提取得到的稻曲病菌基因组DNA 均可稳定PCR扩增,且PCR产物特异性好,重复性高。
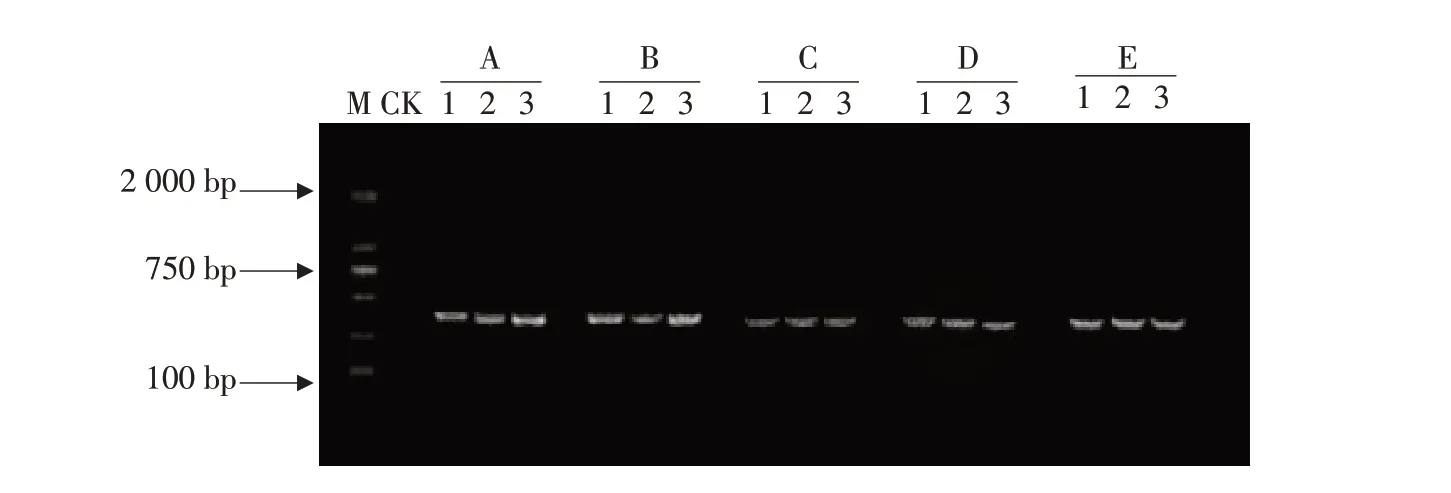
A-CTAB法;B-SDS法;C-试剂盒法;D-改良脲素法;E-改良ROSE法;M-DNA marker DL2000;CK-空白对照;1-水稻稻曲病菌(U.virens UV-WC-1);2-水稻稻曲病菌(U.virens UV-AC-1);3-水稻稻曲病菌(U.virens UV-FZ-1)A-CTAB method;B-SDS method;C-DNA extraction kit;D-Modified urea method;E-Modified ROSE method;M-DNA marker DL2000;CK-Blank control;1-U.virens(Strain UV-WC-1);2-U.virens(Strain UV-AC-1);3-U.virens(Strain UV-FZ-1)
2.5 Eco RⅠ限制性内切酶酶切检测
DNA样品中如存在大量蛋白质、多糖及其他次生代谢产物将严重影响限制性内切酶酶切效率[12]。Eco RⅠ限制性内切酶对5 种方法提取得到的DNA酶切后,酶切产物经1%琼脂糖凝胶电泳检测结果见图3。

图3 5种方法提取的DNA限制性内切酶消化结果Fig.3 Test results of Eco RⅠrestriction endonuclease enzyme digestion of genomic DNA obtained by five methods
由图3 可见,CTAB 法和SDS 法提取得到的DNA 酶切产物均可见大面积弥散状条带,但SDS法提取的DNA 未被完全消化,存在明显DNA 残留,表明酶切效率受残留蛋白质、次生代谢产物的影响。改良脲素法和试剂盒提取得到的DNA 酶切产物弥散状条带较弱,可能被限制性内切酶过度消化。改良ROSE 法提取的DNA 酶切效果最好,酶切产物电泳后呈明亮大面积弥散条带,表明该方法提取的DNA 中无蛋白质、次生代谢产物及化学试剂等物质影响酶活性,稻曲病菌DNA 可用于高效酶切。
3 讨论与结论
稻曲病菌培养过程中菌丝生长特点为①平板培养菌丝生长缓慢、收集周期长;②液体震荡培养菌丝产生大量次生代谢产物,菌丝体呈黄色粘稠状。因此,快速高效获取高质量稻曲病菌DNA 存在难度。
伏荣桃等采用SDS、CTAB、试剂盒3 种方法对比稻曲病菌DNA 提取效果,CTAB 法是提取稻曲病菌基因组DNA 的最优方法,与本试验结果相似[13]。本试验结果表明,CTAB 法可提取高质量DNA 且优于SDS 法、改良脲素法和试剂盒法。但CTAB法操作过于繁琐,易造成DNA链断裂,需接触氯仿、苯酚等有毒试剂,提取时间长达3.5 h,耗时费力。传统ROSE 法步骤简单快速高效,但DNA 纯度与得率相对较低,仅适用于大量DNA 样品粗略定性分析研究,如注重高通量、快速低成本提取DNA 的稻曲病菌群体遗传多样性分子研究,不适用于基因克隆、QTL 定位等对DNA 质量与浓度有较高要求的分子试验[14]。
“改良ROSE 法”在原有ROSE 法操作步骤上增加两个步骤提高DNA 提取纯度与得率。①加入预冷异丙醇和NaAc-20 ℃放置30 min,充分沉淀提取液中DNA,提高稻曲病菌DNA 得率。②70%无水乙醇漂洗沉淀以去除DNA 中残余的盐离子,提高DNA纯度。相比传统ROSE法,“改良ROSE法”提取的DNA纯度与得率均大幅提高,与CTAB法提取得到的DNA 质量相当且保留原有ROSE 法高通量、快速、低成本优势。
“改良ROSE法”成功用于稻曲病菌基因组DNA提取,可简单、快速获得高质量稻曲病菌基因组DNA。该方法提取的稻曲病菌DNA 可满足稻曲病菌分子标记、遗传图谱构建等需短时获取大量DNA 样本的分子生物学实验需求,也适用于基因精细定位、构建基因组文库等需高质量DNA 样本的分子生物学研究。不同生物材料适用于不同DNA提取方法,冉策等通过比较试验发现CTAB法能提取到高质量草莓DNA 用于PCR 技术检测草莓镶脉病毒[15]。贺羽等研究报道,对于苹果球壳孢腐烂病菌CTAB 法提取的DNA 效果优于试剂盒提取法[16]。“改良ROSE 法”是否同样适用于其他生物材料DNA提取尚待进一步研究。

