拮抗黄曲霉枯草芽孢杆菌21-1-2发酵条件的优化
金黎明,王晓彤,宫小明,权春善,赵 晶,侯熙彦
(1.大连民族大学 生物技术与资源利用教育部重点实验室,辽宁 大连 116605;2.潍坊出入境检验检疫局,山东 潍坊 261041)
黄曲霉(Aspergillus flauvs)是一种世界范围常见的许多重要农作物以及动物的共同致病菌,由于其产生的次级代谢产物—黄曲霉毒素具有极强的致癌、致突变和致畸作用,尤其是黄曲霉毒素B1(aflatoxin B1,AFB1)毒性最强、危害最大,被世界卫生组织列为毒物之首,定为IA类致癌物质[1-2],因此,黄曲霉的防治仍然是亟需解决的问题。目前,粮食和食品中黄曲霉防治的方法主要有物理方法(如吸附[3]、萃取[4]、热处理[5]、射线处理[6]等)、化学方法[7]、加强采后贮藏管理和生物防治等,其中,生物防治技术被认为是最有前途和最有效的方法[8-9]。
近年来发现的能有效防治黄曲霉的微生物主要有芽孢杆菌(Bacillus)、乳杆菌(Lactobacillus)、假单胞菌(Pseudomonas)、扁座壳孢(Aschersonia placenta)等。徐进等[10]研究发现,乳杆菌培养液对黄曲霉孢子萌发具有显著的抑制作用;曹冬梅等[11]将弯曲乳酸杆菌(Lactobacillus curvatus)与黄曲霉(Aspergillus flavus)共培养,结果发现黄曲霉菌丝产量明显降低;郭艳萍等[12]以泡菜、新鲜猪肠、豆浆渣、鸡肠道内容物为材料,采用牛津杯法筛选出6株对黄曲霉的生长有明显的抑制作用的拮抗菌株,其中,3株为植物乳杆菌(Lactobacillus plantarum),2株为消化乳杆菌(Lactobacillus alimentarius),1株为亚利桑那乳杆菌(Lactobacillus arizonenensis);GOURAMA H等[13]研究表明,市售的青贮饲料接种植物乳杆菌、保加利亚乳杆菌(Lactobacillus bulgaricus)和嗜酸乳杆菌(Lactobacillus acidophilus)的混合菌种,对黄曲霉具有抗菌活性;DEY R等[14]研究发现,从花生根际筛选的假单胞菌对黄曲霉具有防治效果;潘洁茹等[15]从福建省建瓯市柑桔园分离筛选出一株虫生真菌,扁座壳孢Jos009,用滤纸片法研究了其胞外代谢产物对黄曲霉菌生长的抑制作用,结果表明抑制作用明显,抑菌圈直径达17 mm。其中,关于芽孢杆菌的报道最多。徐铭乾等[16]筛选出一株能够抑制黄曲霉生长的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)HSP-5;李俊峰等[17]以烟台黄曲霉污染区域土壤为材料,采用稀释分离法和琼脂扩散法,筛选到1株对黄曲霉有抑制作用的空气芽孢杆菌(Bacillus aerius)Y-17-3;涂彩虹等[18]从土壤中分离纯化出一株具有黄曲霉拮抗活性的枯草芽孢杆菌,该菌株的次生代谢产物具有抑制黄曲霉生长的效果,抑菌率可达63%;PETCHKONGKAEW A等[19]将从泰国北部的大豆和新鲜豆豉分离出来的23株芽孢杆菌与黄曲霉共培养,发现大多数芽孢杆菌都可抑制黄曲霉生长,效果最好的两种菌株分别为枯草芽孢杆菌和地衣芽孢杆菌(Bacillus licheniformis)。XIA X H等[20]分离到一株枯草芽孢杆菌(Bacillus subtilis)JSW-1,对黄曲霉的抑制率为58.3%。AFSHARMANESH H等[21]研究发现,枯草芽孢杆菌UTB1可抑制黄曲霉孢子的萌发,抑制率为39.45%;但是,目前仍然存在抑制效果差的的问题。
枯草芽孢杆菌(Bacillus subtillis)是一类常见的安全性较高的革兰氏阳性菌,具有多种抑菌作用。本研究以从花生原产地土壤中筛选得到的1株对黄曲霉具有较强拮抗作用的枯草芽孢杆菌(Bacillus subtilis)21-1-2为研究对象,抑菌圈直径为响应值,通过单因素试验和响应面试验对其发酵条件进行优化,为进一步研究该菌株的抗菌活性物质及其相关次级代谢产物奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
黄曲霉(Aspergillus flavus)(保藏号CGMCC3.2890):中国普通微生物菌种保藏管理中心;枯草芽孢杆菌(Bacillus subtilis)21-1-2:潍坊出入境检验检疫局。
1.1.2 试剂
胰蛋白胨、琼脂、酵母提取物(均为生化试剂):北京奥博星生物技术责任有限公司;氯化钠、无水乙醇(均为分析纯):天津科密欧化学试剂有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:土豆去皮切块,每200 g加入500 mL去离子水,煮沸30 min。双层纱布过滤后,加入20 g蔗糖,20 g琼脂粉,加去离子水至1 L;115 ℃条件下高压灭菌30 min。
LB培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠5 g,琼脂20g,去离子水1L,pH7.0;121℃条件下高压灭菌20min。LB液体培养基中不添加琼脂。
1.2 仪器与设备
S-4800型扫描电子显微镜:日本Hitachi公司;JA12002型电子天平:精密科学仪器公司;MLS-3020型湿热高压灭菌器:日本SANYO公司;BUCHI Rota vapor R-200型旋转蒸发仪:上海精宏试验设备有限公司;SW-OJ-2FD型洁净工作台:苏州安泰安气技术有限公司;MT-180B型生化恒温培养箱:上海新苗医疗器械制造有限公司;HWY111型恒温培养振荡器:智诚分析仪器制造公司。
1.3 方法
1.3.1 黄曲霉孢子的制备
将黄曲霉菌株接种到PDA斜面,28 ℃条件下培养6 d后加入4 mL 0.9%的无菌生理盐水,充分振荡后滤掉菌丝,调整孢子浓度为1×107个/mL,待用。
1.3.2 拮抗黄曲霉活性的测定
采用滤纸片法[25]测定抑菌活性。具体操作:取100 μL制备好的黄曲霉孢子液均匀涂布于PDA平板。将Bacillus subtilis21-1-2发酵液离心(13 000 r/min,10 min),去除菌体,收集上清液过0.22μm无菌微孔滤膜,取上清液100μL缓慢滴于涂布有黄曲霉的培养皿中的8mm滤纸片上,28℃恒温培养48 h,用游标卡尺测量抑菌圈直径,平行试验3次,取平均值。
1.3.3 枯草芽孢杆菌21-1-2培养条件优化
初始发酵条件:将Bacillus subtilis21-1-2按1%(V/V)的接种量接种于LB液体培养基,初始发酵条件为培养温度37 ℃、初始pH 7.0、摇床转速180 r/min、培养时间36 h。
单因素试验:采用单因素轮换法,依次考察培养时间(12 h、24 h、36 h、48 h、60 h、72 h、84 h、96 h)、培养温度(31 ℃、33 ℃、35 ℃、37 ℃、39 ℃)、初始pH值(3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0)、转速(140 r/min、160 r/min、180 r/min、200 r/min、220 r/min)对Bacillus subtilis21-1-2拮抗黄曲霉活性的影响。
响应面试验:在单因素试验基础上,以抑菌圈直径(Y)为响应值,选取培养时间(A)、培养温度(B)、初始pH值(C)及转速(D)为考察因素,根据Box-Behnken试验设计原理,设计4因素3水平的Box-Behnken试验[22],以-1、0、1分别代表自变量的低、中、高水平。各因素与水平见表1。
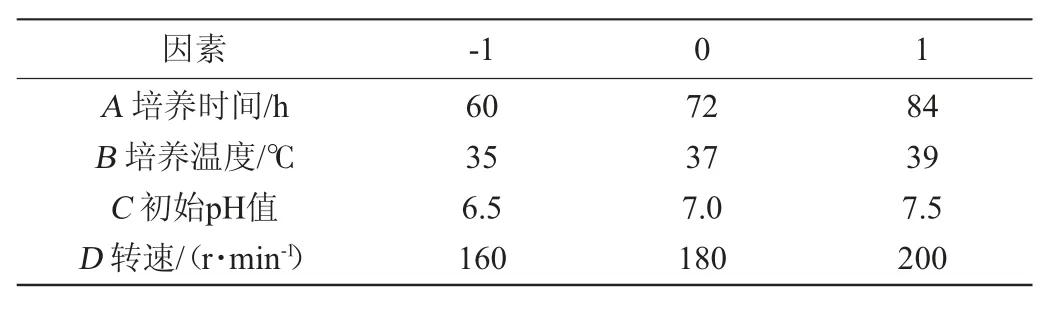
表1 枯草芽孢杆菌21-1-2培养条件优化Box-Behnken试验因素与水平Table 1 Factors and levels of Box-Behnken tests for culture conditions optimization of Bacillus subtilis 21-1-2
采用Design-Expert.V 8.0.6软件对数据进行二次回归拟合,得到多元二次回归方程,分析各因素的主效应和交互效应,依据回归方程绘制响应面立体分析图,得出响应面规范分析结果,确定最佳培养条件。
2 结果与分析
2.1 枯草芽孢杆菌21-1-2培养条件优化单因素试验结果
2.1.1 培养时间对Bacillus subtilis21-1-2拮抗黄曲霉活性的影响
培养时间对Bacillus subtilis21-1-2拮抗黄曲霉活性的影响见图1。由图1可知,随着培养时间的延长,抑菌圈直径呈先增大后减小的趋势,当培养时间为72 h时,抑菌圈直径最大,为23.68 mm。因此,确定Bacillus subtilis21-1-2的最适培养时间为72 h。
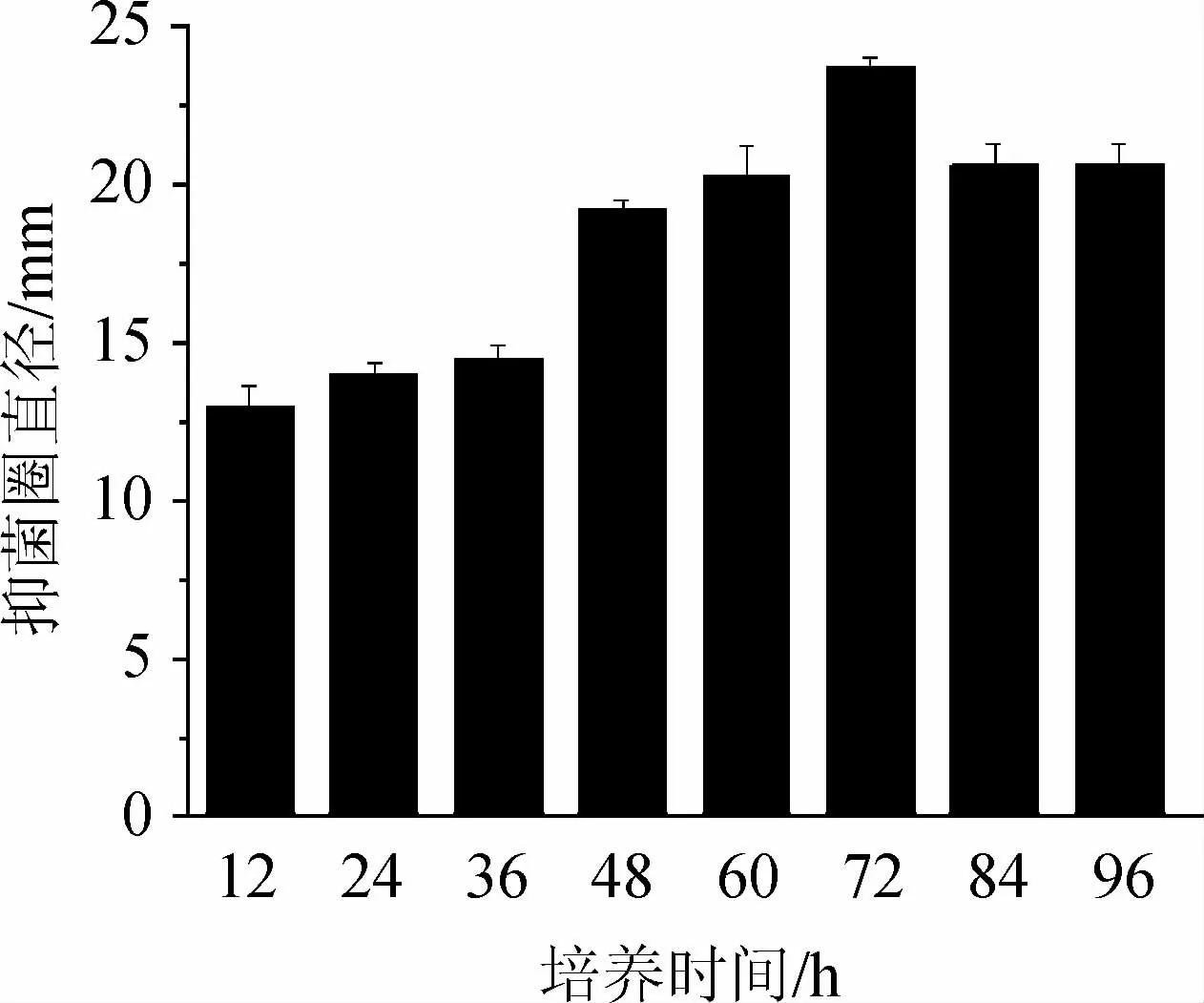
图1 培养时间对枯草芽孢杆菌21-1-2拮抗黄曲霉活性的影响Fig.1 Effect of culture time on the activity of Bacillus subtilis 21-1-2 against Aspergillus flavus
2.1.2 培养温度对Bacillus subtilis21-1-2拮抗黄曲霉活性的影响
培养温度对Bacillus subtilis21-1-2拮抗黄曲霉活性的影响见图2。由图2可知,随着培养温度的升高,抑菌圈直径呈先增大后减小的趋势,当培养温度为37 ℃时,抑菌圈直径最大,为23.87 mm。因此,确定Bacillus subtilis21-1-2的最适培养温度为37 ℃。
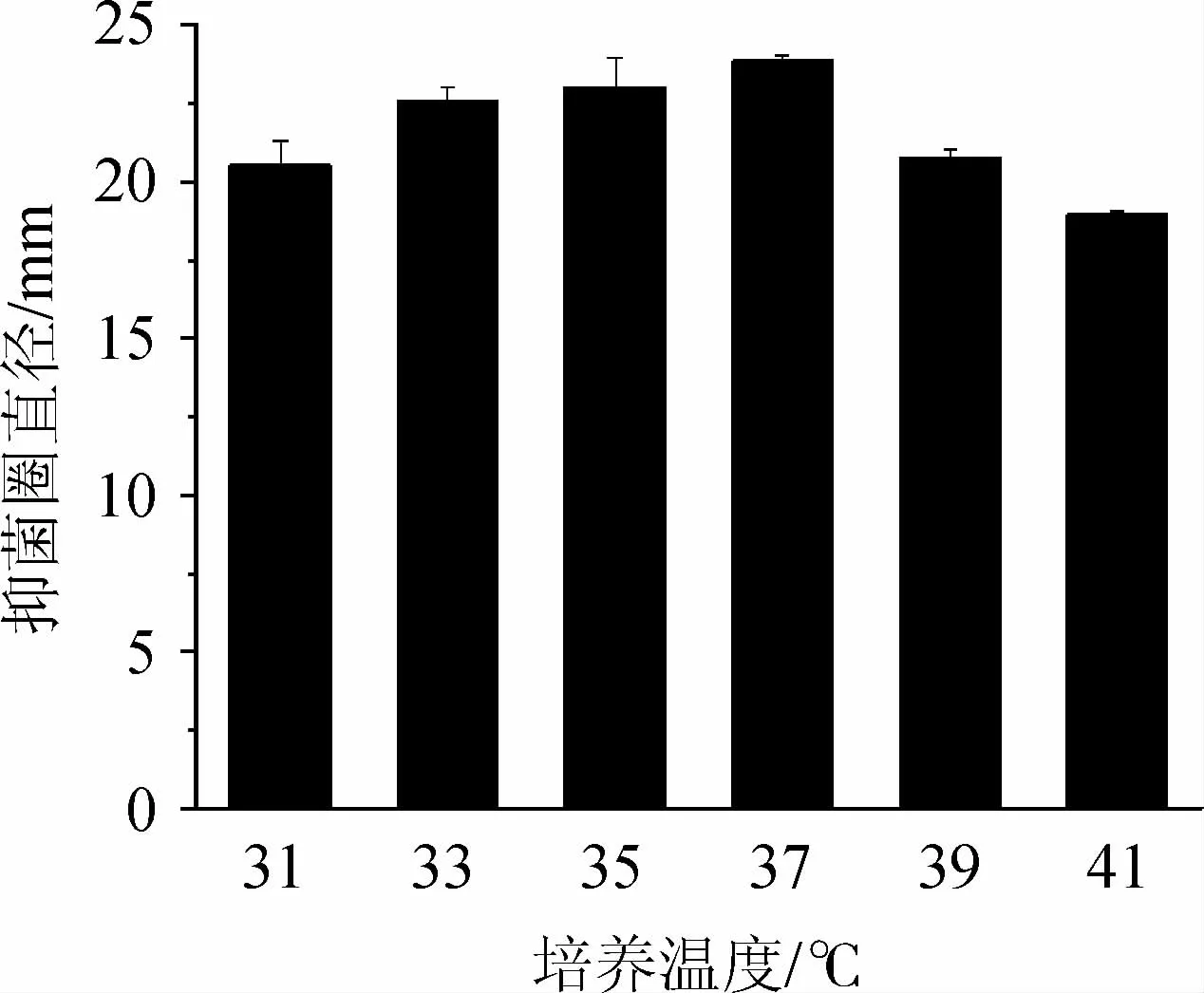
图2 培养温度对枯草芽孢杆菌21-1-2拮抗黄曲霉活性的影响Fig.2 Effect of culture temperature on the activity of Bacillus subtilis 21-1-2 against Aspergillus flavus
2.1.3 初始pH值对Bacillus subtilis21-1-2拮抗黄曲霉活性的影响
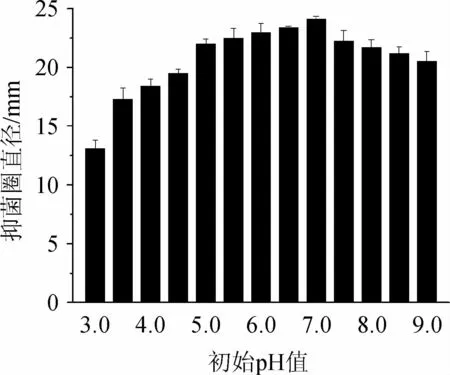
图3 初始pH值对枯草芽孢杆菌21-1-2拮抗黄曲霉活性的影响Fig.3 Effect of initial pH on the activity of Bacillus subtilis 21-1-2 against Aspergillus flavus
初始pH值对Bacillus subtilis21-1-2拮抗黄曲霉活性的影响见图3。由图3可知,随着初始pH值的增加,抑菌圈直径呈先增大后减小的趋势,当初始pH值为7.0时,抑菌圈直径最大,为24.10 mm。因此,确定Bacillus subtilis21-1-2的最适初始pH值为7.0。
2.1.4 转速对Bacillus subtilis21-1-2拮抗黄曲霉活性的影响
转速对Bacillus subtilis21-1-2拮抗黄曲霉活性的影响见图4。由图4可知,随着转速的增加,抑菌圈直径呈先增大后减小的趋势,当转速为180 r/min时,抑菌圈直径最大,为24.33 mm。因此,确定Bacillus subtilis21-1-2的最适转速为180 r/min。
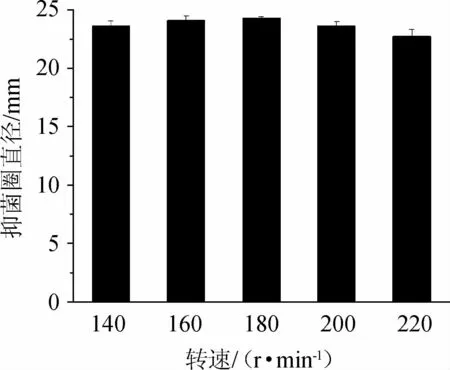
图4 转速对枯草芽孢杆菌21-1-2拮抗黄曲霉活性的影响Fig.4 Effect of shaking speed on the activity of Bacillus subtilis 21-1-2 against Aspergillus flavus
2.2 枯草芽孢杆菌21-1-2培养条件优化响应面试验结果
响应面法常被应用在多个影响因素共同存在的优化研究工作中,此方法与传统方法相比,具有节约时间、空间以及原材料的优点[23]。在单因素试验的基础上,以抑菌圈直径(Y)为响应值,培养时间(A)、培养温度(B)、初始pH值(C)及转速(D)为考察因素,采用响应面分析法进行4因素3水平试验,结果与分析见表2,回归模型的方差分析见表3。
采用Design-expert.V 8.0.6软件对表2的试验结果进行多元回归拟合,得到抑菌圈直径(Y)对自变量培养时间(A)、培养温度(B)、初始pH值(C)及转速(D)的二次回归方程:

由表3可知,模型的P值<0.01,极显著,说明模型构建成功,能反映响应值的变化。失拟项P值>0.05,回归方程拟合效果较好,模型选择恰当。决定系数R2=0.924 5,调整决定系数R2adj=0.621 4,说明该模型的预测值与实际值具有较好的拟合性,可以用此模型对抑菌圈直径进行预测。各因素对抑菌圈直径影响的主次顺序为A>B>D>C,其中,交互项BC、CD、二次项A2、B2、D2对结果影响极显著(P<0.01),一次项A、交互项AD、BD、二次项C2对结果影响显著(P<0.05),而其他项对结果影响不显著(P>0.05)。
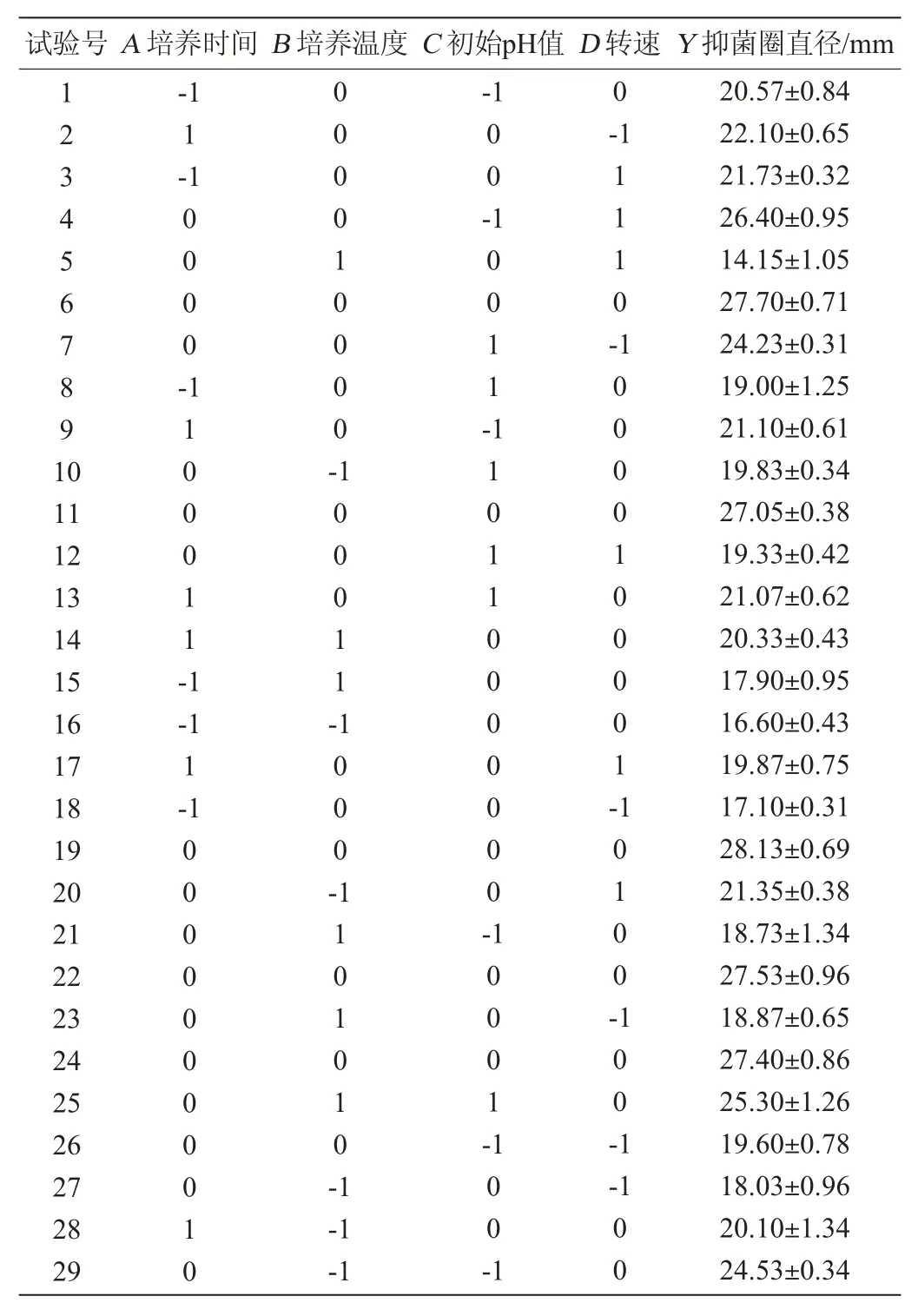
表2 枯草芽孢杆菌21-1-2培养条件优化Box-Behnken试验结果与分析Table 2 Results and analysis of Box-Behnken tests for culture condition optimization of Bacillus subtilis 21-1-2
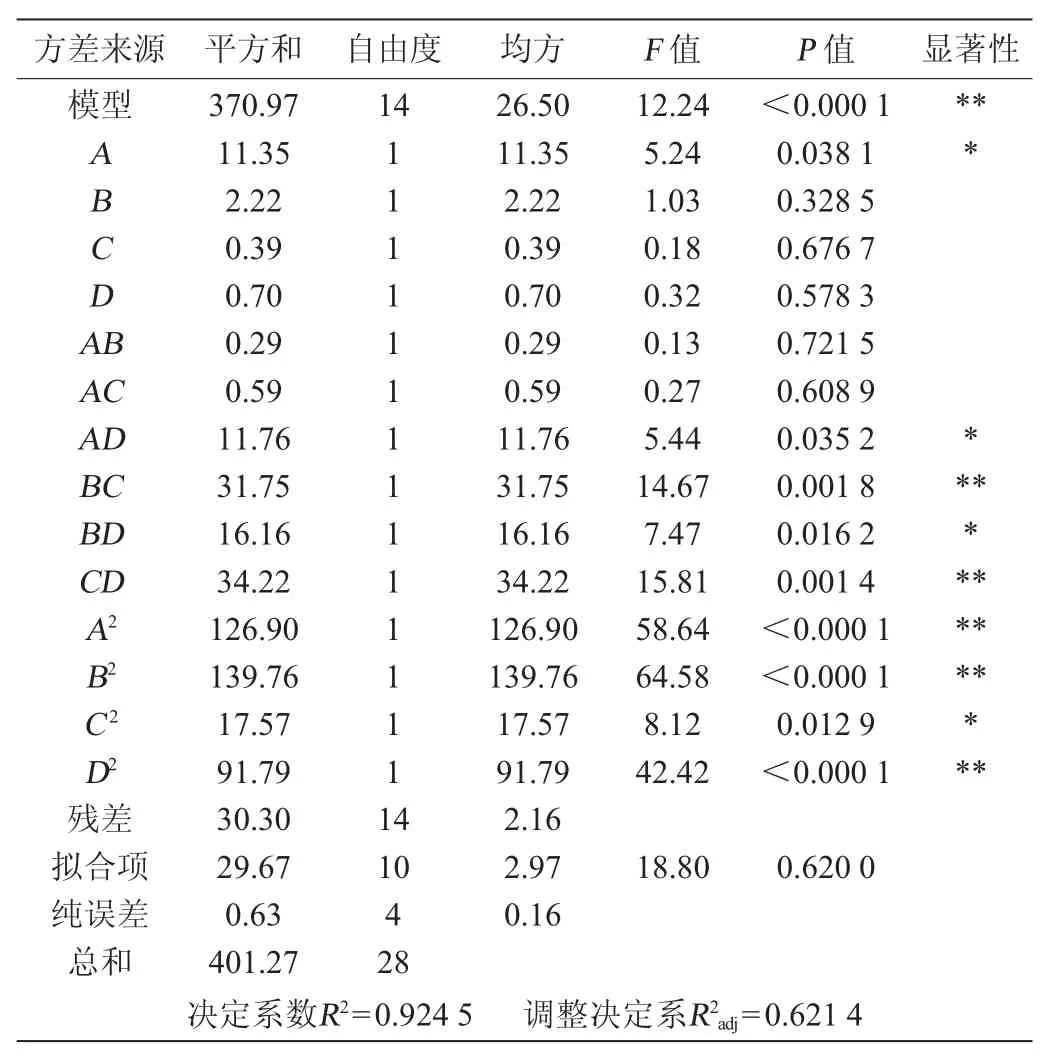
表3 回归模型的方差分析Table 3 Variance analysis of regression model
采用Design-expert.V 8.0.6软件依据回归方程绘制响应面及等高线,结果见图5。
由图5可知,随着各因素水平的增大,响应值呈先升高后降低的趋势,说明存在最大值。培养温度和初始pH值、初始pH值和转速的等高线均为明显的椭圆,说明培养温度和初始pH值、初始pH值和转速的交互作用对抑菌直径影响极显著。
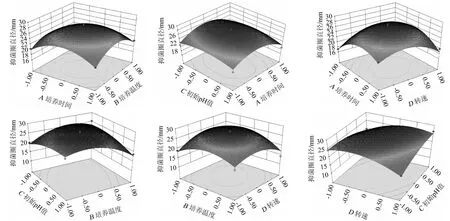
图5 各因素交互作用对枯草芽孢杆菌21-1-2抗黄曲霉活性影响的响应面及等高线Fig.5 Response surface plots and contour lines of effects of interaction between each factor on the activity of Bacillus subtilis 21-1-2 against Aspergillus flavus
通过Design-Expert.V 8.0.6软件对模型进行优化求解,得到Bacillussubtilis21-1-2的最佳培养条件为培养时间72.16 h、培养温度为36.31 ℃、初始pH值6.65、转速187.89 r/min,预测的抑菌直径为27.76 mm。考虑到实际操作性,将最佳培养条件修订为培养时间72 h,培养温度36 ℃,初始pH值6.7,摇床转速188 r/min。为了检验Box-Behnken试验结果的可靠性,在最佳培养条件下进行3组平行验证试验。结果表明,Bacillus subtilis21-1-2对黄曲霉抑菌直径达到27.42 mm,与预测理论值相对误差较小,说明回归模型预测值具有良好符合性,结果可信。
3 结论
通过单因素试验和响应面试验确定枯草芽孢杆菌(Bacillus subtilis)21-1-2拮抗黄曲霉的最佳培养条件为培养时间为72 h,培养温度36 ℃,初始pH值6.7,摇床转速188 r/min。在此优化条件下,Bacillus subtilis21-1-2抑菌圈直径为27.42 mm,是优化前(14.36 mm)的1.9倍。

