大曲中氯氟氰菊酯降解菌的分离筛选及特性研究
王若瑜,曹 明,陈晶瑜*
(中国农业大学 食品科学与营养工程学院 食品质量与安全北京实验室,北京 100083)
据联合国粮食及农业组织统计,世界粮食生产因病虫鼠草害常年损失高达35%,农药作为重要的农业生产资料,在减少作物损失、保障粮食安全上贡献巨大[1]。然而,过量使用农药造成严重的农药残留,不仅会影响地表植被及土壤微观成分,还会通过地下及地表径流流入海洋,影响水生生物圈的安全,通过蒸发影响大气成分,甚至通过食物链影响人类健康[2]。高效氯氟氰菊酯(cyhalothrin)是一种高效、广谱、速效拟除虫菊酯类杀虫剂、杀螨剂,以触杀和胃毒作用为主,无内吸作用[3]。主要抑制昆虫神经轴突部位的传导,对昆虫具有趋避、击倒及毒杀的作用,杀虫谱广,药效迅速,对刺吸式口器的害虫及害螨有一定防效,持效期长,是一种典型的农药杀虫剂[4]。随着有机氯、有机磷等高毒农药禁用,高效氯氟氰菊酯由于拥有较高的生物活性和光谱型,被广泛应用于农业生产、害虫控制和公共卫生方面,因此,安全性问题也随之而来[5-6]。
降解环境中残留的农药,一方面要开发高效、低毒、低残留的化学农药或生物农药,另一方面则是要找到能够高效、快速降解农药残留的制剂[7]。微生物降解农药相较于其他方式,成本低、见效快、安全性高,被认为是最有效的降解方式[8]。目前已分离有许多可降解农药的微生物,这些微生物大多数来源于土壤,主要包括细菌、真菌、放线菌和藻类,细菌由于适应能力强在降解农药的微生物中占有重要地位,主要种属有假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、黄单孢杆菌属(Xanthomonas)、硫杆菌属(Thiobacillus)、固瘤细菌属(Azotomonus)等。由于这些菌株都来自农药污染严重的土壤以及水体污泥中,筛选得到的菌株安全性受到质疑,应用也受到限制[9-11]。因此,寻求安全可靠的菌株来源成为降解农药残留的关键[12]。
大曲作为我国传统白酒和醋的糖化发酵剂,微生物种类繁多,安全性高,能为白酒提供风味物质[13-14]。HAN Y T等[15-16]研究发现,在白酒发酵过程中,敌敌畏、杀螟硫磷、马拉硫磷、溴氰菊酯等农药质量浓度显著下降,说明白酒发酵过程中的一些微生物对低质量浓度农残有显著的降解作用。因此,以传统食品发酵剂大曲中的微生物作为菌株来源,针对农作物中常见农药残留的降解情况进行探究,既可以保证低质量浓度农药残留的高效降解,又可以确保菌株来源的安全可靠。
本研究以传统食品发酵剂大曲中的微生物资源为研究对象,筛选具有强降解氯氟氰菊酯能力的菌株,并探究氯氟氰菊酯质量浓度变化与菌株生长情况的关联性,最后,采用模拟混合农残体系验证其农残降解能力。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
汾酒大曲:山西杏花村汾酒厂股份有限公司。
1.1.2 培养基
基础盐培养基(minimal salt medium,MSM)[17]:NH4NO31.5 g/L,KH2PO40.5 g/L,K2HPO41.5 g/L,MgSO4·7H2O 0.2 g/L,NaCl 1.0 g/L,121 ℃高压灭菌15 min。固体培养基中添加20 g/L琼脂。
LB培养基:北京奥博星生物技术有限公司。
1.1.3 化学试剂
琼脂(生化试剂):北京奥博星生物技术有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;ExTaq酶(5 U/μL):日本TAKARA公司;三唑酮、氰戊菊酯、氯氟氰菊酯、溴氰菊酯、吡虫啉、硫丹、甲霜灵农药标准品(纯度>98%):北京百灵威科技有限公司;乙腈(色谱纯)、氯化钠、无水乙醇、硝酸铵、磷酸二氢钾、磷酸氢二钾、七水合硫酸镁、葡萄糖、无水硫酸镁(均为分析纯):北京北化精细化学有限责任公司。
1.2 仪器与设备
3K15冷冻离心机:德国Sigma公司;2800UV紫外分光光度计:尤尼科(上海)仪器有限公司;AG223B1聚合酶链式反应(polymerase chain reaction,PCR)仪:德国EPPENDORF公司;GC-MS-QP 2010 Plus气相色谱-质谱联用(gas chromatography-massspectrometer,GC-MS)仪:日本岛津公司;毛细管柱HP-5(30 m×0.25 mm×0.25 μm):美国安捷伦公司。
1.3 实验方法
1.3.1 氯氟氰菊酯降解菌的富集、分离与筛选
称取10 g大曲样品于90 mL无菌生理盐水中,置于漩涡混匀器上振荡40 min,充分混匀后制成菌悬液。吸取1 mL菌悬液于含有10 mg/L氯氟氰菊酯的MSM中,30 ℃、150 r/min条件下培养7 d。取1 mL菌液转接至含有50 mg/L氯氟氰菊酯的MSM中,相同条件下继续培养7 d后转接,逐步提高氯氟氰菊酯的质量浓度至400 mg/L。将得到的菌液在超净工作台内以10倍稀释法进行梯度稀释。选取原液及稀释度为10-1、10-2、10-3的菌悬液分别涂布于含有100 mg/L氯氟氰菊酯的固体MSM上,37 ℃条件下培养2~3 d。挑取生长较快、生长状况较好的不同形态的菌落,在含有100 mg/L氯氟氰菊酯的固体MSM上转接3代,验证菌株的氯氟氰菊酯耐受性,以筛选耐受性较好的菌株。
1.3.2 氯氟氰菊酯降解菌生长曲线的测定
挑取单菌落于LB液体培养基,于37 ℃、180 r/min条件下培养至OD600nm值为1.0±0.1,使菌株处于对数生长期,得到种子液。按5%(V/V)的接种量将种子液接种于LB液体培养基中,于37 ℃、180 r/min条件下培养20 h,每2 h测定菌株OD600nm值,以筛选生长状况较好的菌株。
1.3.3 氯氟氰菊酯降解菌的分子生物学鉴定
采用细菌基因组DNA提取试剂盒提取氯氟氰菊酯降解菌的基因组DNA,以其为模板,采用细菌16S rRNA基因扩增通用引物Be-for(5'-AGAGTTTGATCCTGGCTCAG-3')和Be-rev(5'-AAGGAGGTGATCCAGCCGCA-3')进行PCR扩增[18]。PCR扩增体系:上下游引物分别1 μL、菌液2 μL、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)4 μL、ExTaq酶0.25 μL、10×ExTaqBuffer 5 μL,用双蒸水(ddH2O)补齐至50 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸1 min,共循环35次;72 ℃再延伸7 min。PCR扩增产物用1%琼脂糖凝胶电泳检测并由华大基因(北京)有限公司进行纯化并测序。将测序结果提交至美国国立生物技术信息中心的GenBank数据库中进行Blast比对搜索,选取同源性较高的模式菌株的16S rRNA序列,采用MEGA中的邻接法构建系统发育树,确定菌株的种属。
1.3.4 菌株的培养
将处于对数生长期的种子液在5000×g条件下离心5min,弃上清,采用MSM洗涤菌体沉淀后混匀,重复洗涤2次后加入MSM,振荡重悬以制备菌悬液。添加5%菌悬液与1%葡萄糖至含有不同质量浓度农药的MSM中,降解率对照组中不加入菌悬液,生长对照组中不加入农药,与处理组同时在37 ℃、180 r/min条件下培养7 d。每组作3个平行。
1.3.5 氯氟氰菊酯降解率的测定
田间喷洒氯氟氰菊酯的质量浓度一般为4~10 mg/L[7],考虑到氯氟氰菊酯的自然降解等情况,考察菌株在含2mg/L、5 mg/L、10 mg/L氯氟氰菊酯的MSM中培养7 d后氯氟氰菊酯的降解率,确定最优菌株。
1.3.6 混合农药对菌株生长及农药降解率的影响
典型的农药代表有三唑酮、氰戊菊酯、氯氟氰菊酯、溴氰菊酯、吡虫啉、甲霜灵、硫丹,采用以上7种农药模拟混合农残体系进行研究。在MSM中添加质量浓度均为5 mg/L的三唑酮、氰戊菊酯、氯氟氰菊酯、溴氰菊酯、吡虫啉、甲霜灵、硫丹[19],按照方法1.3.4培养菌株,考察混合农药对菌株生长及农药降解率的影响。
1.3.7 农药含量的测定方法
吸取2 mL菌液于12 000×g条件下离心5 min,收集上清液1.5 mL,加入等体积乙腈,剧烈振荡1 min,加入1.5 g氯化钠振荡1 min,3 800 r/min离心5 min,取1 mL上清液于装有150 mg无水硫酸镁的2 mL离心管中,振荡1 min,10 000 r/min离心1 min,取上清液,经0.22 μm有机系滤膜过滤后,采用GC-MS法[20]测定农药的含量。
GC条件:HP-5毛细管柱(30 m×0.25 mm×0.25 μm);载气为氦气(He),柱流速1.0 mL/min;进样口温度280 ℃,不分流进样模式,进样量1 μL;色谱柱升温程序为初始温度100 ℃,以20 ℃/min升至220 ℃,再以10 ℃/min升至300 ℃,保持8 min。
MS条件:载气为氦气(He);碰撞器为氩气(Ar);传输线温度为290 ℃;离子源为电子电离(electron ionization,EI)源;离子源温度为250 ℃;电子能量为70 eV;溶剂延迟时间为2.5 min;多选择离子存储(selective ion storage,SIS)检测。
定性定量:采用保留时间定性,外标法定量。
1.3.8 农药降解率的计算
通过GC-MS法得到各农药含量后计算其降解率,计算公式如下:
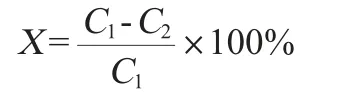
式中:X为农药降解率,%;C1为培养7 d后对照组中农药残留质量浓度,mg/L;C2为培养7 d后处理组中农药残留质量浓度,mg/L。
2 结果与分析
2.1 氯氟氰菊酯降解菌的筛选结果
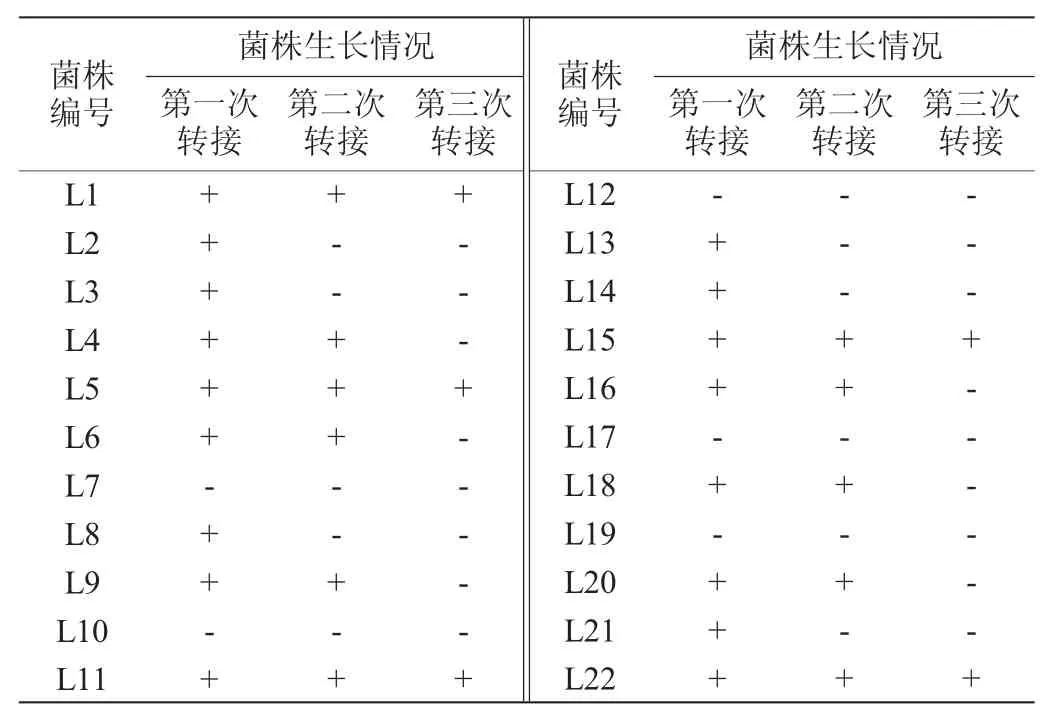
表1 筛选菌株的氯氟氰菊酯耐受性Table 1 Cyhalothrin tolerance of screened strains
农药降解菌的酶系可利用农药生长繁殖,将其代谢,达到农药降解的目的。因此,在以农药为碳氮源的培养基中生长繁殖能力越强的菌株,对于农药的代谢能力越强,农药降解速度越快。无氮源、碳源等生长因子的环境条件对菌株生长是不利的,因此,农药降解菌筛选过程中需严格控制除农药外的碳源[21]。通过富集培养,在含有100 mg/L氯氟氰菊酯的固体MSM上初步筛选出22个生长较快、生长状况较好的不同形态的菌落,编号为L1~L22。经含有100 mg/L氯氟氰菊酯的固体MSM转接3代后,验证各筛选菌株的氯氟氰菊酯耐受性,结果见表1。
由表1可知,菌株L1、L5、L11、L15、L22可耐受氯氟氰菊酯并继续生长,进一步对这5株菌的生长能力进行测定,结果见图1。
由图1可知,菌株L1、L5的生长比较旺盛,在LB培养基中很快突破延滞期,进入对数生长期,且生长情况显著优于菌株L11、L15、L22,故选取菌株L1、L5作为目标菌株。
2.2 氯氟氰菊酯降解菌的鉴定结果
菌株L1、L5的分子生物学鉴定系统发育树见图2~图3。
由图2~图3可知,菌株L1和L5分别与驹形白色杆菌(Leucobacter komagatae)和玫瑰红红球菌(Rhodococcus rhodochrous)聚于一支,亲缘关系最近。因此,确定菌株L1为驹形白色杆菌(Leucobacter komagatae),菌株L5为玫瑰红红球菌(Rhodococcus rhodochrous)。
2.3 氯氟氰菊酯降解率的测定
菌株L1和L5在含2 mg/L、5 mg/L、10 mg/L氯氟氰菊酯的MSM中培养7 d后氯氟氰菊酯的降解率见图4。
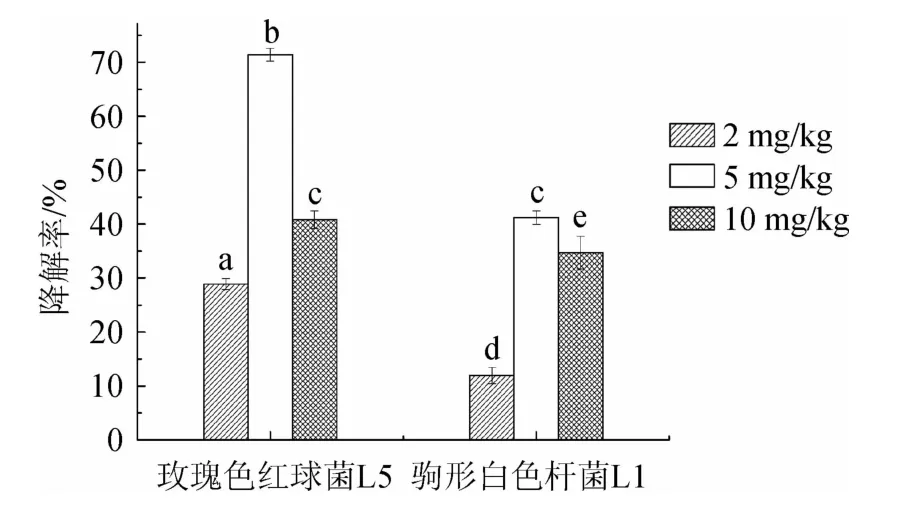
图4 菌株L1和L5对氯氟氰菊酯的降解率Fig.4 Degradation rates of cyhalothrin by strain L1 and L5
由图4可知,菌株L1和L5均对质量浓度为2mg/L、5mg/L、10 mg/L的氯氟氰菊酯具有一定的降解能力。两株菌降解氯氟氰菊酯总体规律相同,当氯氟氰菊酯质量浓度为5 mg/L时,降解率均最高,菌株L5降解率达到71.44%,说明质量浓度为5 mg/L趋近于菌株最适生长质量浓度。同时研究发现,菌株L5的降解效果更佳,玫瑰色红球菌具有代谢多样性的特点,能有效去除多种化合物,比如石油污染修复、降解有机农药等[22]。此外,红球菌属还能作为某些水产养殖动物的益生菌,可提供水产养殖动物必须的类胡萝卜素[23],是一株具有应用前景的安全菌株。因此,后续对菌株L5的氯氟氰菊酯降解特性进行进一步分析。
2.4 菌株L5的生长与氯氟氰菊酯降解动态的相关性
为进一步探究发酵过程中菌株L5对氯氟氰菊酯的降解动态、菌株L5的生长动态及二者之间的相关性,在质量浓度为5 mg/L氯氟氰菊酯培养体系下测定了菌株L5的生长和氯氟氰菊酯降解情况,结果见图5。

图5 菌株L5的生长曲线和氯氟氰菊酯降解动态曲线Fig.5 Growth curve of strain L5 and degradation dynamic curve of cyhalonthrin
由图5可知,发酵0~7 d,在未接种菌株L5的对照组中,氯氟氰菊酯质量浓度从4.95 mg/L下降至3.98 mg/L,而接种菌株L5组中,氯氟氰菊酯质量浓度从4.94 mg/L下降至1.13 mg/L,且在0~3 d内变化量最多,说明菌株L5对氯氟氰菊酯降解能力较强。在MSM中加入质量浓度为5 mg/L的氯氟氰菊酯,菌株L5的OD600nm值高于未添加氯氟氰菊酯MSM,说明氯氟氰菊酯的添加对菌株L5的生长有促进作用。说明氯氟氰菊酯的浓度变化与菌株生长密度有关。
2.5 混合农药对菌株L5生长及农药降解率的影响
为了确定菌株L5在实际生产时的实用性,对菌株L5在混合农药中的生长情况与农药降解率进行探究,结果见图6。
由图6可知,与无农药添加MSM中菌株L5的生长情况相比,菌株L5在含有混合农药MSM中的生长有明显的促进作用,同时,7种农药均被降解,可能由于菌株L5对混合农药具有很高的耐受性,可以利用混合农药作为碳源生长或在有葡萄糖作为初级能源的条件下,对农药进行共代谢,既促进了菌株L5的生长,同时又加快了自然条件下混合农药的降解速度,提高了混合农药的降解率。在含有混合农药MSM中,菌株L5对菊酯类农药氯氟氰菊酯、氰戊菊酯与溴氰菊酯的降解率分别达到52.8%、44.6%、37.5%,占绝对优势,同时,对吡虫啉、硫丹、甲霜灵等其他类型杀虫剂类农药的降解率也较高,具有较宽的降解谱。
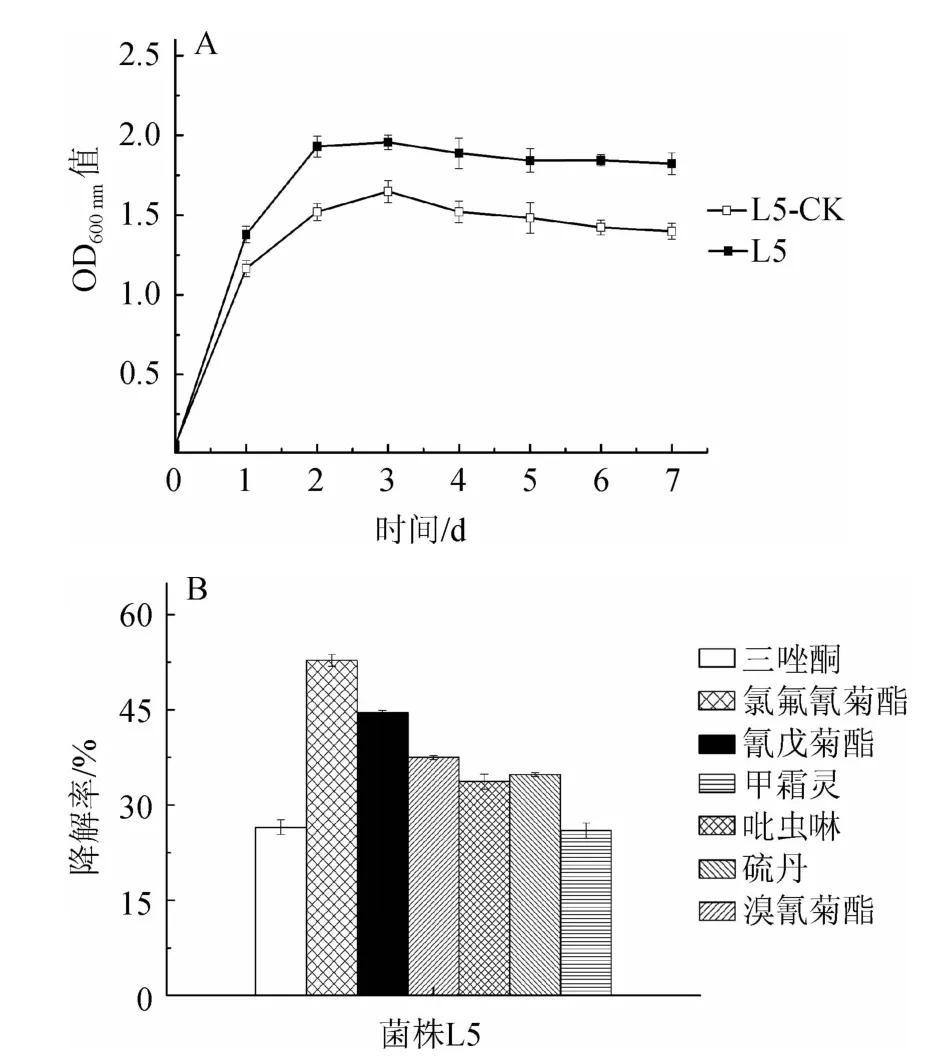
图6 菌株L5在含混合农药基础盐培养基中的生长情况(A)及农药降解率(B)Fig.6 Strain L5 growth (A) and pesticide degradation rate (B) in minimal salt medium with mixed pesticides
3 结论
本研究从大曲中分离得到5株能够高效降解氯氟氰菊酯的菌株,其中菌株L1和L5生长旺盛且氯氟氰菊酯降解率高,通过分子生物学技术分别鉴定为驹形白色杆菌(Leucobacter komagatae)与玫瑰红红球菌(Rhodococcus rhodochrous)。两株菌对5 mg/L氯氟氰菊酯的降解效果最好,且玫瑰红红球菌L5降解率最高,达到71.44%。氯氟氰菊酯的添加能促进玫瑰红红球菌L5的生长,且玫瑰红红球菌L5的生长能促进氯氟氰菊酯的降解,氯氟氰菊酯的浓度变化与菌株生长密度有关。在混合农残体系中,玫瑰红红球菌L5有较强降解能力,其中对氯氟氰菊酯的降解率最高,降解率达到52.8%。对其他农药氰戊菊酯、溴氰菊酯、吡虫啉、硫丹、甲霜灵等其他类型杀虫剂类农药的降解率较高,达20%以上,具有较宽的降解谱。综上,玫瑰红红球菌L5是一株性能优异、生长旺盛、降解谱较宽的功能菌株,对高效氯氟氰菊酯单一或混合农残体系具有潜在的应用前景。

