黄酒中氨基甲酸乙酯的研究进展
杨 佳,李新生,3 *,耿敬章,徐悦菱,刘智强,裴金金,3
(1.陕西理工大学 生物科学与工程学院,陕西 汉中 723000;2.陕西理工大学 中国谢村北派黄酒研究院,陕西 汉中 723000;3.陕西省资源生物重点实验,陕西 汉中 723000)
黄酒是中国最古老的酒种,同啤酒和葡萄酒并称为世界三大古老酒种,享有“酒中之祖、酒中之王”的美誉。黄酒因其酒体柔和、香气浓郁、酒味醇厚,加其丰富的营养、独特的风味,受到广大消费者的喜爱。近年来,黄酒已被列入我国重点扶植和发展的酒精饮品之一[1],但黄酒在生产加工、食品质量安全控制方面,与现代化程度较高的啤酒和葡萄酒相比较,还有一定差距。1987年日本有关部门在检测中国出口到日本的部分绍兴黄酒中发现氨基甲酸乙酯(ethyl carbamate,EC)的含量超标(>100 μg/L),并要求我国相关生产企业采取措施进行控制[2]。
氨基甲酸乙酯在一般食品中含量较低,而其在发酵食品(如面包、酸牛奶、乳酪、酱油等)和发酵酒精饮料(如葡萄酒、苹果酒、啤酒、中国黄酒和日本清酒等)中属伴随的副产物[3],含量相对较高,在食品质量与安全方面属潜在危害性成分。目前EC的含量已成为国际社会高度关注的发酵类食品安全热点问题之一,一些国家还规定了不同酒中EC最高限量。围绕葡萄酒、日本清酒中EC产生的生物学基础及代谢调控报道也较多,但关于我国传统黄酒中EC的研究甚少。开展传统黄酒酿造中EC形成的机制及控制技术研究,对我国传统黄酒酿造的安全性具有非常重要的理论价值和现实意义[4]。本文对有关黄酒中EC的形成机理、食品安全性评价、检测方法及控制四个方面的国内外研究现状进行综述,旨在为黄酒生产中降低EC的含量,提升黄酒品质提供借鉴和参考。
1 EC的形成机理
EC分子式为NH2COOC2H5,分子质量89.09,CAS#51-79-6,无色无臭,呈结晶或白色粉末状,易燃,易溶于水、乙醇等,微溶于有机溶剂,不易挥发[5-6]。1971年,LOFROTH G等[7]利用同位素标记实验表明葡萄酒和啤酒中存在EC。EC是在食品发酵过程中产生的一种发酵副产物,广泛存在于发酵食品和酒精饮料中,人体摄取EC的主要途径是饮用酒精饮料[8]。
1.1 氨甲酰化合物与乙醇反应生成EC
1976年,OUGH C S[9]采用气相色谱-质谱联用法(gas chromatography-mass spectrometer,GC-MS)在酸乳酪和葡萄酒中检测到了EC,并证实EC可由氨甲酰化合物与乙醇反应生成。黄酒中发酵代谢产生的氨甲酰化合物主要有:尿素(urea)、瓜氨酸(citrulline)和氨甲酰磷酸(carbamoylphosphate)等[10]。
(1)氨甲酰磷酸-乙醇途径
酿酒酵母在酒精发酵过程中产生的腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)、CO2和氨在氨甲酰磷酸合成酶作用下生成氨甲酰磷酸,其与乙醇反应式如下:
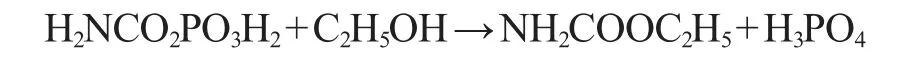
(2)尿素-乙醇途径
OUGH C S等[11]对精氨酸、瓜氨酸、氨、尿素和谷氨酸在发酵饮品发酵过程中对EC形成的影响进行了研究,结果表明,由精氨酸分解产生的尿素与乙醇反应生成的EC含量远多于由氨甲酰磷酸形成的EC含量,成品葡萄酒中绝大部分的EC是由尿素形成的,因此尿素是形成EC的主要前体物质。其反应式如下:

(3)瓜氨酸-乙醇途径
王霈虹[12]在模拟黄酒溶液中,对尿素、瓜氨酸分别与乙醇经加热后形成EC的结果进行分析。结论表明,黄酒中的瓜氨酸与尿素处于同一数量级,可与乙醇在加热条件下也能形成数量可观的EC。因此瓜氨酸也是黄酒中形成EC的重要前体物质。瓜氨酸与乙醇反应式如下:
H2NCONH(CH2)3CH(NH2)COOH+C2H5OH→NH2COOC2H5+H2N(CH2)3CH(NH)COOH
1.2 黄酒工艺中EC的形成
黄酒具有独特的生产工艺,如麦曲酿造、高温煎酒、年份酒勾兑等。虽然采用独特的生产工艺能酿制出独特风味的美酒,但同时其过程中条件控制不当,也会伴随着EC的产生。
(1)麦曲酿造
中国黄酒原料以稻米、麦曲为主,蛋白质含量相对较高,其中高含量的精氨酸分解后产生的尿素与黄酒中乙醇反应生成EC。陈艳[13]在浙江及其附近地区采集了85个黄酒样品,采用液-液萃取(liquid-liquid extraction,LLE)法分别对不同酒曲酿造的黄酒中EC含量进行了检测,结果表明,麦曲酿制的黄酒中EC含量普遍高于红曲酿制。
(2)煎酒与贮酒
较高的煎酒温度与适宜的贮酒条件对黄酒的稳定性和香气形成具有重要作用,但在其过程中会形成更多的EC。加热可加快EC的形成,温度每升高10 ℃,EC的形成速度就增加约1倍[14]。陶新功等[15]在实验中发现,在发酵阶段黄酒中EC含量小幅升高,但煎酒后出现大幅回升的现象,随着黄酒贮存期的延长,EC含量会不断上升,贮存时间相同,温度越高,生成的EC越多。罗苏仅[16]采用GC-MS法对黄酒生产过程中氨基甲酸乙酯含量进行测定结果表明,经煎酒后的黄酒中EC含量是煎酒前的2~4倍;陈酿2年后,EC含量高达113.46 μg/L。
2 EC食品安全性评价
2.1 EC的致癌机理研究
在20世纪40年代,EC以1 g/d的剂量被用作人的催眠剂并作为实验动物的麻醉剂,但在1943年,NETTLESHIP A等[17]通过动物毒理学实验证实EC具有致癌性。每周一次重复向小鼠腹腔内注射最小麻醉剂量的EC并对其肺部细胞进行观察,结果表明,小鼠的肺肿瘤发病率从不到5%增加到了75%以上,肿瘤类型主要是特征性肺腺瘤。大量研究者对EC的致癌机理进行了研究,发现EC在生物体内的代谢途径主要有3种:其一是超过90%的EC可被分解为乙醇、氨和碳水化合物等;其二是约0.5%的EC被细胞色素P450氧化成脱氧核糖核酸(deoxyribonucleic acid,DNA)加聚物,造成DNA双链破坏,导致癌变;此途径被普遍认为是EC的主要致癌途径;其三是0.1%左右的EC被细胞色素(P450)氧化成N-羟基-EC,后者可以诱导Cu2+所调控的DNA损伤从而导致细胞癌变[18]。
2.2 EC食品安全性评价
自1943年EC被发现具有致癌性,世界各国学者又先后在蒸馏酒、酱油和面包等发酵酒精饮料和食品中检测到了EC,这些研究使各国政府对EC在食品安全领域的关注程度日益增加。1985年,加拿大卫生与防疫部门对酒精饮料中EC含量进行规定:佐餐葡萄酒为30 μg/L,加强葡萄酒为100μg/L,蒸馏酒为150μg/L,烈性酒和水果白兰地为400μg/L,日本清酒为100 μg/L。美国食品和药品管理局(food and drug administration,FDA)、美国葡萄酒研究所和美国酒商协会规定:1988年以后生产的佐餐葡萄酒(酒精度≤14%vol)EC含量不能超过15 μg/L,1989年以后生产的甜葡萄酒(酒精度≥14%vol)EC含量不能超过60 μg/L。2002年,联合国粮农组织对EC进行重点监控,制定了国际标准:EC含量不得超过20 μg/L[19]。2007年世界卫生组织国际癌症研究机构(international agency for research on cancer,IARC)正式将EC重新分类,由2B组(或可能令人类患癌的物质)改为2A组(可能令人类患癌的物质)[20-21]。
目前,国际上尚无统一的EC限量,各国仍以加拿大EC限量作为主要参照。我国由于发酵食品种类众多,检测方法不统一等原因尚未制定酒精饮料和发酵食品中氨基甲酸乙酯限量标准[22]。
3 EC的检测方法
早在1993年,我国商检部门采用气相色谱法建立了出口酒中EC的检测标准方法[23]。随着经济的发展和贸易全球化的进行,如何有效检验和控制黄酒中的EC含量,就成为质检部门关注的问题。近几年,相继出现了许多新的检测EC的方法。
3.1 气质联用法
在已报道的各种黄酒中EC的测定方法中,仍以气质联用(gas chromatograph-mass spectrometry,GC-MS)法为主。在气相色谱法的基础上,GC-MS法能快速高效地对样品进行定量和定性分析,更适用于复杂混合物中某组分的鉴定。一般黄酒中的EC检测采用GC-MS法[24],其已被国际葡萄与葡萄酒组织(international vine and wine organization,OIV)、美国官方分析化学师协会(association of official analytical chemists,AOAC)和欧盟纳入检测标准方法[25]。采用GC-MS法检测酒中EC的含量成为了近年来的研究热点之一。
鲍会梅[26]采用GC-MS法测定黄酒中EC的含量。结果表明,采用GC-MS法检测出的EC各项指标均符合国标,且操作简便、检测快速,该方法适用于黄酒中EC的测定。华颖等[27]建立应用同位素内标-GC-MS法快速测定黄酒和食用酒精中EC的分析方法。该方法定量准确、操作简便、灵敏度高,适用于黄酒和食用酒精中氨基甲酸乙酯的测定。
目前GC-MS法已被GB 5009.223—2014《食品安全国家标准食品中氨基甲酸乙酯的测定》采用。
3.2 其他方法
钟其顶等[28]建立了高效液相色谱-荧光法(high performance liquid chromatography-fluorescence detection,HPLCFLD)测定黄酒中EC含量的方法,发现此法更为简单快速、成本较低、易于掌握,适用于生产企业过程监控。王丽娟等[29]建立了超高效液相色谱-电喷雾串联质谱法(ultra performance liquid chromatography-electrospray ionization tandem mass spectrometric,UPLC-ESI-MS/MS)测定黄酒与葡萄酒中EC含量的方法。该方法样品处理简单,前处理过程不使用有机溶剂,测定快速、准确,灵敏度高,适合黄酒中EC的快速检测和定量分析。LUO L等[30]采用间接竞争酶联免疫吸附测定法(competitive inhibition enzyme linked immunosorbent assay,Ci-ELISA法)分析中国黄酒。结果表明,通过Ci-ELISA分析实际样品的结果与GC-MS法的结果相关,该方法具有良好的准确性和可重复性,适用于监测大量样品中的EC。
4 EC的控制
EC的形成途径多种多样,采用单一的方法很难将EC全部清除。国内外关于解决饮料酒中EC问题的研究主要是从减少其来源、工艺条件控制与后续去除等方面去考虑,主要方法如图1所示。我国学者对黄酒中EC的主要控制途径研究方面已做了一些基础性的的工作,其中降低、控制黄酒中EC含量的方法已见报道,并在实际生产中应用。

图1 氨基甲酸乙酯主要控制途径示意图Fig.1 Sketches diagram of the main way to control ethyl carbamate
4.1 构建低产尿素酵母
黄酒中的尿素主要有2个来源:其一是原料、水和辅料会带入一定量尿素;其二是在发酵过程中由酵母菌代谢精氨酸生成。黄酒中绝大部分的尿素是由酿酒酵母代谢精氨酸产生的,直接参与尿素代谢与转运的基因有精氨酸酶编码基因(CAR1)、脲基酰胺酶编码基因(DUR1,2)、尿素转运蛋白基因(DUR3),研究表明[31],酿酒酵母的单个CAR1等位基因表达的精氨酸酶足以降解精氨酸生成大量的尿素,形成数量可观的EC。
(1)敲除CAR1。在酒精发酵时,酵母胞内的CAR1表达水平较高,精氨酸水解产生大量尿素,进而使酒中EC含量增加。赵然然[32]选育低产尿素的黄酒酵母菌株,通过敲除CAR1的方法改造黄酒酵母,降低其精氨酸酶表达活性,减少酵母分解精氨酸产生的尿素,进而降低酒液中EC含量。方逸群等[33]通过紫外诱变试验筛选获得诱变菌株(CAR1缺陷型酵母菌株)。结果表明经过改良菌种发酵获得黄酒产品与原始菌株相比,发酵产物尿素及EC含量显著下降。
(2)过表达DUR1,2和DUR3。酿酒酵母在酒精发酵阶段时,由于DUR1,2表达受到氮代谢阻遏效应(nitrogen catablite repression,NCR)调控,胞内脲基酰胺酶活性很低,不能及时降解由精氨酸水解所产生的大量尿素,多余尿素被分泌到胞外与乙醇反应生成EC[34]。WU D H等[35]采用代谢工程改造了两种酵母菌株N85(DUR1,2)和N85(DUR1,2)-c。使用两种改造菌株发酵的黄酒中EC的浓度比亲本菌株发酵的黄酒分别降低49.1%和55.3%。所有工程菌株均显示出良好的遗传稳定性,适合商业化以提高中国黄酒的安全性。申超等[36]通过采用融合聚合酶链式反应(polymerase chain reaction,PCR)技术提高DUR3的表达水平,构建了尿素吸收型工业黄酒酵母单倍体工程菌Na-uD。通过实验发现Na-uD具有“吸收尿素”的能力,能够有效降低发酵液中尿素及EC的含量,且无外源抗性基因的引入。
4.2 生产工艺过程控制
4.2.1 添加酸性脲酶
通常的尿素降解酶即指脲酶,脲酶分为中性和酸性酶。基于饮料酒的酸性pH,只可添加酸性脲酶。发酵液中的尿素可在外源酸性脲酶的作用下分解为NH3和CO2,进而减少酒中EC的含量[37]。
周建立等[38]构建表达酸性脲酶的乳酸乳球菌,并对重组酸性脲酶对尿素和EC的水解过程进行研究,结果表明重组酸性脲酶对黄酒中尿素具有很好的降解能力(60 mg/L的尿素在25 h内完全被降解)。张傲娜[39]从小鼠粪便、合肥豆制品厂和乳制品厂的污泥中筛选得到一株产酸性脲酶能力较高的菌株,并初步研究该酶对尿素的去除效果。结果表明,该酶能去除75%左右的尿素;经该酶处理的黄酒在煎酒过程中生成的EC含量降低75.7%,表明该酶在黄酒中具有潜在的应用价值。
4.2.2 控制传统生产条件
(1)缩短浸米时间
王宾等[40]通过模拟黄酒的发酵过程,利用分光光度法和平板计数法对黄酒发酵过程中EC相关前体物质的变化规律进行研究,结果表明,黄酒酿造工艺中的浸米阶段会形成瓜氨酸积累,瓜氨酸是EC形成过程中重要的前体物质。因此浸米时间不宜过长,避免黄酒中瓜氨酸的积累。
(2)煎酒与贮存
煎酒与贮存过程均会使黄酒产生数量可观的EC[16-18],但其也是黄酒生产中不可或缺的两个重要工序,所以控制原料及灵活掌握适宜的煎酒条件、贮酒条件和贮酒期,就既能最大程度的保留黄酒营养成分及色、香、味,又能直接减少黄酒中EC的产生量。
(3)EC降解酶
EC降解酶是能直接降解EC的酶,使其降解为氨、CO2和乙醇,此法可直接解决EC问题且不需更换酵母菌种,不改变生产工艺条件和原酒风味特性。刘俊[41]通过基因比较发现,黄酒适用肠杆菌(Enterobactersp.)R-SYB082尿素降解酶是一种酸性脲酶同功酶——脲基乙醇酸酰胺水解酶(ureidoglycolate amidohydrolase,UAH)而非脲酶,该酶能实现黄酒中待去除底物尿素及产物EC的联合控制,具有很好的应用特性与工业开发前景。
目前为止仍没有商品化的EC降解酶生产,一是由于己经报道的产生菌酶活都比较低,二是黄酒中的乙醇和低pH环境也对酶的性质有苛刻的要求,而EC降解酶普遍乙醇耐受性及酸耐受性差。
(4)吸附材料
被广泛开发和应用的吸附性材料是合成树脂,其具有多孔性立体结构的小颗粒,在整个颗粒内部及外部具有表面活性,其与物质间的相互作用能达到物质的分离、净化等目的。
王翼玮等[42]通过筛选得到能够有效吸附黄酒中EC的大孔结构吸附树脂。研究结果表明,该树脂具有良好的吸附性能和再生能力,对EC吸附去除率可达70%以上,且对黄酒的主要理化指标没有显著影响。高雅[43]优选出吸附黄酒中EC效果较好且对其风味物质影响较低的两种树脂材料DM301和DA-201,将二者进行复配后可进一步减少风味物质的损失。另得出结论,在最适工艺条件下黄酒的EC去除率可达76.81%。
5 展望
综上所述,黄酒在酿制及贮存过程产生的EC的含量的控制,目前的研究主要集中在黄酒中EC的形成机理、食品安全性评价、检测方法及控制四个方面。EC的研究已取得一系列成果,但如何在不影响黄酒品质的条件下,高效经济地控制并去除EC,并能大规模应用到实际生产中的技术体系尚未建立。虽然在发酵液中直接添加酸性脲酶控制EC含量的方法已建立,但酸性脲酶只能专一地分解EC合成前体物质尿素,不能分解EC或对其分解率极低,酸性脲酶作用的局限性,影响了其在酒类行业中使用;且由于诸多原因目前为止仍没有商品化的EC降解酶生产。已发现许多新型树脂吸附材料可去除EC,进一步提高去除率,并实现在生产中应用,还需要后续更深入的研究。

