白内障晶状体上皮细胞中miR-126和VEGF的表达关系及意义
梁焱 方晏红 沈强
白内障在世界范围内具有较高的发病率,是获得性致盲性眼病的首要原因[1-3]。探讨白内障的发病机制是降低白内障发病率和致盲率的关键[4]。晶状体上皮细胞凋亡是白内障发生的早期事件,研究发现年龄相关的皮质核白内障上皮细胞凋亡率高,且aspase-3、Bax/Bcl-2高表达。晶状体上皮是紫外线暴露的主要靶点,紫外线照射诱导的晶状体上皮细胞凋亡被用作研究白内障发病机制的体外模型[5]。MicroRNA,也称为miRNA,是动物和植物中广泛存在的一种非编码短链RNA。miRNA可通过降解RNA并通过完全或不完全匹配的靶基因抑制蛋白质翻译来发挥其调节功能[6,7]。最近的研究表明, miR-126b参与了晶状体上皮细胞的凋亡和增殖。据报道,miR-126b在癌症中上调并促进细胞凋亡[8]。越来越多的证据表明异常的VEGF表达与几种人类疾病有关,例如癌症[9]。最近,VEGF被发现在眼睛发育和疾病中起关键作用。VEGF在白内障晶状体上皮细胞中的作用尚不清楚[10]。本研究拟探讨白内障晶状体上皮细胞中miR-126和VEGF的表达关系及意义,为白内障的治疗提供理论及临床依据。
1 资料与方法
1.1 一般资料 本研究纳入了2015年11月至2018年11月重庆市江津区中心医院和重庆市合川区人民医院收治的白内障患者198例(无其他眼疾)作为病例组。白内障患者在白内障手术中获得了新鲜的晶状体前囊。正常晶状体前囊膜标本(来自膜移植中供体眼球的透明晶状体及高度近视透明晶状体摘除术的患者)49例作为对照组。所有晶状体标本为中心前囊,直径约5~6 mm,使用CCC连续环形撕囊术获得。对照组未发现白内障或任何其他眼病。病例组,男80例,女118例;平均年龄(65.45±8.65)岁。对照组,男22例,女27例;平均年龄(66.85±9.43)岁。该研究方案经重庆市江津区中心医院伦理委员会批准。所有试验按照赫尔辛基宣言进行。患者及家属对本次研究知情,并签署知情同意书。
1.2 晶状体中MIR-126、VEGF mRNA的测定 通过实时荧光逆转录-定量聚合酶链反应(RT-qPCR)对MIR-126、VEGF进行RNA提取和定量。将所有组织样品在TRIzol试剂(Invitrogen; Thermo Fisher Scientifc,Inc.,Waltham,MA,USA)中匀浆,并根据制造商的说明分离总RNA。使用PrimeScript RT试剂盒(RR037A; Takara Biotechnology Co.,Ltd.,Dalian,China)在含有以下物质的20 μl反应混合物中将总共1 μg RNA逆转录成第一链cDNA:5X PrimeScript缓冲液(4 μl),PrimeScript RT Enzyme Mix I(1 μl),oligo Dt引物(1 μl),总RNA(1 μg),用不含RNase的dH2O制成20 μl。 RT反应如下进行:37℃15 min,85℃5 s,然后在4℃终止。通过260nm处的吸收测定RNA浓度。通过RT-qPCR对miR-126a进行定量。引物如下:miR-126,F-ACACTCCAGCTGGGTGGCAGTGTCTTAGC,R-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGACAACCAG;VEGF,F-GTGGAGTCGGCTGGGTGGCAGTGGTGGAGTCG,R-GTGGAGTCGGTCGTGGAGTCGGCAATTCAGTTCAGCTGGG;U6,F CTCGCTTCGGCAGCACA和R AACGCTTCACGAATTTGCGT。
1.3 细胞复苏培养 SRA01/04细胞获自中山大学医学院人类病毒研究所。将SRA01/04细胞细胞在高葡萄糖Dulbecco改良的Eagle培养基(DMEM;Gibco Invitrogen;Thermo Fisher Scientific,Inc。)中培养,所述培养基补充有10%胎牛血清(FBS;Gibco Invitrogen;Thermo Fisher Scientific,Inc),100 U/ml青霉素和100 U/ml链霉素(Gibco; Thermo Fisher Scientifc,Inc)。将细胞在含有5%CO2的加湿37℃培养箱中培养。对于每个实验,使用的所有细胞系都在第3代和第8代之间。 在转染前1 d,将细胞在不含抗生素的培养基中接种至约60%的水平。 用绿色荧光蛋白(GFP)标记的MIR-126 inhibitor、MIR-126 mimics组购自Genepharma(中国苏州)。 使用Lipofectamine RNAiMax(Thermo Fisher Scientifc,Waltham,MA,USA)根据制造商的说明书进行细胞转染。 转染后8 h更换培养基,然后每天更换。
1.4 分组设计 SRA01/04细胞组:取10 ml SRA01/04细胞液于10%胎牛血清的DMEM培养液中,置于CO2培养箱(37℃、5% CO2、20% O2);MIR-126 inhibitor、MIR-126 mimics组:取10 ml转染MIR-126 inhibitor、MIR-126 mimics的SRA01/04肝癌细胞细胞液于10%胎牛血清的DMEM培养液中,置于CO2培养箱(37℃、5% CO2、2% O2)。以上3组每孔设6个平行样,培养72 h。
1.5 SRA01/04细胞活力检测 细胞增殖通过细胞计数试剂盒-8(CCK-8;Dojindo Molecular Technologies,Inc)根据制造商的说明书测定。 简而言之,将SRA1/04细胞接种到96孔fl底部平板中,在37℃下生长8 h,并用(50 nmol/L)miRNA模拟物转染。 随后向每个孔中加入10 μl CCK-8染料,将细胞在37℃下孵育0.5 h,并在酶标仪中在450 nm下测量吸光度。
1.6 SRA01/04细胞凋亡及G1期的测定 将3组SRA01/04细胞以1.0×104个细胞/孔的密度接种在6孔板中。 当细胞汇合达到50%时。根据制造商的方案,使用膜联蛋白V-FITC/PI凋亡检测试剂盒测定细胞凋亡。简而言之,在孵育24 h后,用0.25%(W/V)胰蛋白酶消化细胞,用磷酸盐缓冲盐水洗涤,并以800×g离心5 min收集。然后将细胞重悬于500 μl结合缓冲液中。将细胞悬浮液与5 μl膜联蛋白V-FITC混合,随后与5 μl PI混合。在室温下在黑暗中孵育15 min后,使用流式细胞仪和CellQuest Pro version 6.0软件(FACScan; BD Biosciences,Franklin Lakes,NJ,USA)测定细胞凋亡及G1期。
1.7 SRA01/04细胞MIR-126、VEGF mRNA水平测定 上述3组SRA01/04细胞培养结束后,无菌收集细胞。取5 ml细胞液(细胞浓度为5×106/ml),5 000 r/min离心 5 min后,-70℃冻存备用,实时荧光定量 PCRSHP-1 mRNA 表达水平,方法同1.2。
1.8 SRA01/04细胞液Caspase-3、Caspase-6、Caspase-9蛋白水平测定 培养结束后,5 000 r/min离心收集各组细胞,加入PBS制成细胞悬液后,酶联免疫吸附法测定培养液中Caspase-3、Caspase-6、Caspase-9蛋白水平。
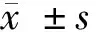
2 结果
2.1 对照组、病例组中MIR-126、VEGF mRNA水平的表达 病例组MIR-126、VEGF mRNA水平高于对照组 (P<0.05)。见表1。
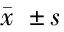

组别MIR-126 mRNAVEGF mRNA对照组(n=49)0.76±0.430.98±0.33病例组(n=198)3.25±0.65∗3.09±0.25∗
注:与对照组比较,*P<0.05
2.2 3组SRA01/04细胞OD值、存活率水平的表达 MIR-126 mimics组OD值、存活率水平低于SRA01/04细胞组(P<0.05),MIR-126 inhibitor组OD值、存活率水平高于SRA01/04细胞组、MIR-126 mimics组(P<0.05)。见表2。
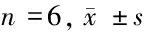
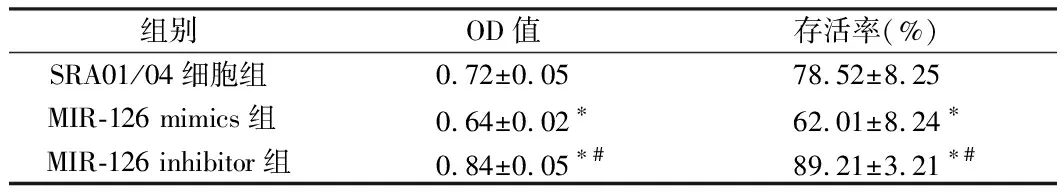
组别OD值存活率(%)SRA01/04细胞组 0.72±0.0578.52±8.25MIR-126 mimics组 0.64±0.02∗62.01±8.24∗MIR-126 inhibitor组0.84±0.05∗#89.21±3.21∗#
注:与SRA01/04细胞组比较,*P<0.05;与MIR-126 mimics组比较,#P<0.05
2.3 3组SRA01/04细胞凋亡率的表达 MIR-126 mimics组凋亡率水平高于SRA01/04细胞组(P<0.05),MIR-126 inhibitor组凋亡率水平低于SRA01/04细胞组、MIR-126 mimics组 (P<0.05)。见表3。
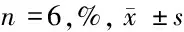

组别凋亡率SRA01/04细胞组 3.40±0.21MIR-126 mimics组5.10±0.38∗MIR-126 inhibitor组2.80±0.34∗#
注:与SRA01/04细胞组比较,*P<0.05;与MIR-126 mimics组比较,#P<0.05
2.4 3组SRA01/04细胞G1期比较 MIR-126 mimics组G1期水平低于SRA01/04细胞组(P<0.05),MIR-126 inhibitor组G1期水平高于SRA01/04细胞组、MIR-126mimics组(P<0.05)。见表4。
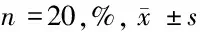

组别G1期SRA01/04细胞组 64.66±1.06MIR-126 mimics组59.02±0.84∗MIR-126 inhibitor组66.38±0.95∗#
注:与SRA01/04细胞组比较,*P<0.05;与MIR-126 mimics组比较,#P<0.05
2.5 3组SRA01/04细胞MIR-126、VEGF mRNA表达水平比较 MIR-126 mimics组MIR-126、VEGF mRNA水平高于SRA01/04细胞组(P<0.05),MIR-126 inhibitor组MIR-126 mRNA、VEGF mRNA水平低于SRA01/04细胞组、MIR-126 mimics组(P<0.05)。见表5。
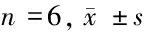

组别MIR-126 mRNAVEGF mRNASRA01/04细胞组 1.91±0.172.34±0.43MIR-126 mimics组 3.67±0.23∗5.99±0.39∗MIR-126 inhibitor组0.45±0.29∗#0.69±0.32∗#
注:与SRA01/04细胞组比较,*P<0.05;与MIR-126 mimics组比较,#P<0.05
2.6 3组SRA01/04细胞Caspase-3、Caspase-6、Caspase-9蛋白表达水平比较 MIR-126 mimics组Caspase-3、Caspase-6、Caspase-9蛋白表达水平高于SRA01/04细胞组(P<0.05),MIR-126 inhibitor组Caspase-3、Caspase-6、Caspase-9蛋白表达水平低于SRA01/04细胞组、MIR-126 mimics组(P<0.05)。见表6。
2.7 各变量的相关性分析 MIR-126 mRNA 与VEGF、Caspase-3、Caspase-6、Caspase-9正相关关系明显(P<0.05)。见表7。
3 讨论
白内障是全世界失明的最常见原因,与衰老过程显着相关。miRNA是单链RNA,长度为21~25个核苷酸。 近年来的研究发现,一些miRNA在角膜,晶状体和视网膜中特异性表达,这表明它们在调节眼睛生长,发育和功能方面具有重要作用。多项研究发现,在三种与年龄相关的白内障中, miR-15、miR-126的表达在白内障晶状体上皮细胞中升高[11-13]。miR-126在胃癌、骨肉瘤、前列腺癌中起着致癌miRNA的作用。在目前的实验中,我们观察到miR-126能够促进SRA01/04细胞凋亡。最近的研究证明,MIR-126的上调可能激活细胞凋亡和细胞周期停滞。研究发现,MIR-126在衰老的心脏中被激活,并且MIR-126的体内沉默或遗传缺失通过诱导DNA损伤反应和端粒损耗来减少与年龄相关的心肌细胞死亡[14]。此外,衰老的系膜细胞MIR-126显着上调,MIR-126的过度表达促进了年轻系膜细胞的过早衰老。目前,已知许多因素,如糖尿病,紫外线照射,全身性药物和其他眼部疾病,与白内障形成有关。在这些疾病中,随后形成氧化应激产物被认为是白内障的主要诱发因素。体外细胞试验发现,MIR-126通过线粒体功能障碍激活HLEC细胞凋亡,包括阻断电子传递,形成ROS和攻击线粒体膜,进一步释放细胞色素c进入细胞质并触发caspase-9活化[15,16]。此外MIR-126的过表达通过促进SOD2和Txnrd2以及伴随的ROS增加诱导年轻系膜细胞的过早凋亡。这些试验结果表明晶状体上皮细胞凋亡是人和哺乳动物中非先天性白内障发展的常见细胞基础。VEGF已成为许多生物过程和人类疾病的新型调节因子。研究发现VEGF在白内障患者的全血晶状体和血浆部分均有特异性上调,此外,VEGF与Akt和miR-150-5p形成反馈环以调节人晶状体上皮细胞功能[17,18]。在一项白内障晶状体上皮细胞的体外试验中,数据显示VEGF在白内障中起重要作用,在该研究中,RIP测定已证实miR-421可与VEGF保守结合位点结合,并且荧光素酶报告基因测定鉴定VEGF可负调节miR-421表达并且miR-421可靶向SRA01/04中半胱天冬酶3的3'UTR细胞。此外,VEGF敲低抑制SRA01/04细胞凋亡被miR-421抑制剂或pcDNA caspase-3逆转。因此,VEGF是年龄相关性白内障的重要调节因子,其潜在机制是TUGR下调miR-421表达,导致caspase-3表达增加并加速SAR01/04细胞凋亡。
本次研究结果显示,病例组MIR-126、VEGF mRNA水平高于对照组;MIR-126 mimics组OD值、存活率、G1期水平低于SRA01/04细胞组,凋亡率水平高于SRA01/04细胞组;MIR-126 inhibitor组OD值、存活率、G1期水平高于SRA01/04细胞组、MIR-126 mimics组,凋亡率水平低于SRA01/04细胞组、MIR-126 mimics组;MIR-126 mimics组MIR-126、VEGF mRNA水平高于SRA01/04细胞组(P<0.01),MIR-126 inhibitor组MIR-126 mRNA、VEGF mRNA水平低于SRA01/04细胞组、MIR-126 mimics组OD值、存活率水平 。这与上述讨论结果一致,同时也说明,MIR-126能诱导白内障晶状体上皮细胞高表达VEGF,进而促进其凋亡。
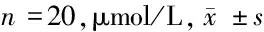

组别Caspase-3蛋白Caspase-6蛋白Caspase-9蛋白SRA01/04细胞组314.36±19.25354.21±16.32630.87±14.87MIR-126 mimics组669.25±5.25∗598.24±20.45∗979.52±19.58∗MIR-126 inhibitor组209.32±20.14∗#298.21±12.54∗#343.76±32.76∗#
注:与SRA01/04细胞组比较,*P<0.05;与MIR-126 mimics组比较,#P<0.05

表7 各变量的相关性分析
文献报道的大量数据表明caspase-3在氧化应激诱导的凋亡白内障晶状体上皮细胞中上调。研究表明,白内障患者晶状体上皮细胞中caspase-3和Bax的表达上调,bcl-2表达下调[19,20]。本研究表明,转染MIR-126 mimics的SAR01/04l细胞caspase-3、caspase-6、caspase-9表达明显增加,且MIR-126 mRNA 与VEGF、caspase-3、caspase-6、caspase-9正相关关系明显。这与上述讨论一致,也提示,MIR-126能诱导caspase-3、caspase-6、caspase-9高表达,进而促进白内障晶状体上皮细胞凋亡。
综上所述,miR-126、VEGF在白内障晶状体上皮细胞中高表达;MIR-126能诱导白内障晶状体上皮细胞高表达VEGF、caspase-3、caspase-6、caspase-9,进而促进其凋亡。

