H9N2亚型禽流感病毒A/Chicken/Shandong/LY1/2017株反向遗传操作系统的建立
李梦娇,徐 凯,杨 彬,刘 伟,仇旭升,孙英杰,谭 磊,廖 瑛,宋翠萍,刘炜玮,张小荣,丁 铲,孟春春,吴艳涛
(1.扬州大学兽医学院,扬州225009;2.中国农业科学院上海兽医研究所,上海200241)
禽流感病毒(Avian influenza virus,AIV)属于正粘病毒科流感病毒属A型流感病毒,其宿主广泛,A型流感病毒根据血凝素HA划分为16个亚型,根据神经氨酸酶NA可划分为9个亚型[1]。1992年,Chen等[2]分离出第1个H9N2亚型LPAIV毒株AID93-1(但被误认为是H9N3亚型流感病毒),随后,在1992年11月至1994年5月期间,广东省共有17个养鸡场和2个小家禽厂暴发了该疾病[3-4]。几年后,中国其他各地也间隔报道了该疾病,至1998年,H9N2亚型AIV在我国各地开始大规模暴发。该亚型流感病毒可通过水、饲料、灰尘和飞沫等媒介进行传播,在家禽中广泛流行,患病的禽类可出现产蛋量下降、精神沉郁、呼吸道感染等症状,给我国养殖业造成了严重的危害。此外,H9N2亚型流感病毒还可以感染哺乳动物和人类,1999年,在猪体内分离到该亚型的流感病毒;同年,从广东省的5名流感患者体内分离到了5株H9N2流感病毒,在香港的2名女性流感患者体内也分离到了2株H9N2亚型流感病毒[5]。由此可见,H9N2亚型AIV能突破种间屏障,可能会成为引发流感大流行的潜在毒株。
反向遗传指从生物基因组及其所含生物信息出发,采用从基因到性状的研究路线,对生物体进行遗传和变异规律的研究[6]。RNA病毒反向遗传学的核心是构建感染性cDNA分子克隆,通过体外转录,合成病毒RNA,用转录物侵染易感宿主或敏感细胞系,拯救出与母本毒株具有相似特性的活病毒[7]。早期的流感病毒拯救需要共转染12个质粒,后建立起转录、翻译载体后将质粒数减少至8个,由于这种拯救病毒来自于病毒基因组的cDNA分子,因此可在DNA水平上对病毒基因组进行操作,研究拯救病毒基因型的改变对病毒表型的影响,进而达到对病毒基因组结构与功能、致病机制以及分子免疫机理等进行研究。
本研究所操作的病毒A/Chicken/Shandong/LY1/2017(Gen Bank登录号:MH018674-MH018681)为低致病性的H9N2亚型流感病毒,其IVPI为0.02。本研究通过构建病毒的8个体外双向表达转录质粒,将其转染至293T和MDCK细胞拯救出了该病毒,病毒TCID50、EID50以及在MDCK细胞上的生长曲线和空斑试验证明拯救病毒生物学特性与野毒株完全一致。本研究成功建立了低致病性H9N2亚型禽流感病毒的反向遗传系统,为进一步通过基因缺失、定点突变技术研究影响病毒致病性的基因建立了技术平台,同时也为进一步研究该病毒的基因功能、致病机制和传播机理奠定了基础。
1 材料与方法
1.1 毒株和主要试验材料 毒株A/Chicken/Shandong/LY1/2017由上海兽医研究所水禽病毒实验室分离纯化,将保存的毒株经噬斑纯化3次后,鸡胚扩增一代,保存于-80℃冰箱备用。SPF鸡胚购自北京梅里亚动物保健有限公司。
1.2 主要试剂BsmbI、BsaI限制性内切酶购自Thermo Fisher公司;高保真酶和T4 DNA连接酶购自南京诺唯赞生物科技有限公司;AMV、5×AMV Buffer、dNTPs、RNA酶抑制剂(PRI)、infusion无缝克隆试剂盒购自宝生物工程(大连)有限公司;DNA凝胶回收试剂盒购自Promega公司;DH5α感受态细胞购自天根生化科技(北京)有限公司;绿如蓝核酸染料(UV型)购自北京天恩泽基因科技有限公司;无内毒素质粒小提中量试剂盒购自广州美基生物科技有限公司;转染试剂Fugen HD购自Life Technologies公司;反向遗传PHW2000载体由本实验室保存。
1.3 引物设计与合成 反转录(RT)为通用引物6 nt(5'-NNNNNN-3'),根据Hoffmann所报道的流感通用引物以及病毒序列设计流感病毒基因组的引物,引物由生工生物工程(上海)有限公司合成,具体信息见表1。
1.4 病毒RNA的抽提以及片段扩增 参照TRIzol法使用说明书进行病毒抽提,反应体系:AMV 1.5 μL,5×AMV Buffer 10 μL,dNTPs 2 μL,PRI 1 μL,将上述14.5 μL体系与33.5 μL RNA和2 μL 6nt引物充分混匀后,于42℃水浴2 h,75℃水浴5 min,将病毒反转录成cDNA后保存于-20℃备用。以此cDNA为模板对流感病毒的8个片段进行PCR扩增,PCR产物经电泳后使用琼脂糖凝胶回收试剂盒进行回收。
1.5 重组质粒的构建 将PCR纯化回收产物分别使用相应的限制性内切酶进行酶切,将PB1基因C1974T进行一个无义突变将其作为遗传标记,纯化后将其克隆至pHW2000载体中,其中PA基因由于含有BsmbⅠ、BsaⅠ酶切位点,因此采用infusion无缝克隆试剂盒将其直接克隆至载体中。重组质粒转化至DH5α感受态细胞后挑取单菌落送至生工生物工程(上海)有限公司测序,鉴定正确的菌株进行扩大培养并提取质粒。

表1 H9N2全基因组扩增的PCR引物表Table 1 Reference primers of H9N2
1.6 细胞转染与病毒拯救 按照Fugen HD转染试剂说明书进行操作,将400 ng的PB1、PB2、PA、HA质粒以及250 ng的NP、NA、M、NS质粒混合均匀后转染至293T和MDCK细胞中(293T和MDCK细胞比例为1∶1~3∶1),转染后6~8 h向培养基中加入终浓度为1 μg/mL的TPCK胰酶。37℃、5%CO2条件下培养96 h后将细胞板反复冻融3次后将细胞悬液接种至10日龄SPF鸡胚,96 h后收取鸡胚尿囊液并测定其HA效价,拯救出的病毒命名为rH9N2。
1.7 拯救病毒的鉴定 将拯救的毒株在SPF鸡胚上连续传递3代后收取病毒尿囊液,参照TRIzol法使用说明书进行病毒抽提,以cDNA为模板扩增PB1中含有遗传标记的片段,经测序对拯救的病毒进行鉴定。
1.8 rH9N2毒株与亲本毒株MDT、EID50、TCID50的测定 按照参考文献[8],测定拯救毒株与亲本毒株的鸡胚半数感染量EID50(egg infectious dose)、鸡胚最小致死量平均死亡时间MDT(mean death time of chicken embryos),同时进行半数细胞培养物感染量TCID50(tissue culture infective dose)的测定。
1.9 rH9N2毒株与亲本毒株在MDCK细胞上生长曲线及其空斑比较 将MDCK细胞以1×106/孔的量接种于6孔细胞培养板中,待细胞形成单层后用PBS清洗3次后将病毒以1 MOI的剂量接种于6孔板中,放入培养箱中吸附1.5 h后,用PBS清洗3次后加入维持液(含1 μg/mL的TPCK胰酶),分别在6、12、24、36、48、72 h收取细胞上清液存于-80℃冰箱保存,所有样品收集完毕后测定其TCID50后绘制病毒的生长曲线。
将MDCK细胞以1×106/孔的量接种于6孔细胞培养板中,待细胞形成单层后用PBS清洗3次后将病毒以1 MOI、0.1 MOI的剂量接种于6孔板中,放入培养箱中吸附1.5 h后,用PBS清洗3次,将1.6%的琼脂与2×DMEM(含2%的TPCK)按1∶1比例混匀后滴入6孔板中,培养箱中倒置培养24 h,加入4%多聚甲醛固定,将琼脂挑出并用1%结晶紫染色后观察结果。
2 结果
2.1 感染性克隆构建示意图 分别扩增出LY1毒株的PB1、PB2、PA、HA、NP、NA、M、NS 8个基因片段,采用同源重组的方法或者分子克隆经BsmbⅠ/BsaⅠ酶切后,分别将其克隆至pHW2000载体中,具体构建过程见图1。
2.2 病毒基因组各片段扩增图 用琼脂糖凝胶电泳验证PCR产物,结果所设计的8对引物均能扩增出清晰的目的条带,且条带大小与预期结果相符,具体结果见图2。

图1 感染性克隆构建示意图Fig.1 The schematic represented infectious clone construction

图2 A/Chicken/Shandong/LY1/2017毒株全基因RT-PCR结果Fig.2 A/Chicken/Shandong/LY1/2017 strain wholegenome RT-PCR result
2.3 病毒拯救转染体系的确定 将构建的8个质粒按不同比例共转染293T/MDCK混合细胞,最终确定成功的病毒拯救转染体系:PB2、PB1、PA、HA为400 ng,NP、NA、M、NS为250 ng,该转染体系的成功率为60%,具体结果见表2。拯救的病毒命名为rH9N2。
2.4 拯救病毒rH9N2的鉴定 将转染后96 h的细胞板于-80℃反复冻融3次后,收取细胞悬液接种于10日龄SPF鸡胚中(每胚0.2 mL),每次接种3枚,经HA试验鉴定有血凝价者,收取其尿囊液,RT-PCR扩增PB1基因片段,测序结果见图3,表明拯救病毒rH9N2的PB1中含有遗传标记的片段。

表2 病毒拯救转染体系Table2 Transfection system of rescued virus
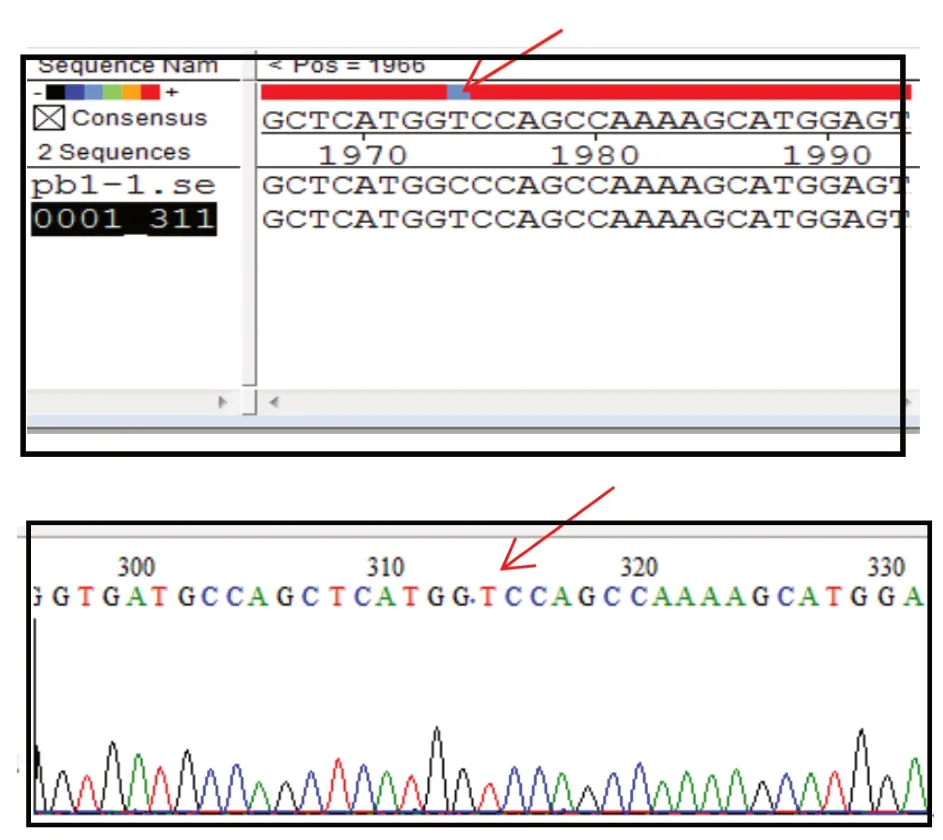
图3 遗传标记处序列比对结果Fig.3 The alignment results of the constructed biological genetic markers
2.5 拯救病毒rH9N2毒株生物学特性分析 rH9N2毒株在HA、MDT、EID50、TCID50方面与亲本毒株保持高度一致,均差异不显著,具体结果见表3。rH9N2毒株与亲本毒株在MDCK细胞上均可以高效复制,其空斑大小及其生长曲线无显著性差异,具体结果见图4。

表3 病毒生物学特性Table3 The biological characteristics of virus

图4 病毒空斑及生长曲线图Fig.4 Plaque and growth curve of the viruses
3 讨论
禽流感最初于1978年在意大利被报道,1880年将该病命名为“禽瘟”,1995年将其正式命名为甲型流感病毒[9-10]。除高致病性流感病毒外,自1990年代中期以来,在各个国家中先后检测到低致病性的流感病毒,其中传播和破坏最广泛的是H9N2亚型流感病毒,该病毒在1990年流行后,随即迅速传至亚洲、中东和北非等国家[11]。一方面,该病毒可以通过直接感染、共同感染以及免疫抑制感染禽类,给养殖业造成损失。另一方面,其不仅可以感染哺乳动物,还可以为新兴的高致病性流感病毒H5N1、H7N9等提供部分至全部的内部基因,从而对公共健康构成重大威胁[12-13]。公认的禽流感病毒的变异机制主要包括抗原漂移和抗原转变,前者的特征是主要免疫保护蛋白中关键氨基酸的点突变,后者则是由于发生了基因重排[14]。与遗传漂移相比,基因重组产生了具有竞争优势的全新病毒,从而广泛流传[15]。在浙江省温州市新发现的鸡H7N7病毒,以及2013年报道的感染人的H7N9、H10N8、H5N6等病毒均基于H9N2亚型流感病毒完整的内部基因[12,17-19]。因此,建立起H9N2亚型流感病毒的反向遗传操作系统对于进一步研究其致病机制,更好的防控该疾病具有十分重要的意义。
本研究中采用的毒株A/Chicken/Shandong/LY1/2017为低致病性的H9N2亚型流感病毒,该毒株的HA基因属于Y280-like分支,该谱系的病毒在我国水禽养殖业中广泛传播,是我国水禽养殖业中H9N2亚型流感病毒的优势流行株[19-20]。虽然目前国内流行的H9N2亚型AIV的HA、NA以CK/Bei-like分支基因型为主,但其内部基因经常被其它分支的基因片段所取代,出现越来越多的重组基因型[21]。因此进一步对该亚型病毒进行研究,尤其是建立起病毒的反向遗传操作系统有助于研究其致病机制和遗传变异规律,从而对其进行有效防控,减少其对于我国养殖业造成的经济损失。
至今,关于流感病毒的反向遗传操作系统已逐渐趋于成熟,但H9N2亚型流感病毒因其感染力相对较弱,因而对于其感染性克隆的构建少有报道。本研究建立起了A/Chicken/Shandong/LY1/2017毒株的反向遗传系统,并成功拯救出了该病毒。通过HA试验、病毒基因组测序、MDT、EID50、TCID50以及病毒空斑和生长曲线试验表明,rH9N2生物学特性与亲本病毒一致。本试验建立起的操作系统为以后的研究开拓了道路,利用该操作平台可深入研究H9亚型流感病毒的复制调控机制、变异规律、致病性以及种间传播的分子机制,为预测流感病毒大流行提供依据,也为新型流感基因工程苗的研发提供了技术储备。

