弓形虫抗原主要功能和免疫特性
王艳华
弓形虫是一种专性细胞寄生原虫,具有广泛的宿主群并在世界范围内流行,引起人兽共患寄生虫病[1]。弓形虫作为一种机会感染因子,可致免疫功能低下者严重感染甚至死亡。弓形虫病也是影响人类优生优育的一个重要病原体。孕妇感染弓形虫后无论有无临床症状,都可发生母胎垂直感染,导致流产、死胎及现先天性缺陷等。家畜感染弓形虫可造成严重经济损失,并成为潜在的人体感染来源。
弓形虫主要借助于虫体分泌蛋白,驱动虫体入侵宿主细胞。分泌这些蛋白的细胞器主要包括微线体(MICs)、棒状体(ROPs)和致密颗粒(GRAs)等。MICs在弓形虫识别、附着和入侵宿主细胞过程中起重要作用[2],在虫体与宿主细胞接触早期,MICs最先从速殖子顶端分泌,通过识别宿主细胞膜上的受体进行粘附;随之ROPs分泌到宿主细胞膜的棒状体颈部蛋白(RONs)与MICs的顶膜抗原1(AMA1)形成移动连接。排放到胞质中的ROPs与宿主细胞相互作用,形成纳虫空泡(PV)。最后,GRAs修饰纳虫空泡,以便于虫体获取在细胞内存活和复制所需的营养。弓形虫入侵宿主细胞是由多种蛋白介导完成的。
目前,许多抗原被确定为候选疫苗,但是其免疫力和保护期有限。因此,选择合适的抗原是设计安全有效疫苗的关键[3]。疫苗保护效果除了抗原本身外,佐剂以及递送系统等都影响疫苗诱导的免疫应答。弓形虫感染期间恰当的抗原诱导的持久免疫保护起着至关重要的作用[4]。越来越多的证据表明,某些虫体效应分子具有致病性,这些分子成为诱导体液和细胞免疫应答的重要分子。此外,阶段特异性抗原可诱导强烈的免疫反应,对弓形虫感染产生阶段性保护。因此,本文就弓形虫各阶段表达的高致病性和强免疫原性的抗原进行综述。
1 弓形虫表面抗原
弓形虫表面最先接触宿主细胞,主要参与吸附、信号传导、入侵、物质转运及宿主免疫应答,被作为主要的抗原进行研究。弓形虫表面抗原具有诊断和疫苗的双重潜在价值。弓形虫表面多以糖磷脂酰化形式锚定在细胞膜上,抗原有40种左右,具有其特异性。除SAG4外,目前已知的多种弓形虫表面抗原均属于SRS(SAG1-related sequence)蛋白超家族。SRS家族分为SAG1样和SAG2样序列家族2个主要类群。该家族由161个SRS编码,组成20种以上结构相关但抗原性不同的虫体表面蛋白[5]。其中SRS8、SRS38A、SRS42和SRS52A蛋白在各期中的表达情况及其功能还有待于进一步研究。
表面蛋白在裂殖子中的表达显著高于速殖子中。SAG1是速殖子期特异性蛋白,在弓形虫不同虫株中高度保守,并表现出高致病性并诱导体液和细胞免疫应答。SAG1影响速殖子与宿主受体的结合和虫体对宿主细胞的入侵[6]。SAG1与虫株的毒力有关,强毒株入侵宿主细胞过程中高表达SAG1。SAG1可能是决定虫株毒力的重要因素之一。SAG1能够刺激机体产生IgG、IgM及多种细胞因子,并具有很好的抗原性和免疫原性[7],是弓形虫疫苗的重要候选抗原。
SAG2能被感染者血清识别,急性感染者血清与SAG2的结合强于慢性感染者的血清。抗SAG2的抗体能阻止弓形虫黏附宿主细胞表面入侵宿主细胞。SAG2家族的SAG2B、SAG2C和SAG2D均有很高的同源性。SAG2B仅在速殖子阶段表达,而SAG2C和SAG2D仅在缓殖子阶段表达。SAG2A可用作弓形虫感染急性期检测的指标,SAG 2C,SAG D,SAG X和SAG Y对于维持虫体在脑内持续感染起到重要作用[5,8]。它们被认为是包囊形成的标志。
SAG3可能通过结合唾液酸化的糖复合物介导弓形虫的入侵,利于虫体增殖,参与虫体入侵和增殖。SAG3在速殖子和缓殖子中均表达,具有致病性和较强的免疫原性。SAG4可引起机体早期细胞及体液免疫应答,抗原性很强。SAG5比SAG1具有更强的免疫原性。SAG 5A不在RH株速殖子中表达,SAG 5B和SAG 5C在速殖子和缓殖子均有表达。SAG 5D表达仅见于速殖子,且具有高致病性和免疫原性。SAG 5E是反转录假基因。各种表面抗原特性见表1。
表1 表面抗原在弓形虫各期中的表达
Tab.1 Expression ofToxoplasmaSRSs in various stages of life cycle

表面抗原速殖子缓殖子子孢子裂殖子致病性免疫原性参考文献SAG 1+---①①[7,9]SRS 1+-----[9]SRS 2+-----[10]SRS 3+-----[9]SRS 9-+----[5]SRS 16-+----[9]SRS 16B+-----[11]SRS 20A+-----[10]SRS 22A---+--[11]SRS 22B---+--[11]SRS 27B---+--[11]SRS 28--+---[12]SRS 29A+-----[11]SRS 35A+-----[11]SRS 35B+-----[11]SRS 36C+-----[11]SRS 36D+-----[11]SRS 36E+-----[11]SRS 42------[10]SRS 44+-----[11]SRS 67+-----[11]BSR 4-+-+--[11]SAG 2A+-----[8]SAG 2B+-----[8]SAG 2C-+----[5,8]SAG 2D-+----[5,8,13]SAG 2X-+----[5,8]SAG 2Y-+----[5,8]SAG 3++--①①[14]SAG 4A-+----[10]SAG 4B-+----[10]SAG 5A++---①[15]SAG 5B++----[15,16]SAG 5C++----[15,16]SAG 5D+---①①[17]SAG 5E+-----[17]
①代表有致病性或免疫原性。
2 微线体蛋白
微线体蛋白(MICs)在虫体顶端与宿主细胞膜接触早期分泌。目前,已知至少20余种MICs,包括MIC1-MIC12、AMA1、M2AP、PLP1、ROM1、SPATR、SUB1和TLN4[18]。其中8种(TgMIC1-4和TgMIC6-9)含有类似真核细胞黏附分子的不同黏附结构域。弓形虫入侵的宿主细胞类型广泛。由于虫体利用自身的肌动蛋白-肌球蛋白系统进入宿主细胞。MICs不仅对宿主细胞的入侵至关重要,而且对于滑动运动也是至关重要的。上述黏附相关结构域在弓形虫入侵宿主过程中结合宿主细胞表面受体和糖类,黏附宿主细胞驱动虫体滑行运动。此外,微线体蛋白的黏附相关结构域还促进微线体蛋白复合物的形成,稳定地存在于虫体表面,增加其黏附作用。MICs复合物在毒力和致病性方面发挥了重要的作用。越来越多的关于MICs的研究表明,MICs是诱导免疫应答的有效候选疫苗。
弓形虫MIC3,MIC4和MIC13在速殖子,缓殖子和子孢子阶段均表达。MIC1、MIC2、MIC2AP、MIC5、MIC7、MIC10和MIC11七种MIC在速殖子和缓殖子中表达。MIC10在速殖子中的表达水平高于缓殖子中的表达水平[19]。其它MICs抗原仅在一个阶段中表达。另外,致病性和免疫原性研究表明MIC1、MIC3、MIC4和MIC6具有高致病性,而MIC3、MIC4、MIC5、MIC6、MIC8和MIC13表现出强免疫原性。其中MIC3研究比较广泛,MIC3被认为是最重要的疫苗候选抗原之一。此外,MICs抗原还是良好的诊断标记。MICs抗原不仅用于普通的血清学检测,最近研究发现,MICs抗原(MIC1、MIC3、MIC4和MIC6)还可用于基于检测IFN分泌的细胞免疫反应诊断方法,来监测感染期间免疫状态[20]。MICs特征见表2。
3 棒状体蛋白
棒状体蛋白(ROPs)有助于虫体主动入侵宿主细胞,并参与纳虫泡的形成。纳虫泡是一种特殊的细胞内小泡,虫体在其内部繁殖,可避免宿主清除。ROPs对3个阶段的虫体入侵及在宿主细胞内的存活起重要作用。一般情况下,ROPs约占弓形虫总量1%~30%,与虫株的毒力和致病性密切相关[39],ROPs是弓形虫疫苗的候选分子。ROP1、ROP2、ROP21和ROP42在弓形虫感染各阶段都表达。ROP2具有高致病性和免疫原性。虽然ROP21不是速殖子入侵所必需,但它在由包囊引起的慢性感染过程中起着重要作用[40]。此外,ROP42在缓殖子中高度表达[11]。ROP5、ROP16和ROP17在弓形虫速殖子和缓殖子2个感染阶段表达,并显示出高致病性和免疫原性。尽管ROP18仅在速殖子阶段表达,但它具有高致病性并能诱导体液和细胞免疫应答。表3详细地列出了ROP研究结果。
表2 微线体抗原特性
Tab.2 Characteristic of MICs

微线体蛋白速殖子缓殖子子孢子裂殖体致病性免疫原性参考文献MIC 1++--①①[21]MIC 2++--①①[22]MIC 2AP++---①[22]MIC 3++++①①[23] MIC 4++++①①[24]MIC 5++--①①[25]MIC 6+---①①[26]MIC 7-+----[27]MIC8+---①①[28]MIC 9-+----[27]MIC 10++----[3]MIC 11++--①①[29,30]MIC 12---+--[11]MIC 13+++-①①[10]MIC 16+-----[11,31]MIC 17A---+--[11]MIC 17B---+--[11]MIC 17C---+--[11]AMA 1+-----[3]PLP1 +---①①[32,33]TLN4+-----[34]ROM1 +-+-①①[35,36]SUB1+---①-[37]SPATR--+-①-[38]
①代表有致病性或免疫原性。
4 棒状体颈蛋白(RONs)
RONs的分泌受微线体调控。目前,已知的RONs包括RON1-5、RON8-9、RON2-L1、RON2-L2和RON4-L1,部分RONs(RON2、RON4、RON5、RON8)与微线体蛋白AMA1结合,形成“运动连接” (MJ)以便虫体入侵宿主细胞。MJ也是一分子筛,限制宿主质膜蛋白进入新生纳虫泡,使纳虫泡免于融合并保护虫体免受溶酶体破坏。RONs复合体2/4/5/8在入侵过程中定位于MJ,为宿主的免疫应答提供了一个稳定的靶点。在侵入开始时,预先形成MJ的RONs复合物被注入宿主细胞,RON2跨越宿主质膜,充当膜锚,而RON 4/5/8定位于其胞质表面。RON8不受ron5基因敲除的影响,但RON5缺失可导致弓形虫分泌的RON2的完全降解和RON4的失活,虫体无法入侵新的宿主细胞。另外,RON5缺失时,ROPs不能形成胞外空泡,完整的MJ复合物是ROPs分泌的先决条件[65]。RON5充当护航蛋白,确保MJ核心复合物完整和运输,RON5在MJ RON复合物的组织结构中起关键作用。虽然RON2和RON5对于MJ是必不可少的成分,RON8和RON4是MJ非必要成分,但RON8缺失会导致入侵力减少70%,纳虫泡膜(PVM)不能完整闭合[65]。
表3 棒状体抗原特性
Tab.3 Characteristic of Rops

棒状体蛋白速殖子缓殖子子孢子裂殖体致病性免疫原性参考文献ROP 1+++--①[41]ROP 2+++-①①[42]ROP 3+---①-[43]ROP 4++--①-[43,44]ROP 5++--①①[45,46]ROP 6+---①-[47]ROP 7++--①-[48]ROP 8+----①[49]ROP 9+-+--①[50,51]ROP 13+----①[52]ROP 16++--①①[53,54]ROP 17++--①①[55]ROP 18+---①①[56]ROP 19++---①[57,58]ROP 20+-----[59]ROP 21++++--[40]ROP 23+-----[11]ROP 26+-----[60]ROP 27 -++---[40]ROP 28+-+---[40,60]ROP 29 +++---[60]ROP 30+-----[40]ROP 32---+--[61]ROP 33---+--[61]ROP 35 ++----[61]ROP 36---+--[61]ROP 38+---①①[62]ROP 39+-----[11]ROP 40+-----[11]ROP 41+-----[11]ROP 42++++--[11]ROP 43---+--[11]ROP 44+-----[11]ROP 46+--+--[11]ROP 48++---①[63]ROP 54----①①[64]
①代表有致病性或免疫原性。
最近研究显示,RON4-L1是弓形虫MJ复合体的另一新成员。RON4-L1与RON4具有一定的序列相似性,以宿主细胞膜的胞质面为靶点。RON4-L1敲除株弓形虫对小鼠的致死作用降低。与RON8相似,RON4-L1是一种球虫特异性蛋白,在无RON2、RON4和RON5的情况,不影响RON4-L1运输到MJ[66]。由于弓形虫、新孢子虫等球虫具有非常广泛的宿主,这些丰富的MJ蛋白可能有利于虫体入侵多种类型细胞。RON2-L1、RON2-L2在子孢子或缓殖子中高表达,RON4-L1在速殖子中大量表达,也在裂殖体表达。RON5在弓形虫所有3个阶段都表达,具有部分致病性和强免疫原性。RON4在裂殖子中表达[61]。RON4 DNA疫苗以及RON4重组蛋白疫苗抗弓形虫慢性感染(包囊灌胃)的免疫保护效果较弱[67]。RON9和RON10在虫体内通过二硫键形成复合物。敲除ron9基因,会使RON10在棒状体内错误定位;敲除ron10基因,会影响RON9分泌,但棒状体形态、入侵能力、复制(体外)以及毒力都不会受影响[68]。
5 致密颗粒蛋白 (GRAs)
GRAs分子量一般为20-50 kDa,在入侵过程中不起重要作用,但与虫体在宿主细胞内存活和复制有关。GRAs分别从虫体顶端、侧面及末端分泌进入纳虫泡,最终与PVM或膜内微管网络关联,完成对纳虫泡的修饰,抵抗宿主细胞溶酶体的酸化和裂解,隔离宿主的内吞噬作用,确保虫体在细胞内的存活与增殖。目前已鉴定出20余种GRAs,其中若干个GRAs为分泌排泄抗原,它们诱导抗体依赖和细胞调节免疫反应[69]。除了NTPase的2个同工酶,这些蛋白质序列同源性很低,但它们都含信号序列。虫体通过更新膜分泌及可溶蛋白分泌的形式修饰调理纳虫泡结构[69-70]。
GRA1、GRA5、GRA6、GRA8和GRA14在弓形虫3个感染阶段都表达。GRA1由速殖子,子孢子和缓殖子表达[12]。卵囊中GRA8的表达水平与速殖子相当,但是高于缓殖子[10]。此外,卵囊中GRA14的表达高于速殖子和缓殖子。GRA23在慢性感染期间的抗原性强于急性感染[3]。针对GRA1和GRA5的抗体是慢性感染的标志物,而GRA6,GRA7和GRA8被报道为急性感染的标志物。GRA4,GRA10,GRA12和GRA15在速殖子和缓殖子中均有表达,具有较高的致病性和较强的免疫原性。重组GRA2 、GRA5、GRA14、GRA17和GRA23具有较好的免疫原性[71-72]。表4详细地列出了GRA研究结果。
表4 致密颗粒抗原GRAs特性
Tab.4 Characteristic of GRAs
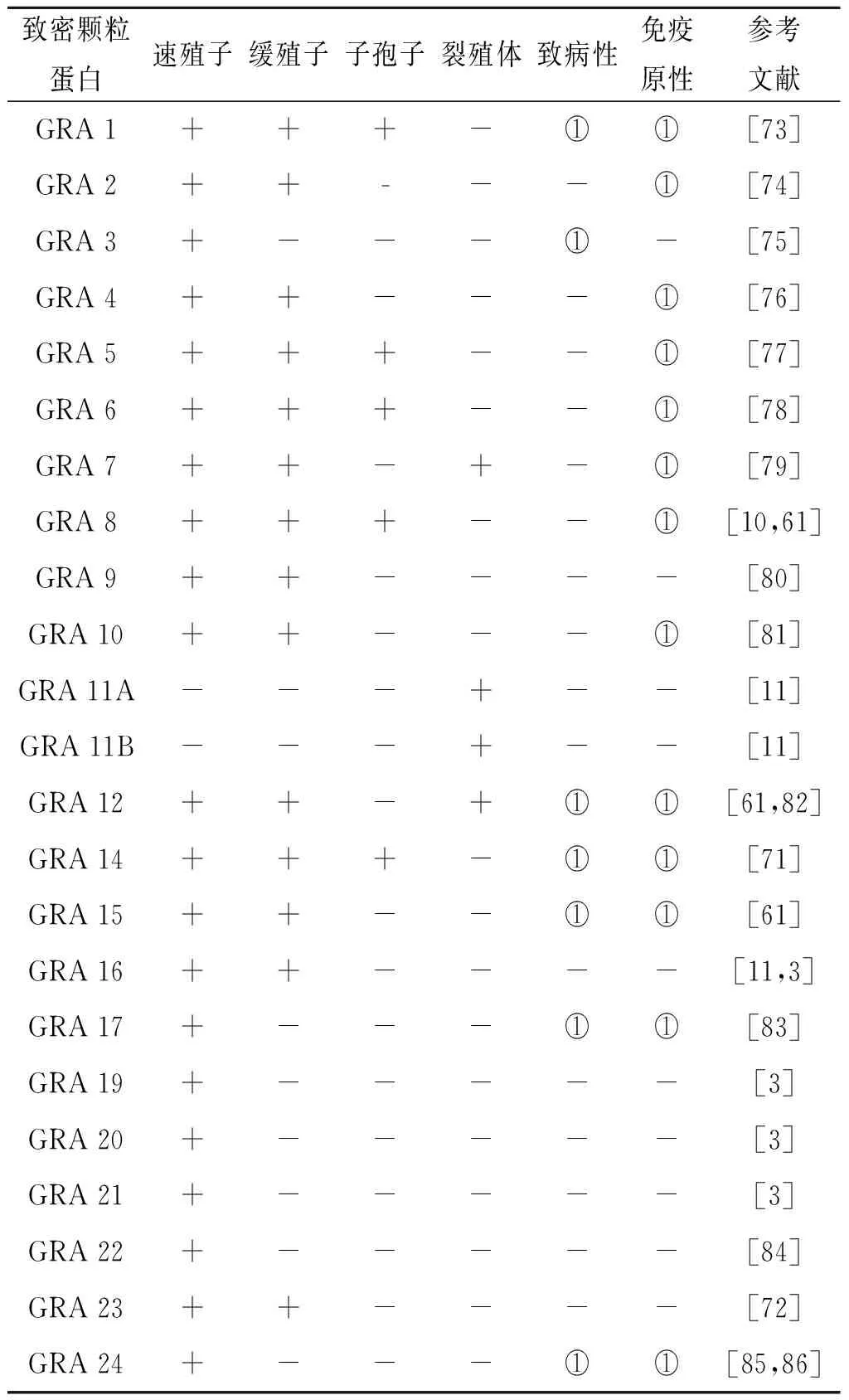
致密颗粒蛋白速殖子缓殖子子孢子裂殖体致病性免疫原性参考文献GRA 1+++-①①[73]GRA 2++---①[74]GRA 3+---①-[75]GRA 4++---①[76]GRA 5+++--①[77]GRA 6+++--①[78]GRA 7++-+-①[79]GRA 8+++--①[10,61]GRA 9++----[80]GRA 10++---①[81]GRA 11A---+--[11]GRA 11B---+--[11]GRA 12++-+①①[61,82]GRA 14+++-①①[71]GRA 15++--①①[61]GRA 16++----[11,3]GRA 17+---①①[83]GRA 19+-----[3]GRA 20+-----[3]GRA 21 +-----[3]GRA 22+-----[84]GRA 23 ++----[72]GRA 24+---①①[85,86]
①代表有致病性或免疫原性。
6 菱形体蛋白(ROMs)
弓形虫含有6个ROMs。菱形体蛋白可识别MICs的跨膜区,并对其进行蛋白水解,使MICs的N端片段释放到介质中并激活MICs。ROM1,ROM4和ROM5显示出高致病性并诱导强烈的体液和细胞免疫应答。ROM4参与MIC2、AMA1和MIC3表面粘附素的加工。抑制ROM4会导致MIC2分泌减少,同时虫体表面MIC2和其它粘连蛋白表达增加。抑制ROM4会破坏虫体正常滑行,导致虫体后端发生旋转。缺乏ROM4的虫体能很好地与宿主细胞粘附,但丧失了顶端定向能力,大多数虫体不能产生移动连接,因此入侵能力严重削弱。ROM4参与细胞表面蛋白的脱落。ROM4下调会破坏弓形虫高效的细胞运动和破坏对侵袭宿主细胞起重要作用的顶后部黏附素[87]。ROM1、ROM4、ROM5在速殖子阶段表达,而ROM2、ROM3在卵囊阶段表达。虽然ROM5和ROM4在速殖子阶段都定位于细胞表面,但ROM5主要位于虫体的后部,只有ROM5能够裂解MIC粘附素,表明它可能提供了侵袭所必需的关键蛋白酶活性[88]。
7 钙依赖蛋白激酶(CDPKs)
目前,因为CDPKs在钙信号级联反应中起重要作用,CDPKs家族成为关注的焦点。CDPK在植物、纤毛虫和顶复门虫体中普遍存在。弓形虫含有14个CDPKs,这些酶在弓形虫生活史包括入侵细胞、退行、滑动和复制过程中起重要作用[89]。弓形虫CDPKs家族有14个成员,其中CDPK1、CDPK2、CDPK3、CDPK5和CDPK6具有良好的免疫原性,被认为是有希望的候选疫苗。CDPK2对支链淀粉代谢起着关键作用,CDPK2的缺失可导致支链淀粉聚合物的过度积累,并导致虫体出现明显的形态学缺陷而无法形成包囊。由于哺乳动物不存在CDPKs,CDPKs家族被认为是一种潜在的抗弓形虫药物的靶标和疫苗候选抗原。最近报道,CDPK2与弓形虫缓殖子的形成相关,缺失CDPK2基因的弓形虫在缓殖子阶段超微结构发生改变[89],导致活力丧失,表明CDPK2可以作为一种有潜力的候选疫苗[90]。
8 弓形虫其它抗原
卵囊壁蛋白在弓形虫的子孢子感染阶段表达。CCP5A是一种子孢子特异性孢壁蛋白,其作为识别动物和人类感染的新标记可用于诊断和流行病学研究[91]。基质抗原1(MAG1)是急性感染的特殊标志物,可用于弓形虫感染早期检测。弓形虫烯醇化酶2(enolase, ENO2)在速殖子和裂殖子中表达,在虫体代谢中起重要作用,具有高致病性和免疫原性。ENO2可能与弓形虫毒力相关,参与多种细胞正常活动。弓形虫ENO2序列具有高度保守性,与其他寄生虫一致性达58.9%~98.9%,序列中金属、底物结合基序及烯醇酶标签(LLLKVNQIGSVTES)完全一致。ENO2在37 ℃时活性达到最大,具有热稳定性(25 ℃~45 ℃),这一特性有利于在不同温度下促进与感染相关的过程[92]。
9 热休克蛋白(HSPs)
热休克蛋白(HSPs)为分子伴侣,与抗原肽形成复合物通过受体与抗原递呈细胞(APC)相互作用,刺激APC分泌炎症细胞因子,并介导树突状细胞(DCs)的成熟。这些特性使得HSPs成为有待开发预防癌症和传染病的新一代预防疫苗。HSP70是所有生物体中最保守的蛋白质,它是多种病原体引起感染的主要免疫原。HSP70能被DCs和自然杀伤细胞(NKs)识别,引发固有免疫和适应性免疫应答。HSP70是弓形虫速殖子特异性毒力分子,在宿主死亡前迅速增加。它通过抑制小鼠腹腔巨噬细胞产生一氧化氮(NO),下调宿主的免疫防御[93]。HSP70具有致病性和免疫原性特征[94]。HSP70基因疫苗不仅适用于包括猫、猪和羊在内的家畜,而且在未来的研究中也将适用于人类。HSP30是一种小分子热休克蛋白,缓殖子阶段特异表达,刺激速殖子转化为缓殖子[92],HSP30基因疫苗可以干扰缓殖子形成[95]。
10 展 望
弓形虫生活史复杂,抗原成分具有发育阶段的特异性,致使阶段特异性抗原的疫苗接种只能激发阶段性保护。因此,具有高致病性和免疫原性的3个阶段均表达的抗原可能是疫苗免疫研究的最佳候选者,如MIC3、MIC4、MIC13、ROP2、RON5、GRA1、GRA6、GRA8和GRA14。一些在速殖子和缓殖子2个感染阶段均表达的抗原,例如MIC1、MIC5、ROP5、ROP8、ROP16、ROP17、ROP19、ROP38、ROP48、RON4、ROM4、GRA2、GRA4、GRA10、GRA12、GRA15、GRA16、SAG3、SAG5A,或在某一个阶段表达具有强力致病性和强免疫原性的抗原,例如ENO2、SAG1、SAG5D、HSP70、ROM1、ROM5、AMA1、ROP18、ROP13、RON2和GRA24,可用于制备鸡尾酒疫苗以获得更好的免疫结果。
此外,由于佐剂、疫苗给药途径、抗原剂量和抗原制备方法等许多因素影响疫苗的免疫效果,为了找到合适的候选抗原,必须对上述诸多因素做出准确地选择。其中选择合适的佐剂对于增强疫苗抗原组分十分重要。因此,在动物模型中使用标准化方案比较不同佐剂与候选抗原所引发免疫反应的效果显得非常重要。此外,采用弱毒株以及我国优势基因型虫株攻击感染测试疫苗的效果,更具有实际应用价值。
目前虽然鉴定到了很多弓形虫疫苗候选抗原,但仍有许多抗原需要鉴定和评估。例如卵囊壁蛋白免疫效果的研究还未见报道。其次,弓形虫抗原用于抗猫弓形虫感染免疫效果的研究较少。未来的研究也应侧重于设计有效和安全的鸡尾酒疫苗以抵抗弓形虫感染。弓形虫许多抗原对于该寄生虫的致病性和免疫原性都很重要。因此,未来的研究不仅应侧重于抗原数量的选择,也需对重组疫苗、DNA疫苗作用和最佳佐剂的选择进一步研究。此外,可以借助计算机模拟和生物信息学来确定针对弓形虫病的新候选疫苗。
利益冲突:无

