黄嘌呤氧化酶多酚抑制剂的筛选及其作用机制
李昕卓,郑丽丽,艾斌凌,郑晓燕,杨旸,杨劲松,盛占武,*
(1.海南大学食品科学与工程学院,海南海口570228;2.中国热带农业科学院海口实验站,海南海口570102;3.海口市香蕉生物学重点实验室,海南海口570102)
黄嘌呤氧化酶(xanthine oxidase,XOD)广泛存在于牛奶、人和动物细胞中,是催化人体内次黄嘌呤和黄嘌呤代谢产生尿酸的关键酶[1]。尿酸是人体中嘌呤化合物的最终代谢产物,体内XOD 含量和活性过高会大量产生尿酸,进而引发高尿酸血症、痛风和运动功能受损[2],长期高尿酸血症还可诱发高血压、糖尿病、冠心病、肾衰竭等疾病[3],如何有效减低体内尿酸的形成是目前国内外研究的热点。XOD 含有1330 个氨基酸,2 个黄素腺嘌呤二核苷酸(flavine-adenine dinucleotide,FAD),2 个钼原子和 8 个铁原子,是嘌呤类化合物催化转化的关键酶[4]。黄嘌呤氧化酶抑制剂可通过抑制体内XOD 的活性而减少尿酸生成,是高尿酸血症和痛风有效的防治药物[5]。别嘌呤醇作为一种XOD抑制剂,是目前临床治疗高尿酸血症及动脉粥样硬化、肾功能异常、糖尿病、高血压等常见并发症最为有效的药物之一,可直接结合XOD 的活性位点,与黄嘌呤竞争性抑制XOD 的活性,然而别嘌呤醇已被证实可诱发多种不良反应,主要包括超敏反应、发热、皮疹、嗜酸性粒细胞增多症、肝炎和肾功能恶化等[6]。因此,寻找天然、安全性高、毒副作用小的XOD 抑制剂显得尤为重要。
天然多酚类化合物大多都可以通过抑制黄嘌呤氧化酶和阻止肾脏对尿酸的再吸收来减少尿酸的合成,进而达到缓解痛风症状的目的[7]。如Zhang 等[8]发现槲皮素以混合型方式可抑制由黄嘌呤氧化酶催化的尿酸和超氧自由基(O2-)的产生。Dong 等[9]证实五种食品中常见多酚短叶松素、高良姜素、乔松素、乔松素呋喃葡萄糖苷和光草甘宁对黄嘌呤氧化酶都有显著的抑制活性。本研究旨在明确槲皮素、白藜芦醇、EGCG、橙皮苷、鼠尾草酸、山萘酚、高良姜素等天然来源的多酚单体对黄嘌呤氧化酶的抑制效果,对筛选出的高活性单体(白藜芦醇、EGCG 和橙皮苷)进行荧光猝灭和分子对接模拟实验,明确这些多酚单体抑制XOD 活性的作用方式、结合位点及其对XOD 结构的影响并揭示其作用机制,以期为黄嘌呤氧化酶抑制剂的开发利用提供理论参考。
1 材料与方法
1.1 材料与试剂
黄嘌呤氧化酶(0.5 U/mg):美国 Sigma 公司;白藜芦醇(纯度≥99%):Acros 公司;表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)(纯度≥98%)、山奈酚(纯度≥98%)、黄嘌呤(纯度≥99%):北京索莱宝科技有限公司;橙皮苷(纯度≥95%)、鼠尾草酸(纯度≥98%)、高良姜素(纯度≥98%):上海源叶生物科技有限公司;二甲基亚砜:江苏强盛功能化学股份有限公司。
1.2 仪器与设备
ML204/02 电子天平:梅特勒-托利多仪器(上海)有限公司;ALXD 超低TOC 生物型超纯水系统:重庆阿修罗科技发展有限公司;JP-080B 超声波清洗机:深圳市洁盟清洗设备有限公司;Multiskan GO 全波长酶标仪:美国 Thermo Fisher Scientific 公司;DK-S26 水浴锅:上海精宏实验设备有限公司;恒温恒湿培养箱:上海新诺仪器设备有限公司;F-7000 FL 荧光分光光度计:日本日立公司。
1.3 方法
1.3.1 多酚对XOD 活性的抑制效果
参照杨华等[10]的方法并略作修改,测定几种多酚单体对XOD 活性的抑制能力。将多酚单体样品用少量二甲基亚砜(最终浓度<1%)溶解,再用磷酸盐缓冲溶液(50 mmol/L、pH7.4)稀释至 10、20、50、75、100 μg/mL。在96 微孔板中分别加入50 μL 0.1U/mL 黄嘌呤氧化酶和 100 μL 不同浓度的槲皮素、白藜芦醇、EGCG、橙皮苷、鼠尾草酸、山萘酚、高良姜素,10 min 后加入50 μL 0.16 mmol/L 黄嘌呤,每个样品做3 次重复,以磷酸缓冲盐溶液替代多酚单体作为空白对照组,并根据以下公式进行计算多酚单体对黄嘌呤氧化酶的抑制率:

式中:OD1为单体、酶和底物混合的吸光值;OD2为PBS 缓冲液、酶和底物混合的吸光值;OD3为单体、PBS 缓冲液和底物混合后的吸光值;OD4为PBS 缓冲液和底物混合后的吸光值。
1.3.2 多酚单体对XOD 抑制动力学分析
XOD 浓度为0.1 U/mL,选取5 种不同浓度的单体并改变黄嘌呤的浓度分别为 0.04、0.08、0.16、0.24、0.32 mmol/L,利用全波长酶标仪的动力学/时间软件,在波长295 nm 处每隔10 s 测定1 次吸光值,共测300 s[11]。Lineweaver-Burk 双倒数作图即以底物黄嘌呤浓度的倒数1/[S]为X 轴,酶促反应速率的倒数1/v为Y 轴作图,判断几种多酚单体对XOD 的抑制类型,抑制常数Ki的测定是通过选取两个仅改变底物浓度的酶活体系,计算不同浓度多酚单体抑制剂存在时酶促反应的速率,采用Dixon 作图法计算出Ki值[12]。
1.3.3 多酚单体与XOD 的分子对接模拟
用Autodock4.2 软件对3 种多酚单体和XOD 进行了分子对接。受体黄嘌呤氧化酶的pdb 格式文件可从protein data bank(PDB)数据库中下载(编号:1fiq),并对其进行去水、加氢、计算点电荷等处理使其能量最小化[13]。应用拉马克(Lamarckian GA)遗传算法来计算蛋白质与多酚单体可能的构象。在对接过程中,最多考虑了化合物的10 个构象,取结合自由能最低的构象用来做进一步的分析[14]。对接结果使用Ligplot+和Py-MOL 进行结合位点分析和图形显示。
1.3.4 多酚单体与XOD 的荧光猝灭实验
将含有300 μL 样品的比色皿分别置于288 K 恒温箱和298、308 K 水浴锅中[15]。将0.6 mL 多酚单体与0.3 mL XOD 混合置于比色皿中继续静置水浴10 min后进行荧光扫描。固定激发波长为280 nm,发射波长从300 nm 到500 nm,激发、发射的狭缝宽度均为2.5 nm,扫描速度12 000 nm/min。
以下Stern-Volmer 方程的数据分析方法如下公式所述[16]:

为研究二者相互作用力的类型,将以上荧光猝灭的实验数据代入修正的Stern-Volmer 方程:
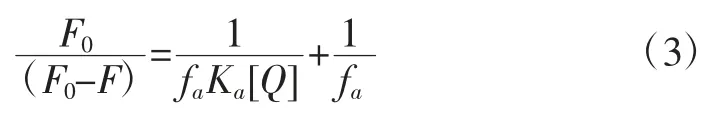
式中:F0为未加猝灭剂时XOD 的荧光强度;F 为加猝灭剂后XOD 的荧光强度;[Q]为猝灭剂的浓度;KSV为Stern-Volmer 动态猝灭常数;Kq为荧光猝灭的速率常数;τ0为生物大分子荧光平均寿命,大约为10-8s[17];Ka为 Stern-Volmer 修正猝灭常数;fa猝灭剂对初始荧光可接近百分数。
以下等式用于计算结合常数和结合时的位点数:
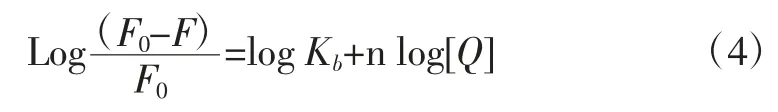
式中:Kb是多酚单体与黄嘌呤氧化酶的结合常数;n 是多酚单体与黄嘌呤氧化酶的结合位点数;Kb和n 是根据方程(4)从log[(F0-F)/F]与log[Q]的双对数回归曲线的斜率和截距数值确定。
1.3.5 数据处理
图表绘制采用Origin 8.0 软件绘制荧光猝灭图和酶的抑制动力学曲线,并用荧光计算公式的线性拟合。用SPSS 22.0 计算多酚单体对XOD 半数抑制浓度、标准差并做显著性分析。
2 结果与分析
2.1 多酚单体对XOD活性的抑制效果
6 种多酚单体和别嘌呤醇对XOD 都有抑制效果,抑制率随多酚单体和别嘌呤醇浓度的升高而不断增加,呈现剂量效应关系(图1A)。多酚单体和阳性对照(别嘌呤醇)对XOD 抑制率的回归分析结果即半数抑制浓度(IC50)见图1B。
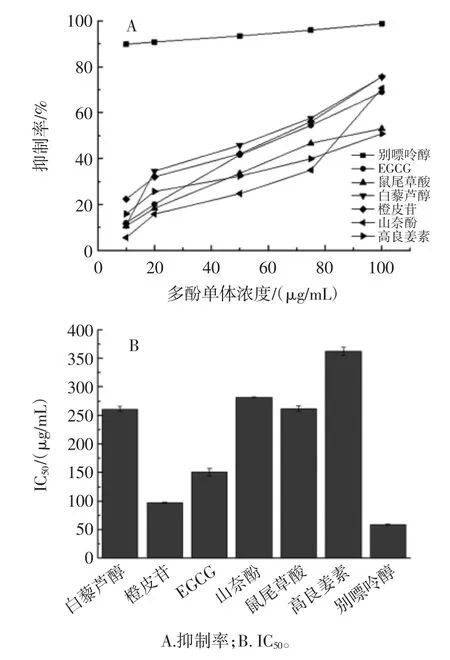
图1 不同浓度下6 种多酚单体及阳性对照别嘌呤醇的抑制率和IC50Fig.1 The inhibition rate and IC50 of six polyphenols and positive control allopurinol at different concentrations
所有单体对XOD 活性均表现有抑制作用,其中EGCG、白藜芦醇、橙皮苷对黄嘌呤氧化酶的抑制率相对较高,IC50分别为 68.99、59.62、59.27 μg/mL。Jia 等[18]也得到了类似的结果,计算出白藜芦醇对黄嘌呤氧化酶抑制率的IC50值为908 μM,证实了白藜芦醇不仅对超氧化物具有清除活性,而且还可抑制XOD 的活性。Rashidinejad 等[19]的研究虽没有计算具体的IC50,但是也证实了EGCG 对XOD 的抑制活性较儿茶素强,并揭示EGCG 对XOD 活性的抑制作用主要源于其自身含有较多数量的羟基,其数量在儿茶素类化合物对黄嘌呤氧化酶活性的抑制中起着重要作用。本研究结果也证实了上述结果,白藜芦醇、EGCG、橙皮苷与其它多酚相比,含有的羟基数量相对较多且抑制效果较好。多酚结构中位于C-5 和C-7 的羟基以及碳碳之间的双键对XOD 抑制作用至关重要[20],而从EGCG、白藜芦醇和橙皮苷结构分析也符合这一结论。由此可见,多酚对XOD 活性抑制作用的大小取决于其苯环和羟基的结构与数量。
2.2 多酚对XOD抑制作用的类型分析
多酚对XOD 的抑制动力学分析结果Lineweaver-Burk 曲线如图2 所示,其中图2A 中 1~5 EGCG 浓度为 21.82、43.63、109.08、163.62、218.15 μmol/L;图2B中 1~5 白藜芦醇浓度为 43.81、87.62、219.06、328.59、438.12 μmol/L;图2C 中 1~5 橙皮苷浓度为 16.38、32.76、81.89、122.84、163.78 μmol/L。
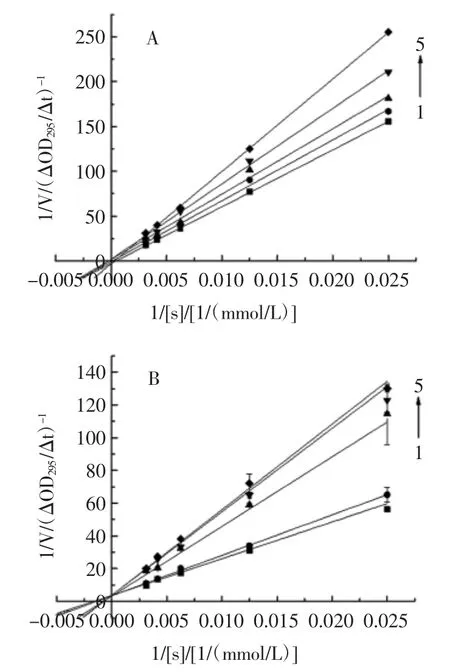

图2 EGCG、白藜芦醇、橙皮苷对XOD 的抑制类型判定图Fig.2 The determination type of inhibition of XOD by EGCG,resveratrol,hesperidin
可以看出,EGCG、白藜芦醇、橙皮苷随着因变量的增加直线的斜率不断降低,由此推断三者对XOD 的抑制作用属于可逆抑制作用[21],Lineweaver-Burk 曲线表现出典型的竞争性抑制特征,表明三种单体是XOD的竞争性抑制剂[22]。采用Dixon 作图法,取两个不同底物浓度[s]的反应体系,以加入的抑制剂浓度[I]对反应速率的倒数1/V 作图可求出抑制常数Ki值(图3)。
由两条相交直线求出其交点坐标得到EGCG、白藜芦醇和橙皮苷对XOD 的抑制常数Ki分别为10.26、20.34、5.33 μg/mL。
从大理藜芦(百合科)的根和茎甲醇提取物分离出的白藜芦醇等5 种多酚,对XOD 活性具有抑制作用,并呈剂量依赖型关系,其中白藜芦醇对XOD 的抑制效果与本研究结果一致,抑制率的IC50值为66.1 μmol/L,对XOD 的抑制类型也为竞争性抑制[23]。Aucamp 等[24]研究了5种儿茶素类化合物和两种黄酮对XOD 的抑制作用,也发现EGCG 是XOD 的竞争性抑制剂,与本试验结果相同。
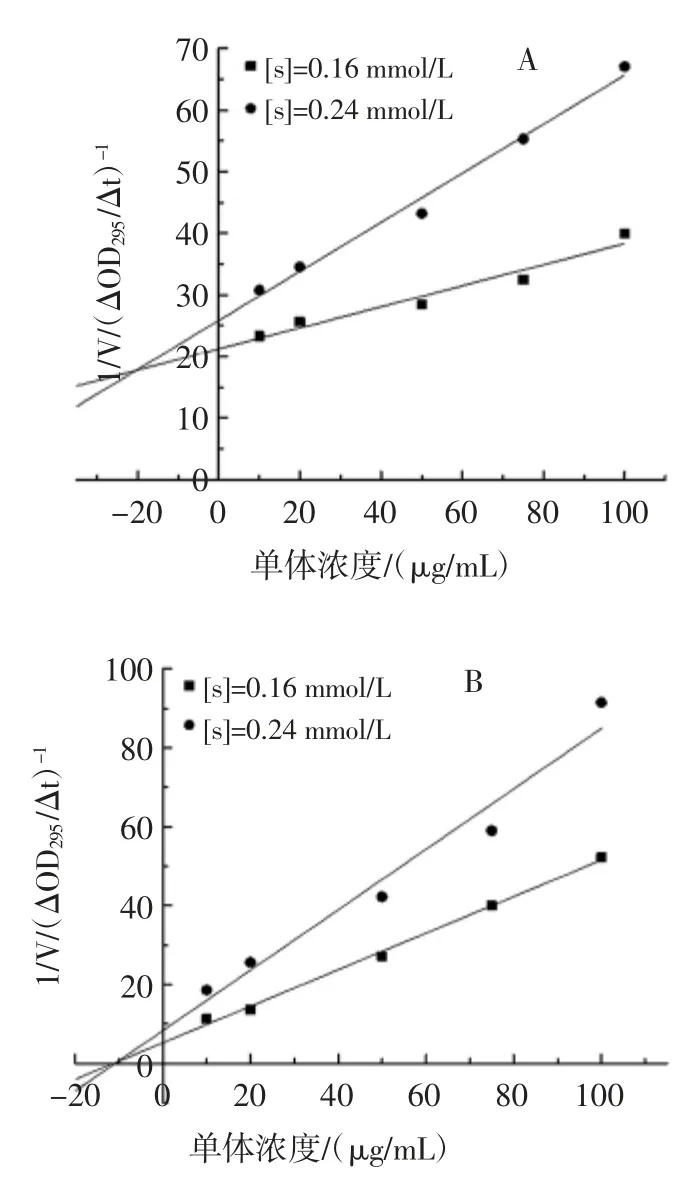
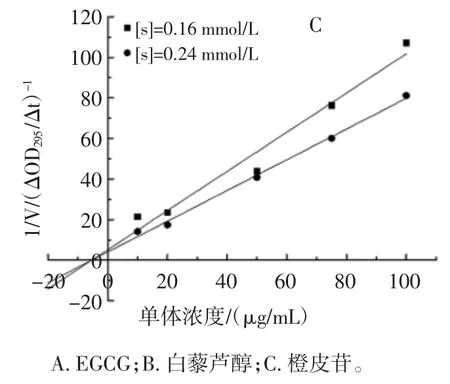
图3 EGCG、白藜芦醇、橙皮苷对XOD 的抑制常数判定图Fig.3 The determination constant of inhibition of XOD by EGCG,resveratrol,hesperidin
2.3 单体与XOD荧光猝灭光谱
XOD 含有3 种发光基团,分别是色氨酸、酪氨酸和苯丙氨酸[25]。苯丙氨酸具有非常低的荧光量子产率,如果酪氨酸被离子化或接近氨基,羧基或色氨酸,则酪氨酸的荧光几乎完全被猝灭,可见XOD 的内在荧光实际上完全归因于色氨酸。因此,XOD 的固有荧光强度的变化主要是小分子物质引起XOD 中色氨酸残基荧光强度的变化所致[26]。XOD 中每个亚基的氨基酸序列包括10 个色氨酸残基[27],多酚对XOD 猝灭强度的变化结果见图4,其中,图4A 中1~11 EGCG 浓度分别为 10.19、21.82、43.63、65.45、87.26、109.08、130.89、152.71、174.52、196.34、218.15 μmol/L;图4B 中 1~11 白藜芦醇浓度分别为 21.91、43.81、87.63、131.44、175.25、219.07、262.88、306.69、350.51、394.32、438.14 μmol/L;图4C 中1 ~11 橙 皮 苷 浓 度 分 别 为 8.19、16.38、32.76、49.14、65.51、81.89、98.27、114.65、131.03、147.41、163.78 μmol/L;3 个子图中12 均为XOD。
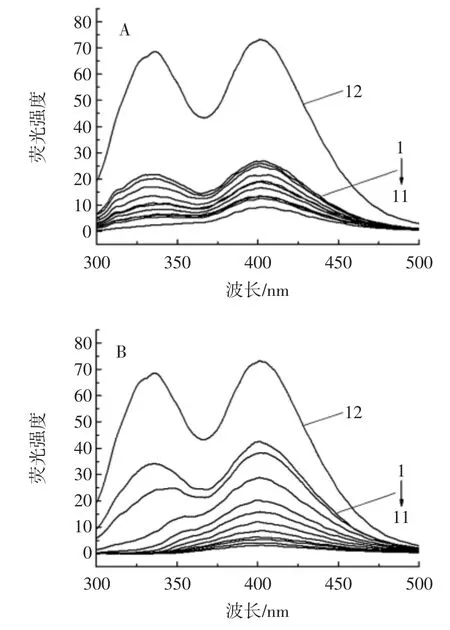
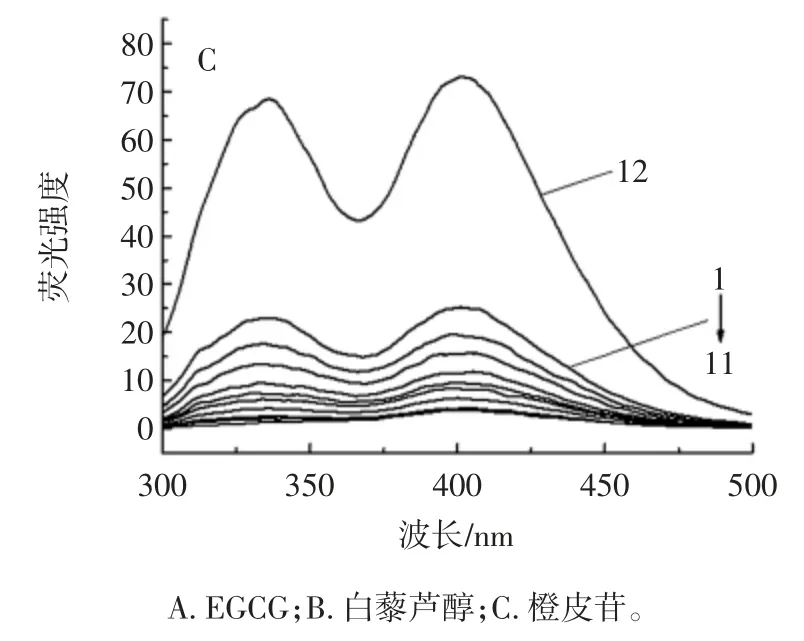
图4 在XOD 中分别加入EGCG、白藜芦醇、橙皮苷的荧光猝灭图Fig.4 Fluorescence quenching of EGCG,resveratrol,hesperidin in XOD
随着多酚浓度的增加,XOD 的荧光强度逐渐降低,最终XOD 的荧光峰完全消失,所以多酚是以类似浓度依赖的方式使XOD 发生荧光猝灭,且很可能与XOD 的某些氨基酸残基结合。随着多酚浓度的增加,荧光强度和发射波长呈现出线性关系,表明荧光猝灭类型是单一的静态猝灭或动态猝灭。动态和静态淬灭可以通过它们对温度的不同依赖性来区分。对于静态淬灭,淬灭常数随温度升高而降低,而在动态淬灭则相反[28]。根据Stern-Volmer 方程作图(图5)。计算得出猝灭常数KSV、猝灭速率常数Kq、修正猝灭常数Ka、结合常数Kb和结合位点数n(表1)。
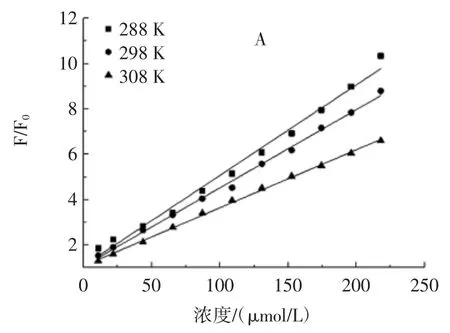
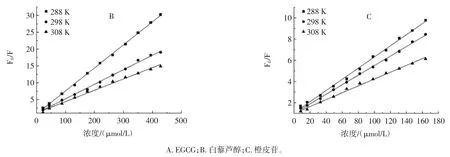
图5 不同温度下EGCG、白藜芦醇、橙皮苷与XOD 结合的Stern-Volmer 曲线Fig.5 Stern-Volmer curves of resveratrol,EGCG,and hesperidin combined with XOD at different temperatures

表1 3 种多酚单体在不同温度下对XOD 的Stern-Volmer 猝灭常数、结合常数、结合位点数Table 1 Stern-Volmer constant,KSV and biomolecular quenching rate constant,Kq for resveratrol,EGCG,and hesperidin with XOD
当多酚浓度较低时,KSV和Kq值随着温度的升高而减小,说明形成的多酚和酶的复合物不稳定,XOD的猝灭效果差,Kq值高于各种生物聚合物的最大碰撞淬灭常数(2.9×1010L/(mol·s))表明了猝灭过程是静态的,这可能是由于多酚单体-XOD 复合物的形成导致XOD 的构象发生改变,从而改变了荧光氨基酸残基的微环境,导致了XOD 荧光的静态猝灭[29]。KSV与Kb趋势相反,表明多酚单体可能独立结合XOD 的几个不同位点,包括XOD 中的荧光和非荧光氨基酸残基[9]。Ka数值较大,表明多酚和XOD 之间存在较强的相互作用[30]。此外,Ka还随温度的升高而降低,说明随着温度的升高,多酚与XOD 之间的相互作用减弱。从表1 数据可知,n 值在1 附近,说明多酚单体与XOD 结合有且只有一个结合位点。3 种多酚单体与XOD 结合常数Kb的大小顺序为:橙皮苷>EGCG>白藜芦醇,这可能是由于橙皮苷和EGCG 自身含有较多的羟基,容易与氨基酸残基之间形成氢键或静电作用,表明位于结合位点周围的多酚单体与生物活性物质之间的结合能力发生了一些改变[19]。
2.4 多酚与XOD的结合位点分析
XOD 是以同型二聚体形式表示的氧化还原酶,包括4 个氧化还原中心,一个FAD 结构域和具有两个铁硫中心的N-末端结构域。酶的活性中心通常被认为是结合位点结构域和在N 末端的2[Fe-S]/铁硫结构域[31]。当底物黄嘌呤在XOD 的Mo-pt 结构域附近经历氧化反应时,同时底物氧在FAD 中心处发生还原并且发生电子转移,导致形成超氧阴离子(O2-)或过氧化氢(H2O2)自由基[32]。
为了阐明多酚单体与XOD 的结合机制,通过AutoDock4.2 对3 种多酚单体与XOD 进行分子对接,得到的最优结果如图6。
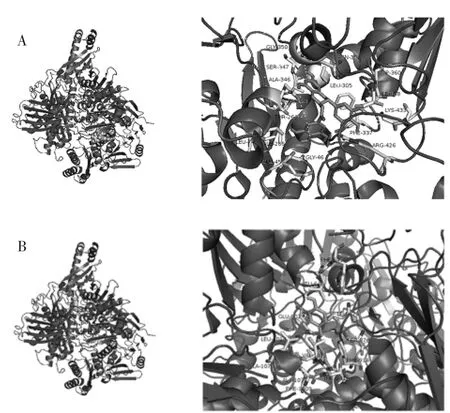
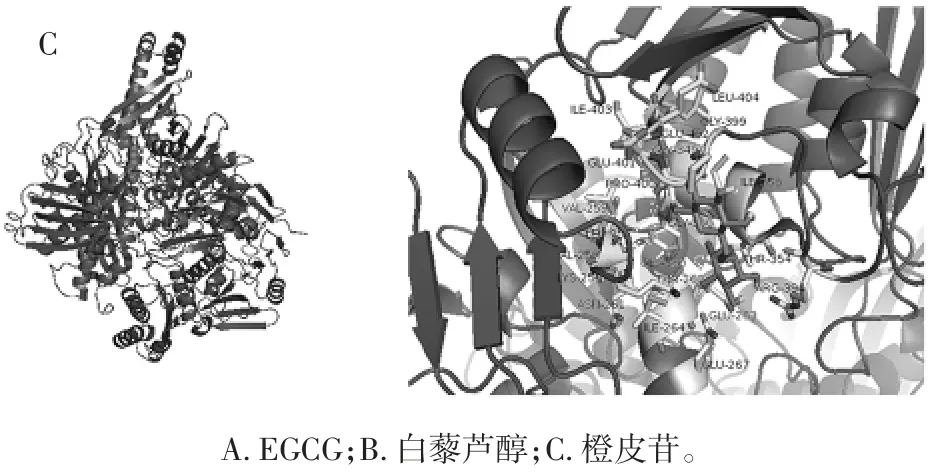
图6 EGCG、白藜芦醇、橙皮苷与XOD 的分子对接Fig.6 The docking models of XOD inhibition by EGCG,resveratrol,hesperidin
由图6 可知,白藜芦醇作用于XOD 的Mo-pt 结构域活性中心附近,EGCG、橙皮苷作用于XOD 的FAD 结构域上,最优构象的吉布斯自由能分别为-8.8 kcal/mol,-11.7 kcal/mol,-11.2 kcal/mol,说明白藜芦醇、EGCG、橙皮苷和XOD 可自发地反应结合形成复合物。多酚单体与XOD 的二维结合图如图7 所示。
在复合物中橙皮苷与XOD 的关键残基Lys256,Leu257,Val258,Thr262,Glu263,Ile264,Gly349,Gly350,Ile353,Thr354,Pro400,Ile403 具有疏水相互作用,并且与 Val259,Gly260,Asn261,Glu267,Arg394,Leu398,Gly399,Glu402,Leu404 都形成了氢键,这表明氢键是多酚单体与XOD 结合的另一主要作用力[33-34]。EGCG位于 FAD 结构域周围由 Gly46,Leu74,Glu263,Ile266,Leu305,Phe337,Ala346,Gly350,Asn351,Asp360 氨 基酸残基包围的疏水口袋中,与Glu45,Ser347,Thr262,Ile358,Arg426,Lys433 形成氢键[35]。白藜芦醇与钼喋呤MOS3004 活性中心附近的 Thr1010,Ala1079 形成氢键,与氨基酸残基 Leu648,Phe649,Glu802,Leu873,Ser876,Phe914,Phe1009,Val1011,Leu1014,Ala1078和钼喋呤Mos1334 活性中心形成疏水相互作用[36]。Leu648,Phe649,Glu802 等残基被证明在底物黄嘌呤的羟基化中发挥关键作用,表明氢键是白藜芦醇与XOD 结合的主要作用,表明白藜芦醇具有与底物相同的结合区域[37]。
因此,在多酚单体与XOD 的疏水残基结合的过程中,氢键与疏水作用在多酚单体-XOD 复合物形成过程中起到了重要作用,是多酚单体与XOD 结合的主要驱动力。基于对接结果,可以推断多酚单体对XOD 活性的抑制作用可能是因为其插入到XOD 的疏水缝隙中占据了其催化活性中心,与底物黄嘌呤竞争结合XOD 的活性位点,阻碍了底物的进入,并且多酚的进入诱导了XOD 构象的变化,直接导致其活性降低。结合对单体化学结构的观察和分子对接模拟实验结果的分析,推测白藜芦醇、EGCG、橙皮苷对XOD 的抑制效果优于其他常见的多酚的原因可能是其拥有对XOD 产生高抑制活性的必须结构,如芳香环的C-5 和C-7 上的羟基[20],同时它们具有更多的疏水的芳香杂环或羟基,便于与XOD 的多个残基形成氢键或产生疏水作用。Tang 等[38]发现丹参酚酸C(salvianolic acid C,SAC)能够插入XOD 活性腔中,Mo-Pt 结构域的活性位点也位于活性腔中,推断SAC 可以与底物黄嘌呤竞争结合XOD 的活性位点,与本试验EGCG 和橙皮苷的结果基本一致。
3 结论
本文研究了6 种常见多酚单体对XOD 的抑制作用,其中白藜芦醇、EGCG 和橙皮苷的抑制率最高,抑制 XOD 的 IC50分别为 261.22、150.51、97.08 μmol/L。白藜芦醇、EGCG 和橙皮苷可逆且竞争性抑制XOD 活性,Ki值分别为 10.26、20.34、5.33 μg/mL。由于单体和XOD 的配合物的形成,静态猝灭了XOD 的荧光,通过猝灭常数、猝灭速率常数、结合常数、结合位点数的分析,掌握了不同温度下XOD 猝灭程度的变化规律。分子对接分析表明多酚单体与XOD 的一些重要氨基酸残基通过氢键和疏水相互作用,与3 种单体亲和力较高的位点分别位于FAD 结构域和Mo-pt 结构域活性中心。上述3 种多酚抑制XOD 活性的半数抑制浓度略高于临床常用药别嘌呤醇,但是它们都来源于天然产物,毒副作用小,可以作为辅助降尿酸功能营养食品或药品中添加的主要成分。

