糖基化修饰对澳洲坚果蛋白性质的影响
董璐,吴亚敬,贾增艳,吴玥琨,张燕
(1.天津科技大学食品工程与生物技术学院,食品营养与安全国家重点实验室,天津300457;2.南开大学医学院,天津市食品科学与健康重点实验室,天津300071)
食物过敏,医学上称之为变态反应,是由食物中所包含的某些成分引起的一种人体免疫系统的不良反应,最常见的是由免疫球蛋白E 介导的过敏反应[1]。食物中的过敏原主要来自于蛋类、奶类、谷物类、鱼类、坚果类等食物中的蛋白质[2]。徐海涛等[3]通过食物过敏皮肤点刺实验分析了1 294 名1 岁以下婴儿因食物过敏导致的皮肤病的过敏原,结果表明易导致过敏主要物质为鸡蛋清、花生、鸡蛋黄、小麦、大豆中的蛋白质,其次为虾、鱼类和牛奶中的蛋白质。摄入蛋白质可以为人们健康带来益处,但食物中蛋白质导致的食物过敏食又为人们健康敲响警钟。
抗原决定簇又称抗原表位,是决定蛋白质抗原性的特殊化学基团,经多项研究表明,食品加工过程能在很大程度上影响蛋白质的抗原决定簇,从而在一定程度上消除或降低食物过敏原的免疫反应性,降低敏感人群的过敏几率[4-11]。食品加工可以导致蛋白质结构不同程度的改变,包括聚集,折叠和糖化,以及美拉德反应产物的出现。所有这些改变都可能会影响到过敏原与IgE 结合能力,从而增加或减少蛋白质的变应原性[12]。目前,有很多研究不同加工方式对过敏原的结构,免疫反应性及致敏性的影响,希望能通过加工的方式降低食品中蛋白质的致敏性,开发低致敏食品[13-15]。
澳洲坚果又称夏威夷果,是一种具有很高营养价值的坚果类食品,备受人们喜爱。有研究表明,澳洲坚果具有提高人体免疫力,增强体质的功能[16]。但是澳洲坚果中的蛋白也会引起较为严重的过敏反应,经过加工或者生鲜的澳洲坚果被患者食用后,会使得患者出现全身瘙痒、呼吸困难、嘴唇及眼睛肿胀甚至昏厥的现象,引起不同程度的过敏现象[17]。Sicherer 等[18]对易过敏的188 名参与者进行了调查,其中约有9%对澳洲坚果敏感。
食物过敏已成为世界范围普遍关注的食品安全问题,如何通过食品加工手段降低食物过敏原的致敏性,开发低致敏食品是食品科学领域重要的研究方向。目前,通过加工处理来改变澳洲坚果蛋白(Macadamia protein,M-Pro)的免疫反应性的研究未见相关报道。本研究通过模拟热加工条件,研究不同种类的糖对M-Pro 糖基化修饰产物的溶解性,消化性以及免疫反应性的影响,探究降低M-Pro 潜在致敏性的有效手段,为开发低致敏食品奠定理论基础。
1 材料与方法
1.1 材料与仪器
牛血清白蛋白(bovine serum albumin,BSA,标品级)、HRP-羊抗兔酶标二抗、α-糜蛋白酶(40 U/mg)、胰蛋白酶(10 000 BAEE U/mg)、蛋白酶(来自灰色链霉菌属,3.5 U/mg):美国 Sigma 公司;ProteinA-SepHarose 4B凝胶:美国Amersham 公司;蛋白质分子量预染Marker、澳洲坚果蛋白兔多克隆抗体血清:天津科技大学食品营养与安全国家重点实验室自制;澳洲坚果:云南江城中澳农业科技发展公司;无水乙酸钠、β-环糊精、柠檬酸、过氧化氢脲、3,3',5,5'-四甲基联苯胺(3,3',5,5'-tetramethylbenzidine,TMB)、二甲基亚砜、三羟甲基氨基甲烷(trismetyl aminomethane,Tris)、甘氨酸、十二烷基硫酸钠、甲醇、氯化钠、吐温-20 为分析纯。
Multiskan Sky 全波长酶标仪:美国Thermo 公司;Mini-PROTEAN Tetra 电泳仪、Mini Trans-Blot 转印槽、ChemiDoc XRS 凝胶成像系统:美国Bio-Rad 公司;S210-B pH 计:瑞士梅特勒-托利多公司;RH-KT/C 磁力搅拌器、MS-3 摇床:德国IKA 公司;Microfuge 20R冷冻离心机:美国贝克曼公司;PT2500E 匀浆机:美国OMNI 公司。
1.2 溶液配制
1.2.1 包被缓冲液
碳酸钠-碳酸氢钠缓冲液(0.05 mol/L,pH 9.6):分别称取 1.60 g 的 Na2CO3,2.91 g 的 NaHCO3,用去离子水定容到1 L。
1.2.2 洗涤缓冲液
PBST(pH7.4):准确称取13.76g的Na2HPO4·12H2O,1.79 g 的NaH2PO4·H2O,9 g 的NaCl 用去离子水溶解后加入 0.50 mL 的 Tween-20(20%),定容到 1 L。
1.2.3 底物显色液
底物液A:准确称取4.10 g 无水乙酸钠,1.25 g β-环糊精,1.615 g 柠檬酸,214.3 mg 过氧化氢脲,定容至500 mL。
底物液B:0.2 TMB 溶于20 mL 的二甲基亚砜。
1.2.4 10 倍蛋白电泳缓冲液
称取Tris 30.3 g,甘氨酸144.2 g,十二烷基硫酸钠10.0 g,用去离子水定容到1 L。
1.2.5 转膜缓冲液
10 倍蛋白电泳缓冲液 ∶甲醇 ∶去离子水(1 ∶2 ∶7,体积比)。
1.2.6 20×Tris 缓冲生理盐水
称取48.4 g Tris,160.0 g 氯化钠于去离子水中充分溶解,调pH 值至7.6,定容到1 L。
1.2.7 Tris 缓冲生理盐水-吐温缓冲液
取 20×的 TBS 缓冲液 50 mL,稀释成 1×溶液,加入5 mL 吐温-20。
1.2.8 消化酶液
称取 16 mg 胰蛋白酶、39.6 mg α-糜蛋白酶、23 mg蛋白酶,用去离子水使3 种蛋白酶完全溶解,调节pH值到8.0,定容到10 mL。
1.3 试验方法
1.3.1 M-Pro 的制备
根据实验室前期优化的M-Pro 提取方法提取MPro[19]。采用 Bicinchoninic Acid 试剂盒测定 M-Pro 含量,试验步骤按试剂盒说明书进行。测得M-Pro 含量为90.40%。
1.3.2 糖基化修饰M-Pro
根据提取的M-Pro 质含量称取蛋白质,使M-Pro分别与葡萄糖和蔗糖按照质量比为3 ∶1 和1 ∶1 混匀,称取各样品300 mg 于带螺帽厚壁加热管中,分别在160 ℃和180 ℃下加热处理。以未处理的M-Pro 及分别在160 ℃和180 ℃下热处理的M-Pro 作为对照。
1.3.3 M-Pro 溶解性的测定
将热处理后的样品研磨至粉末状后,称取200.0 mg溶于 5 mL 磷酸盐缓冲液(0.01 mol/L,pH 8.5),摇床振荡混匀3 h,使蛋白充分溶解,之后吸取上清液3 mL 于10 000 Da 的超滤离心管中,5 000 r/min 离心 10 min,将溶液浓缩到250 μL 后用考马斯亮蓝法测定蛋白质浓度。以牛血清蛋白为标准品,考马斯亮兰G-250 为染料,在595 nm 处测定吸光度值(A595)绘制标准曲线,将待测样品稀释20 倍,测定A595,计算样品浓度。根据稀释倍数换算蛋白质的溶解率,并以未处理的M-Pro的溶解率作为基准,计算相对溶解率。
1.3.4 澳洲坚果蛋白免疫反应性的测定
试验所用抗体为实验室自制兔多克隆抗体,通过ProteinA-SepHarose4B 凝胶纯化获得,浓度为1.5 mg/mL。
采用间接竞争酶联免疫竞争吸附(enzyme-linked immunosorbentassay,ELISA)方法测定试样的 IC50值。操作步骤如下:(1)用包被液稀释M-Pro,浓度为 0.25 μg/mL包被在酶标板上,100 μL/孔,在 4 ℃下包被 15 h;(2)包被结束后甩出包被液,用洗涤缓冲液洗板3 次,2 min/次,200 μL/孔加入1%的脱脂乳粉作为封闭液,在37 ℃封闭1 h;(3)封闭结束后甩出封闭液,用Tris 缓冲生理盐水-吐温缓冲液重复洗板3 次,2 min/次,空白孔加入 100 μL PBS(0.01 mol/L,pH 8.0)、对照孔加入 50 μL PBS 和 50 μL 抗体,加样孔加入 50 μL 待测样品蛋白溶液和50 μL 稀释20 000 倍的M-Pro 兔多克隆抗体,37 ℃孵育 1 h;(4)孵育结束后甩出溶液,用 Tris 缓冲生理盐水-吐温缓冲液重复洗板4 次,2 min/次,将稀释了25 000 倍的HRP-羊抗兔酶标二抗以100 μL/孔加入到酶标板中,37 ℃孵育30 min;(5)孵育结束后甩出溶液,用Tris 缓冲生理盐水-吐温缓冲液重复洗板5 次,2 min/次,底物液 A 与底物液 B 按 33 ∶1(体积比)混合均匀,100 μL/孔,置于 37 ℃显色 15 min;(6)每孔加入 100 μL 终止液(H2SO4溶液 1.25 mol/L),终止后显示黄色。(7)读取各个孔的吸光度值A450~650,按照以下公式计算抑制率:
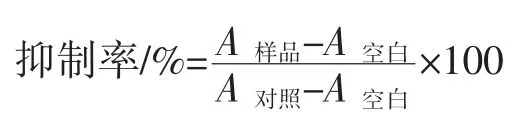
式中:A对照、A样品和 A空白分别为对照孔、样品孔和空白孔的平均吸光度值。
1.3.5 澳洲坚果蛋白消化性的测定
采用pH 值降低法测定待测样品的消化率[20]。不同条件处理后的M-Pro 样品研磨致粉末状后,称取100 mg,定容到 25 mL。37 ℃水浴 1 h,调 pH 值至 8.0,取1 mL 配置好的消化酶液加入到各样品中,消化10 min 并伴随磁力搅拌(50 r/min),之后煮沸 5 min 灭酶活,测定消化10 min 时的pH 值。按照以下公式计算消化率:
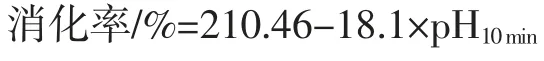
1.3.6 澳洲坚果蛋白及其消化产物的免疫印迹分析
首先采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)对样品中蛋白进行分离,浓缩胶和分离胶浓度分别为5%和12%,上样浓度为1 mg/mL,分离胶采用80 V 电压,浓缩胶采用100 V 电压。SDSPAGE 完成后将凝胶取下进行转膜操作,用去离子水浸润凝胶,平衡15 min 后,将转印膜、滤纸板和凝胶浸泡在转印缓冲液中平衡30 min。设置电压为25 V,转印40 min 后,将转印膜置于孵育盒中,倒入TBST 缓冲液,置于摇床上24 ℃洗膜5 min。加入15 mL 封闭液在摇床上24 ℃封闭1 h,,加入15 mL 稀释的兔多克隆抗体,结合1 h。用TBST 洗膜3 次,与稀释后的HRP-羊抗兔酶标二抗24 ℃结合1 h。然后将AB 曝光液1 ∶1(体积比)在暗室混合后平铺在转印膜上,用曝光仪曝光拍照得到抗原抗体结合图。
1.4 数据处理
所有试验平行测定3 次,利用统计学软件SPSS 24.0 对试验结果进行方差分析。
2 结果与分析
2.1 糖基化修饰对M-Pro产物溶解性的影响
热处理条件下,糖基化修饰对M-Pro 溶解性的影响如表1 所示。
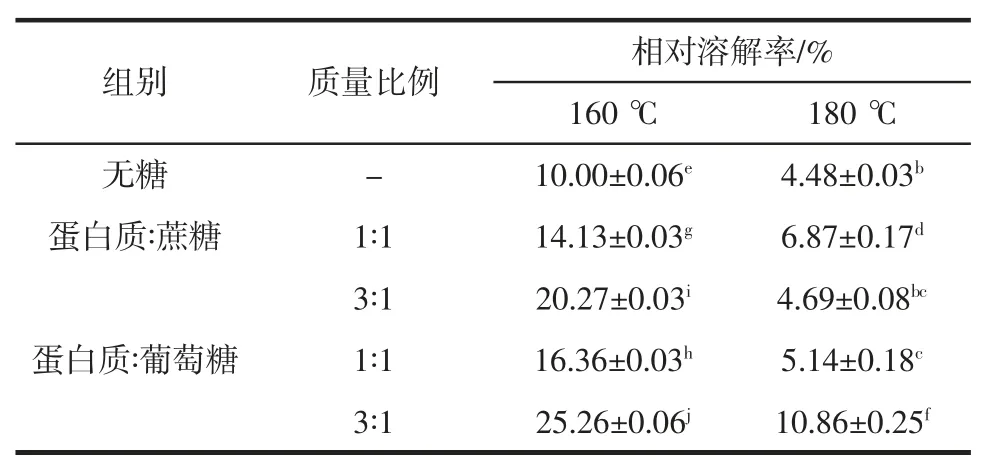
表1 热处理对糖基化M-Pro 相对溶解率(X±SD,%)的影响Table 1 Effect of heat treatment on relative solubility(X±SD,%)of the glycated Macadamia protein
以未经处理的M-Pro 溶解率作为对照,未经糖基化的M-Pro 分别在160 ℃和180 ℃加热后,相对于未经处理的M-Pro 溶解率分别为10.00%和4.48%,温度与溶解率呈负相关关系,相较于未处理的M-Pro 溶解性显著降低(P<0.05),说明热处理可以降低蛋白质的溶解性,这可能是由热处理导致的蛋白质结构改变,蛋白质发生聚集所引起的。而在相同温度分别被蔗糖和葡萄糖糖基化修饰的M-Pro 的溶解率高于被单独热处理的M-Pro 的溶解率,说明蛋白的糖基化修饰有利于在热处理条件下保持蛋白质的溶解性。有研究结果指出,经过糖基化反应的蛋白质热稳定较强[21],且溶解性提高[22]。在相同条件下,葡萄糖作为糖基供体时热处理得到的糖基化产物的相对溶解率比蔗糖高,可能是由于葡萄糖为还原糖,具有游离醛基,可以迅速与蛋白的氨基进行反应[23-25],从而提高蛋白质溶解性。
2.2 糖基化修饰对M-Pro免疫反应性的影响
图1 为以不同浓度未处理的M-Pro 绘制的M-Pro间接竞争 ELISA 标准曲线,IC50为(3.04±0.03)ng/mL。同样绘制不同处理的M-Pro 间接竞争ELISA 标准曲线,得到相应的IC50(R2>0.99)。表2 为不同处理条件M-Pro 的 IC50。
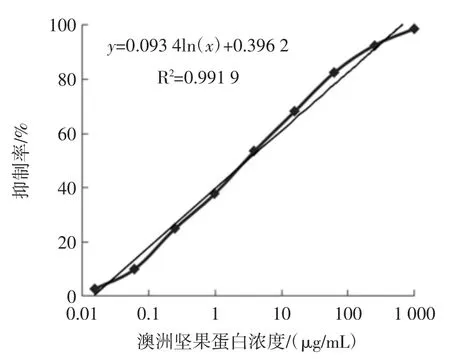
图1 M-Pro 间接竞争ELISA 标准曲线Fig.1 The standard curve of indirect competition ELISA for Macadamia nut allergens
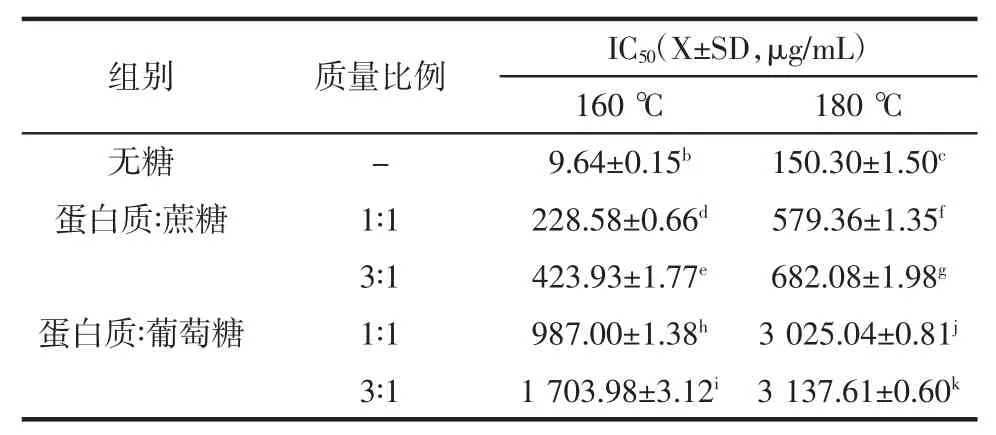
表2 不同处理方法M-Pro 的IC50(X±SD,μg/mL)的影响Table 2 Effects of different dreatments on the IC50(X±SD,μg/mL)of Macadamia protein
未处理的M-Pro IC503.04±0.03a,未经糖化处理的M-Pro 为分别在 160 ℃和 180 ℃热处理时,其 IC50分别为9.64 ng/mL 和150.30 ng/mL,IC50显著增大,说明热处理可降低M-Pro 的免疫反应性,这可能是由于热处理能使过敏原蛋白的结构发生变化,导致其与抗体结合的表位或抗原决定簇被隐藏或被破坏,从而与抗体结合的程度降低。在相同温度下,经葡萄糖和蔗糖糖基化修饰的M-Pro 的IC50显著大于单独热处理的MProIC50,说明糖基化修饰可降低M-Pro 质的免疫反应性,这可能是在糖基化过程中糖与M-Pro 发生化学反应,对蛋白质发生的修饰作用使蛋白的抗原表位破坏或被掩蔽,从而减少了与抗体结合的表位,表现出免疫反应性的降低。有研究结果显示,当某些蛋白的突变序列的基因被糖基化的糖链覆盖时,能够避开免疫监视作用同时改变过敏原蛋白的免疫反应性,例如,通过特定的方法把糖链接到天门冬酰胺酶上,动物实验显示可降低其在小鼠体内的免疫原性[26]。在相同温度下,葡萄糖糖基化修饰M-Pro 的IC50显著大于蔗糖糖基化修饰的M-Pro,说明葡萄糖糖基化修饰M-Pro能更好的降低M-Pro 的免疫反应性,分析原因一方面是葡萄糖为还原糖,而蔗糖为非还原糖,还原糖参与糖基化反应速度比非还原糖快且反应程度大;另一方面,葡萄糖属于六碳单糖,相对于分子量较大的蔗糖而言,葡萄糖内部的C 链较短,碳架的空间阻位效应较小,相比之下较容易发生糖基化反应,因此葡萄糖对蛋白的结构修饰作用更大[27],导致M-Pro 的抗原决定簇的破坏或掩蔽更强,因此蔗糖参与的糖基化反应产物较葡萄糖参与的反应产物的免疫反应性显著降低(P<0.05)。朱婷伟[28]在研究糖基化修饰大豆过敏原蛋白的抗原性时发现,用葡萄糖作为糖基供体降低大豆球蛋白的抗原性效果最好。在相同的糖类与加热温度条件下,蛋白质与糖的质量比越小,得到的相对IC50值越大,这可能是较高比例的糖的会导致M-Pro 接枝度增加,使得与抗体结合的相应位点减少,与低比例的糖参与糖基化反应比较,得到的糖基化产物的免疫反应性较低,这可能是因为糖的比例越高对蛋白质修饰程度越大,从而更大程度的破坏抗原决定簇。
综合以上研究结果说明,糖基化反应能降低M-Pro的免疫反应性,且温度越高,糖与蛋白的比例越高,产物的免疫反应性越小,同时还原糖的影响作用显著高于非还原糖。
2.3 糖基化修饰的M-Pro的消化率
热加工对蛋白糖基化产物的消化性,如表3 所示。

表3 热加工对M-Pro 消化率(X±SD,%)的影响Table 3 Effect of thermal processing on Macadamia protein digestibility(X±SD,%)
与未处理蛋白的消化率95.71%比较,经单独加热后M-Pro,消化率降低,说明热加工能使蛋白改性,且随着加热温度的升高,消化率降低到92.75%,可能是热加工使蛋白形成了疏水性聚集体从而更耐水解。当坚果蛋白与蔗糖、葡萄糖混合加热形成糖基化产物的消化率降低到90.35%,消化率降低可能是糖基化修饰了蛋白,减少了消化酶的识别位点[29]。在相同条件下,与蔗糖相比,葡萄糖糖基化修饰的M-Pro 的消化率较低,这可能是由葡萄糖比蔗糖作为糖基供体发生糖基化反应的速率较快,使得蛋白质表面更多的酶水解位点被覆盖,导致消化率降低。因此,葡萄糖修饰对M-Pro 的修饰作用更强,使得消化率降低。在加热温度和糖的种类相同的情况下,糖含量越高,糖基化修饰的M-Pro 消化率越小,这可能是由于糖的含量增加会导致蛋白被糖修饰的程度增大[30],使澳洲坚果蛋白表面的酶水解位点相对较少,从而降低蛋白的消化率。
综合以上试验结果,糖基化能降低澳洲坚果蛋白的消化率,温度越高消化率越低。
2.4 免疫印迹抗体识别性
2.4.1 糖基化M-Pro 免疫印迹抗体识别性
将热处理后的可溶性蛋白进行免疫印迹分析,如图2。
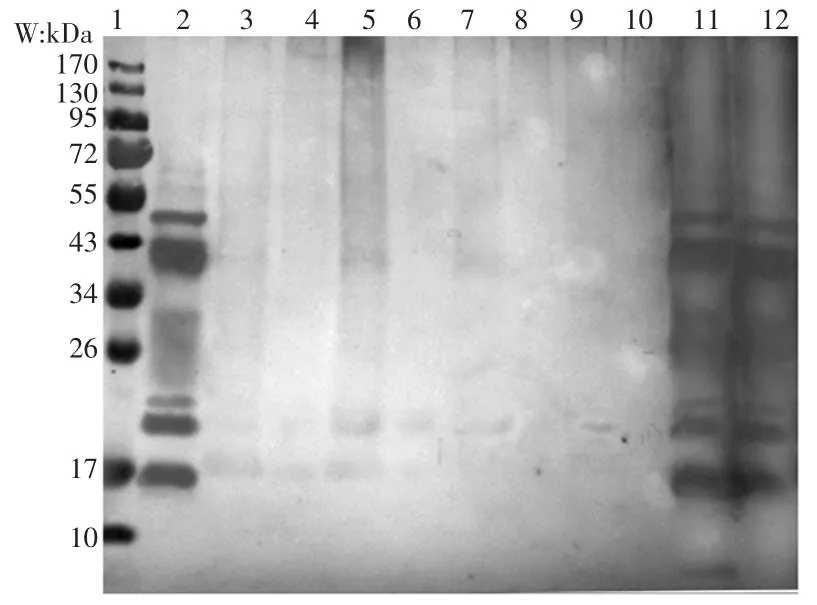
图2 M-Pro 及不同条件下糖基化产物的免疫印迹结果Fig.2 Western blot results of Macadamia protein and glycosylation products under different conditions
未处理蛋白与特异性抗体结合反应明显,制备蛋白的所有组分均与对应抗体识别。与未处理蛋白相比,单独加热处理的蛋白(160、180 ℃)与抗体结合的条带没有变化,但条带颜色随着加热温度的增高而变浅,说明蛋白组成变化不大。糖基化反应后,产物与抗体的识别能力大大降低,只有在18 kDa 附近的蛋白显示较弱的抗体结合力。蛋白与蔗糖质量比为3 ∶1 时糖基化产物的免疫印迹条带较清外,说明糖基化反应显著降低了蛋白与抗体的识别力,可能是由于抗原表位结构的破坏,导致不能与特异性抗体识别位点的结合。
2.4.2 模拟消化物免疫印迹抗体识别性
模拟消化后蛋白的结构变化,将消化物进行免疫印迹分析,结果如图3。
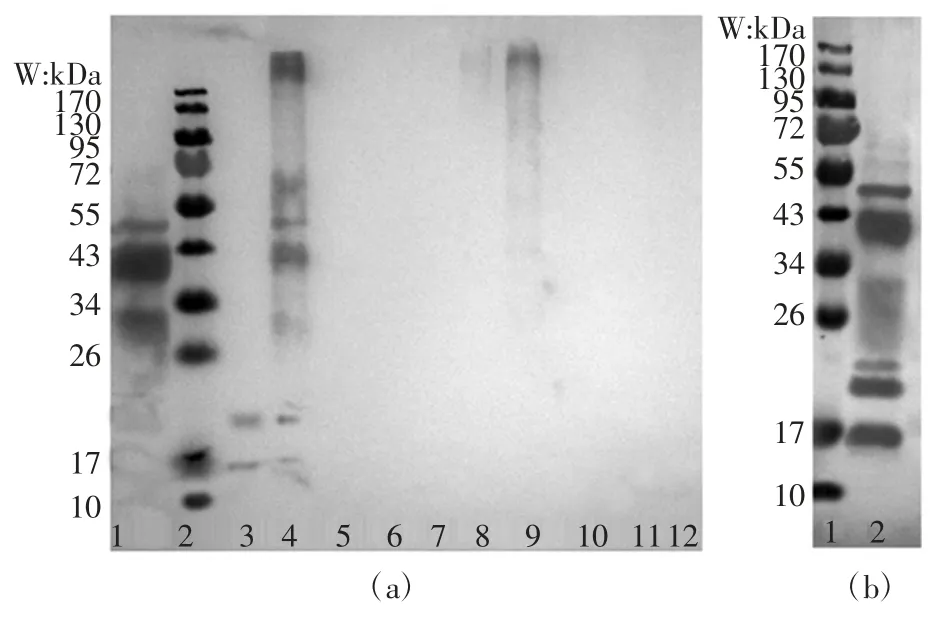
图3 热加工对M-Pro 糖基化产物模拟消化产物的免疫印迹结果Fig.3 Immunoblot results of macadamia protein glycosylation products simulated by thermal processing
未消化蛋白与所制备的特异性抗体有明显的结合反应,制备的蛋白所有组分均能与对应抗体识别,而未处理的蛋白经过消化后仅剩3 条蛋白条带与抗体结合,分别在30、43、50 kDa 左右,这可能是在消化过程中大部分的蛋白被水解成小片段不能识别抗体。蛋白经过160 ℃单独热加工时,消化产物仅有17、20 kDa左右的分子量的蛋白与抗体结合,经过180 ℃单独热处理后,消化产物在 17、20、30、43、50 kDa 左右的分子量能识别抗体,这可能是经过热处理后,消化率降低导致能与抗体结合的蛋白质没有被消化,使之与抗体的识别能力较高。糖基化产物经过消化后,识别抗体的能力减弱,蛋白与葡萄糖质量比为1 ∶1,加热160 ℃时,糖基化产物的消化物能与抗体结合条带较模糊。这可能是由于蛋白的抗原表位被糖链修饰,导致不能与特异性抗体识别位点结合。免疫印迹结果与消化率结果一致,消化率越低,蛋白被糖基化修饰的程度越高且随着加热温度的升高形成的不可消化的高聚物越多。
3 结论
糖基化修饰M-Pro 可降低其溶解性、消化性和免疫反应性。与单独热处理M-Pro 相比,糖基化修饰降低了M-Pro 的免疫反应性,但提高了M-Pro 的溶解性,且对消化性影响不大。在相同处理条件下葡萄糖参与的糖基化反应比蔗糖对M-Pro 结构的影响程度更大,说明还原糖对改善M-Pro 致敏性更为有效。糖基化处理能显著降低M-Pro 的免疫反应性,特别是还原糖的作用更强,是降低蛋白致敏性的潜在有效手段。

