水产养殖水、沉积物中抗生素检测方法优化及残留特征研究
李贞金,张洪昌,沈根祥,*,胡双庆,郭春霞,王真,曹国民,#
1. 华东理工大学,上海 200237 2. 上海市环境科学研究院,上海 200233
中国是世界上最大的水产品生产者、消费者和出口商[1-2]。全球超过1/3的水产品来自中国,其中,大部分来自水产养殖[3-4]。然而,目前淡水养殖大多数采用高密度的养殖模式,使鱼类疾病频繁发生[5]。抗生素作为预防细菌感染和寄生虫病的药物,大量使用于水产养殖中[6]。据统计,2013年中国抗生素使用量约为16.2万t,水产和畜禽使用量占总量的52%[7]。
水产养殖中,投入的抗生素仅有20%~30%被鱼类等水产品吸收,大部分以原药的形式排入环境,造成养殖区及废水排放水域抗生素的残留,或通过吸附蓄积在周围沉积物中[8-10]。残留的抗生素可能会引起一系列危害,如对非靶生物的毒害、诱导产生耐药性菌株、威胁人类健康等[11-13]。
目前,对于长三角地区水产养殖中抗生素的污染特征研究相对较少。为此,建立一种能够对水产养殖环境中多种痕量抗生素有效分离富集和检测的方法,并研究水产养殖区抗生素的残留特征,对该地区残留抗生素的环境风险评估有着重要的意义。本研究对水产养殖水、沉积物中15种典型抗生素的前处理方法进行了优化,包括沉积物样品提取溶剂的选择、活化溶剂的选择和洗脱溶剂的选择;建立了15种抗生素的高效液相色谱串联质谱仪(HPLC-MS/MS)检测方法,包括色谱条件和质谱条件的确定。采用所建立的分析方法,对上海市不同水产品养殖区水及沉积物中15种典型抗生素的残留特征进行了研究。
1 材料与方法 (Materials and methods)
1.1 样品的采集与处理
选取上海市某水产养殖区作为研究区域,分别于2018年9月(秋季)和2018年12月(冬季)对该区域内的水产养殖塘进行采样。采集了该养殖区青鱼塘(QY1、QY2)、白水鱼塘(BSY)、草鱼塘(CY)、成蟹塘(CX)、扣蟹塘(KX)和虾塘(BDX),共7个养殖塘的水样及沉积物。水样用棕色玻璃瓶采集,加入适量盐酸抑制微生物活性,4 ℃冷藏待用;沉积物使用彼得逊采泥器采集后放入密封袋中,-20 ℃冷冻待用。
1.2 主要仪器与材料
液相色谱串联质谱仪(Waters Acquity HPLC®Hclass-Waters Xevo TQ-S micro,美国Waters公司)、全自动氮吹仪(AUTO-EVA,厦门睿科有限公司)、全自动固相萃取仪(Fotector Plus,厦门睿科有限公司)、低温真空冷冻干燥器(LDG-0.3C,上海昊博有限公司)、微波萃取仪(CEM MARS CLASSIC,美国CEM公司)、Oasis HLB固相萃取小柱(美国Waters公司)、0.7 μm玻璃纤维滤膜(GF/F,英国Whatman公司)、0.22 μm聚四氟乙烯针式滤头(上海安谱有限公司)。
15种抗生素标准品:纯度为99.22%的磺胺嘧啶(SD)、纯度为99.72%的磺胺甲基嘧啶(SM1)、纯度为99.47%的磺胺二甲基嘧啶(SM2)、纯度为99.47%的磺胺间二甲氧基嘧啶(SDM)、纯度为99.58%的磺胺甲恶唑(SMX)、纯度为99.1%的甲氧苄啶(TMP)、纯度为99.9%的恩诺沙星(ENR)、纯度为92.31%的环丙沙星盐酸盐(CIP)、纯度为97.29%的诺氟沙星(NOR)、纯度为98.89%的呋喃唑酮(AOZ)、纯度为94.6%的盐酸金霉素(CTC)、纯度为95.6%的盐酸土霉素(OTC)、纯度为98.7%的盐酸多西环素(DOX)、纯度为98%的阿莫西林(AMX)和纯度为97.89%的喹乙醇(OLA)购自德国Dr. Ehrenstorfer公司。用于定量的内标物:磺胺甲恶唑-13C6、甲氧苄啶-D3和四环素-D6购自德国Dr. Ehrenstorfer公司,诺氟沙星-D5、呋喃唑酮-D4购自德国Witega公司,喹乙醇-D4、阿莫西林-13C6购自英国Cambridge Isotope Laboratories公司。色谱级甲醇、乙腈、丙酮和甲酸购自德国Merck公司,色谱级甲基叔丁基醚购自国药集团化学有限公司。磷酸、柠檬酸、柠檬酸钠、无水磷酸二氢钠、乙二胺四乙酸二钠和十二水磷酸氢二钠为分析纯,购自上海睿捷化学试剂有限公司。
pH=5.0柠檬酸缓冲溶液的配制:取8.88 g柠檬酸和16.89 g柠檬酸钠,用超纯水定容至1 L。
磷酸盐缓冲溶液的配制:取23.90 g无水磷酸二氢钠和1.35 mL磷酸,用超纯水定容至1 L。
EDTA-Mcllvaine缓冲溶液的配制:取37.20 g乙二胺四乙酸二钠、27.50 g磷酸氢二钠和12.90 g柠檬酸,用超纯水定容至1 L,现配现用。
1.3 样品预处理方法的优化
抗生素污染样品的配制:沉积物样品冷冻干燥后,研磨并过100目筛网。称取2.00 g的沉积物样品于100 mL的烧杯中添加2 mL浓度为100 μg·L-1的抗生素混合标准溶液,使沉积物中抗生素的浓度为100 ng·g-1。加入100 ng的磺胺甲恶唑-13C6、诺氟沙星-D5、呋喃唑酮-D4、四环素-D6、喹乙醇-D4、阿莫西林-13C6和甲氧苄啶-D3内标物质,与沉积物样品充分混匀后,放在通风橱中干燥30 min。水样准确量取1 L于烧杯中,添加1 mL浓度为100 μg·L-1的抗生素混合标准溶液,使水样中抗生素的浓度为100 ng·L-1。添加上述8种内标物质,调节pH=3.0。过程中保证抗生素在样品中分布均匀,确保提取的准确性。
沉积物中抗生素的提取:将烧杯中的沉积物样品转移至微波萃取管中,加入50 mL的提取液(根据目标物和基质组成选择),进行微波萃取,萃取温度65 ℃,萃取时间30 min,萃取功率1 200 W。萃取结束后过滤,用蒸馏水稀释至500 mL,调节pH=3.0。
使用HLB固相萃取柱对目标抗生素富集净化。上样前,先活化固相萃取柱(活化溶剂根据目标物和基质组成选择);然后以5 mL·min-1的速度使样品通过萃取柱;上样结束后,依次用6 mL超纯水、6 mL 5%的甲醇-水溶液淋洗萃取柱;最后用10 mL洗脱液(根据目标物和基质组成选择)洗脱。
洗脱下来的溶液在35 ℃下氮气吹干,用体积浓度为70%的甲醇-水溶液定容至1 mL,经0.22 μm 聚四氟乙烯(PTFE)针式滤器过滤至棕色进样瓶中待测。
以上处理均做3次平行,同时设置不添加抗生素的水样及沉积物作为空白。
1.4 标准溶液的配制
准确称取10.00 mg抗生素标准品,用甲醇溶解配制成100 mg·L-1的抗生素标准液;诺氟沙星溶解在含0.8% 0.5 molL-1盐酸的甲醇中,-20 ℃避光冷藏保存。
1.5 检测条件的优化
用高效液相色谱串联质谱仪分析目标抗生素。色谱柱为BEH-C18柱(1.7 μm,2.1 mm×100 mm);色谱柱柱温35 ℃;进样量2 μL;流动相流速0.25 mL·min-1;流动相A是体积分数为0.5%的甲酸-水溶液;流动相B为乙腈;梯度洗脱程序:0~2.2 min,16% B;2.2~2.5 min,16% B~95% B;2.5~5.5 min,95% B;5.5~6.0 min,95% B~16% B;6.0~10.0 min,16% B。
质谱采用电喷雾离子源正离子模式(ESI+),三重四级杆质量分析器进行检测,扫描方式为多反应监测模式(MRM);碰撞气为高纯氩气;脱溶剂气温度为500 ℃,脱溶剂气流速度为1 000 L·h-1,锥孔电压为30 V,毛细管电压为3.5 kV,扫描时间为0.1 s。15种抗生素的质谱分析参数如表1所示。
1.6 质量控制与质量保障
目标抗生素采用内标法定量,配制一系列浓度范围在1.37~500.00 μg·L-1的混合标准工作液进行检测分析,得到各抗生素的标准曲线,相关系数大于0.993,检测限范围在0.003~1.230 ng·L-1(或ng·g-1)。
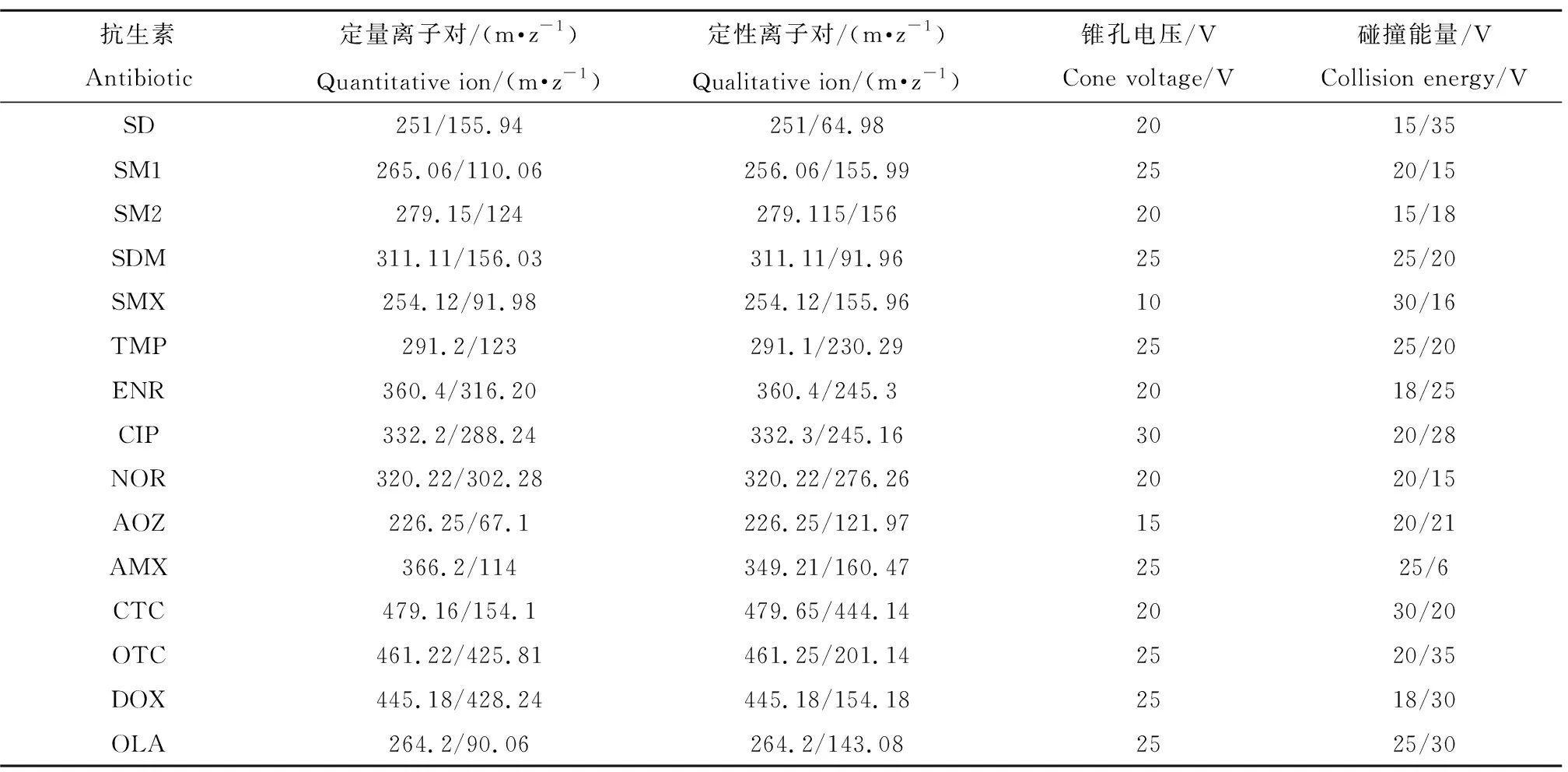
表1 15种抗生素的质谱检测条件Table 1 Mass spectrometric detection conditions for 15 antibiotics
注:SD表示磺胺嘧啶,SM1表示磺胺甲基嘧啶,SM2表示磺胺二甲基嘧啶,SDM表示磺胺间二甲氧基嘧啶,SMX表示磺胺甲恶唑,TMP表示甲氧苄啶,ENR表示恩诺沙星,CIP表示环丙沙星盐酸盐,NOR表示诺氟沙星,AOZ表示呋喃唑酮,AMX表示阿莫西林,CTC表示盐酸金霉素,OTC表示盐酸土霉素,DOX表示盐酸多西环素,OLA表示喹乙醇。
Note: SD stands for sulfadiazine; SM1 stands for sulfamerazine; SM2 stands for sulfamethazine; SDM stands for sulfadimethoxine; SMX stands for sulfamethoxazole; TMP stands for trimethoprim; ENR stands for enrofloxacin; CIP stands for ciprofloxacin; NOR stands for norfloxacin; AOZ stands for furazolidone; AMX stands for amoxicillin ; CTC stands for chlortetracycline; OTC stands for oxytetracycline; DOX stands for doxycycline; OLA stands for olaquindox.
以养殖区水样和沉积物为基底的加标回收率实验中,水样加标水平为100、200 ng·L-1,回收率范围为69.4%~118.5%;沉积物加标水平为50、100 ng·g-1,回收率范围为69.7%~109.4%;相对标准偏差均低于10%。
2 结果与讨论(Results and discussion)
2.1 分析方法的优化
2.1.1 提取液的选择
采用微波萃取法提取沉积物中的抗生素,相比于目前常用的超声波萃取法,微波萃取是一种内加热,具有均匀性,样品和溶剂可在短时间内升高到一定温度,强化萃取效率[14]。提取液的选择要根据目标物质的理化性质及基质组成决定。参考相关文献[15-18],选择了5种沉积物中抗生素的提取液分别为甲醇/磷酸盐缓冲溶液(V∶V=1∶1)、乙腈/磷酸盐缓冲溶液(V∶V=1∶1)、丙酮/磷酸盐缓冲溶液(V∶V=1∶1)、乙腈/柠檬酸缓冲溶液(V∶V=1∶1)、乙腈/EDTA-Mcllvaine缓冲溶液(V∶V=1∶1),测得沉积物中15种抗生素的加标回收率,如图1所示。乙腈/柠檬酸缓冲溶液(V∶V=1∶1)作为提取液时,氟喹诺酮类、四环素类抗生素和喹乙醇的回收率均在5%以下;乙腈/EDTA-Mcllvaine缓冲溶液(V∶V=1∶1)作为提取液时,不能有效提取氟喹诺酮类抗生素和喹乙醇。不同有机溶剂与磷酸盐缓冲液体积比1∶1混合时,甲醇/磷酸盐缓冲溶液(V∶V=1∶1)对氟喹诺酮类抗生素和呋喃唑酮的回收率小于50%,对四环素有较高的回收率,为108%~118.9%;乙腈/磷酸盐缓冲溶液(V∶V=1∶1)和丙酮/磷酸盐缓冲溶液(V∶V=1∶1)对15种抗生素的回收率均在60%以上。综合考察各物质的回收水平,选择乙腈/磷酸盐缓冲溶液(V∶V=1∶1)作为沉积物中抗生素的提取液。
2.1.2 HLB活化溶剂的选择
活化的目的是去除固相萃取柱中的杂质并创造一定的溶剂环境。有研究显示,采用不同溶剂组合活化固相萃取柱,对目标物质的回收率有影响[19-20]。选择依次用甲醇、超纯水活化HLB固相萃取柱和依次用甲基叔丁基醚、甲醇、超纯水活化HLB固相萃取柱,测得15种抗生素的加标回收率,如图2所示。由甲醇、超纯水活化的固相萃取柱回收率为62.3%~142.8%;甲基叔丁基醚、甲醇和超纯水活化的固相萃取柱回收率为68.7%~116.4%。后者平均回收率更高且提取率稳定。本研究选择依次用甲基叔丁基醚、甲醇和超纯水活化HLB固相萃取柱。

图1 5种不同提取溶剂对15种抗生素的加标回收率Fig. 1 Recovery rates of 15 antibiotics with 5 different extraction solvents
2.1.3 洗脱液的选择
HLB固相萃取柱是一种亲水-亲脂性聚合物填料柱,容易吸附沉积物中的腐殖酸[21]。本研究选择3种不同极性的洗脱溶剂(甲醇、乙腈和乙酸乙酯),考察3种洗脱溶剂对目标抗生素的回收率,测得15种抗生素的加标回收率,如图3所示。甲醇作为洗脱溶剂时回收率为62.1%~118.5%;乙腈作为洗脱溶剂时回收率为40.6%~167.8%;乙酸乙酯作为洗脱溶剂时,几乎对阿莫西林、呋喃唑酮、甲氧苄啶、喹乙醇、环丙沙星和诺氟沙星无洗脱能力,其他抗生素的回收率为63.0%~240.0%,回收率不稳定。综上,选择甲醇作为本研究的洗脱溶剂。
2.2 典型水产养殖区水体和沉积物中抗生素的残留水平
基于上述优化的预处理方法,调查了上海市7个水产养殖区2018年9月和2018年12月抗生素的残留水平。表2展示了15种抗生素在上海市水产养殖区水和沉积物中的含量水平。结果显示,2个月份中15种抗生素除磺胺甲基嘧啶外均有检出,包括4种磺胺类(磺胺嘧啶、磺胺二甲基嘧啶、磺胺间二甲氧嘧啶和磺胺甲恶唑)、3种氟喹诺酮类(环丙沙星、诺氟沙星和恩诺沙星)、3种四环素类(金霉素、土霉素和多西环素)、甲氧苄啶、阿莫西林、呋喃唑酮和喹乙醇,说明该区域水产养殖中有大量抗生素使用。水中共检测到10种抗生素,抗生素残留浓度中间值的顺序为:磺胺类>甲氧苄啶>阿莫西林>氟喹诺酮类>喹乙醇>四环素类和呋喃唑酮。分析结果与渤海湾养殖区的类似[22]。
沉积物中共检测出13种抗生素,抗生素的残留浓度中间值的顺序为:氟喹诺酮类>四环素类>磺胺类>甲氧苄啶>喹乙醇>阿莫西林和呋喃唑酮。分析结果与新疆博斯腾湖水体及沉积物中不同抗生素的分布情况类似[23]。不同种类抗生素的检出浓度各有差异,这与它们的应用方式和环境行为有关[24]。水和沉积物中抗生素的含量分布也存在差异,可能与它们在水和沉积物中的分配行为有关。
磺胺类药物逐渐被β-内酰胺类和大环内酯类药物所取代,但由于其价格低廉仍然用于畜禽和水产养殖中,常与增效剂甲氧苄啶同时使用[25]。性质上,磺胺类是亲水性化合物,吸附系数较小且不易降解。这可能是水中磺胺类抗生素及甲氧苄啶残留浓度大于其他抗生素的原因。氟喹诺酮类抗生素是水产养殖中应用最广的抗生素之一,对革兰氏阴性菌具有较强的抗菌活性[26]。它们易发生光解、易吸附在固相物质上。这可能是氟喹诺酮类抗生素在水中浓度低的原因。本研究氟喹诺酮类抗生素在沉积物中浓度较高,其中,恩诺沙星最高浓度达到μg·g-1级别,反映了当地水产养殖业恩诺沙星较高的使用量。四环素类抗生素是广谱抗菌素,广泛用于动物疾病的预防与治疗[27]。四环素类抗生素降解半衰期长,吸附系数大。本研究沉积物中四环素类抗生素浓度仅次于氟喹诺酮类,但浓度相差了1~2个数量级,表明四环素类抗生素在该地区水产养殖业中的使用量较低。喹乙醇曾经被广泛用于兽药和饲料添加剂中,由于喹乙醇具有中度至明显的蓄积毒性,《中国兽药典》(2005版)规定禁止水产养殖中使用喹乙醇。但本研究养殖水体中喹乙醇检出率高且有较高的检出浓度[28]。此外,人用抗生素环丙沙星、呋喃唑酮在2002年农业部第193号公告中被列入食品动物禁用药物,但本研究中均有检出。沉积物中环丙沙星检出率大于80%,水中呋喃唑酮检出率小于30%。长期使用可能在人类用药时产生严重的细菌耐药性[29]。

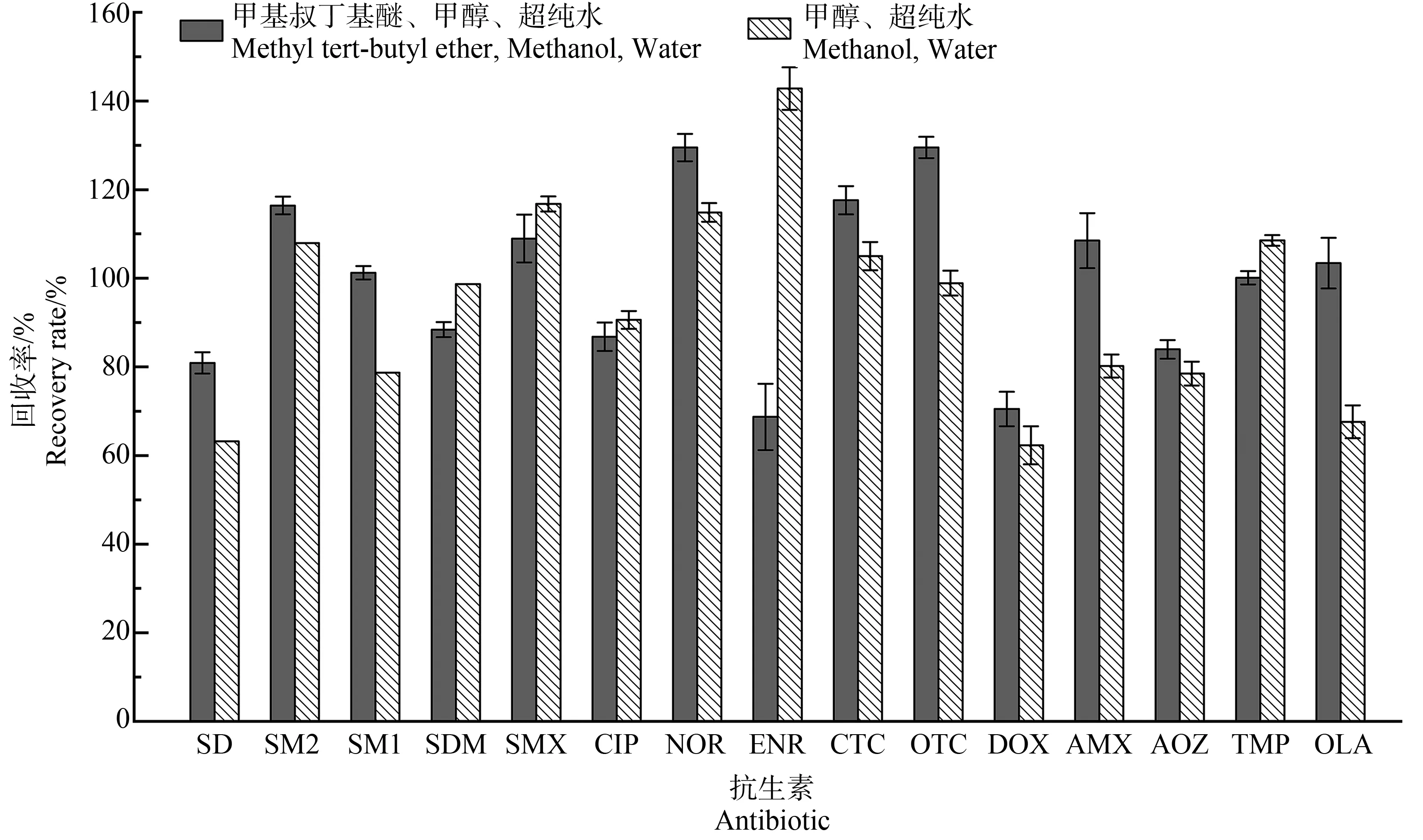
图2 2种活化方法对15种抗生素的加标回收率Fig. 2 Recovery rates of 15 antibiotics with 2 activation methods

图3 3种不同洗脱溶剂对15种抗生素的加标回收率Fig. 3 Recovery rates of 15 antibiotics with 3 different elution solvents
与其他水产养殖区的研究比较,抗生素的检测种类、数量相近。本研究同时检测到一部分禁用药物,推测仍然存在禁用药物违法使用现象。Zou等[22]在渤海湾鱼塘水体中检测到19~54 ng·L-1的磺胺类抗生素,诺氟沙星和环丙沙星平均水平在几百ng·L-1,磺胺类抗生素含量高于本实验结果,喹诺酮类抗生素含量与本实验结果相近。丁惠君等[30]在环鄱阳湖水产养殖区检测到最高含量水平为162.68 ng·L-1的金霉素、298.51 ng·L-1的磺胺甲恶唑、96.55 ng·L-1的恩诺沙星和27.44 ng·L-1的诺氟沙星,远高于本实验结果。梁惜梅等[31]在珠江口养殖区水体检测到几到几十ng·L-1的氟喹诺酮类抗生素和四环素,未检出磺胺类抗生素,与本实验结果相近。本实验水体抗生素污染水平低于畜禽场排出废水[32],低于白洋淀湖[33](除甲氧苄啶外)、太湖[34]、海河[17]、黄浦江[35],与美国肖邦河[36]浓度水平相近,高于芬兰万塔河[37]、中国北部湾[38]。
聂湘平等[39]在珠江三角洲淡水养殖区沉积物中检测了诺氟沙星、环丙沙星和恩诺沙星,检出范围分别为5.03~13.28、3.64~9.32和0~7.13 ng·g-1。Gao等[40]在海河水产养殖区沉积物中检测到诺氟沙星浓度最高,为166.0 ng·g-1,其他检出抗生素浓度水平在几到几十ng·g-1。Chen等[41]分析了广州市番禺区水产养殖区沉积物中磺胺类、氟喹诺酮类、四环素类和甲氧苄啶等抗生素的污染水平,氟喹诺酮类抗生素总质量分数为312 ng·g-1,其他抗生素未检出或在几ng·g-1的水平。与上述水产养殖区相比,本实验沉积物中氟喹诺酮类抗生素污染程度较高,部分养殖区含量约高于上述养殖区1~2个数量级,其他抗生素污染程度类似。
2.3 典型水产养殖区抗生素的分布特征
上海市不同水产养殖区(包括4个鱼塘、2个蟹塘和1个虾塘)2018年9月和2018年12月中15种抗生素的分布特征如图4所示。不同品种养殖塘中抗生素的检出种类和检出浓度都不相同,这可能与产品特征及用药习惯有关。5种抗生素在所有鱼塘都有检出(磺胺间二甲氧嘧啶、恩诺沙星、环丙沙星、盐酸多西环素和甲氧苄啶)。青鱼和白水鱼塘中抗生素检出种类最多,各10种。虾塘也有9种抗生素被检出。扣蟹塘抗生素检出种类最少,仅5种。分析9月份各养殖塘抗生素的检出水平,青鱼塘和白水鱼塘沉积物中恩诺沙星污染水平远高于其他养殖塘,浓度达到μg·g-1级别,青鱼塘检出浓度最高,为1 279.70 ng·g-1。环丙沙星在青鱼塘沉积物中检出浓度最高,为147.56 ng·g-1。诺氟沙星在白水鱼塘沉积物中检出浓度最高,为42.94 ng·g-1。综上,氟喹诺酮类抗生素在鱼类养殖中使用量较大,虾塘和蟹塘中使用量较少。磺胺类抗生素在各类养殖塘水中检出水平较平均,范围在几到十几ng·L-1,其中,磺胺甲恶唑仅在蟹塘被检出。鱼类养殖塘水体中甲氧苄啶检出水平为16.40~30.42 ng·L-1,略高于虾塘、蟹塘。喹乙醇在虾塘水体检出浓度达到3 612.85 ng·L-1,其他养殖水体检出浓度仅几ng·L-1,可能当时喹乙醇刚被投加入虾塘水体中。有研究显示,用30~150 mg·kg-1添加量饲喂,成虾平均增重率提高15%~20%,喹乙醇有明显的促生长作用,这使其仍广泛用于水产养殖[42]。表层水体中的喹乙醇易光解、易生物降解,这可能是其他养殖塘喹乙醇检出水平低的原因[43]。9月份与12月份抗生素的检出量也有差别,抗生素在9月份的含量水平均比12月份高。磺胺二甲基嘧啶、磺胺间二甲氧嘧啶、磺胺甲恶唑和甲氧苄啶在12月份水体中检出水平明显降低,可能期间停止了使用该药。12月份虾塘水体中磺胺嘧啶检出水平升高,说明虾塘仍处于养殖期。阿莫西林和呋喃唑酮在水体中的检出浓度提高,可能期间对该药物进行了投加。较9月份相比,12月份沉积物中氟喹诺酮类抗生素含量明显减少。水-沉积物体系中抗生素是动态平衡的,这与水体和沉积物的基质组成和理化性质有关[44-45]。养殖塘换水使沉积物中的抗生素重新释放到水体中,或抗生素通过直接或间接排水进入周围环境,或抗生素在沉积物中经过纵向迁移至底层。
综上所述:
(1)在微波萃取-固相萃取-高效液相色谱质谱联用技术基础上,选用乙腈/磷酸盐缓冲溶液(V∶V=1∶1)作为提取液,依次用甲基叔丁基醚、甲醇和超纯水活化HLB小柱,甲醇作为洗脱溶剂时15种目标抗生素回收率最高。

图4 不同月份各水产养殖区水、沉积物中抗生素的分布特征注:QY1、QY2为青鱼塘采样点,BSY为白水鱼塘采样点,CY为草鱼塘采样点,CX为成蟹塘采样点,KX为扣蟹塘采样点,BDX为虾塘采样点。Fig. 4 Distribution characteristics of antibiotics in water and sediments in different aquaculture areas in different monthsNote: QY1, QY2 are the sampling points of Mylopharyngodon piceus ponds; BSY is the sampling point of Erythroculter ilishaeformis pond; CY is the sampling point of Ctenopharyngodon idellus pond; CX is the sampling point of Eriocheir sinensis H. Milne-Edwards pond; KX is the sampling point of Eriocheir sinensis H. Milne-Edwards pond; BDX is the sampling point of Penaeus vannamei pond.
(2)不同种类抗生素的检出浓度各有差异,可能与它们的应用方式和环境行为有关;水和沉积物中抗生素的含量分布也存在差异,可能与它们在水和沉积物中的分配行为有关。
(3)不同品种养殖塘中抗生素的检出种类和检出浓度都不相同,可能与产品特征及用药习惯有关;抗生素含量在不同月份也存在差异,可能是养殖时间、排水换水和一系列环境因素引起的。
致谢:本研究由国家水体污染控制与治理科技重大专项(2017ZX07207002);上海市2016年度“科技创新行动计划”社会发展领域项目(16DZ1204700);长江水环境教育部重点实验室开放课题资助项目(YRWEF201803)的支持下完成。

