人参皂苷的乙醇溶出性能及分布特征研究
侯明韬,李潇然,曹 芮,迟乃超
(1.中国建筑材料科学研究总院,北京100024;2.中国建材检验认证集团股份有限公司,北京100024;3.北京中医药大学东直门医院,北京100700)
人参素有“百草之王”的称号,其具有多种药理功能,在我国中医的使用中已有悠久历史。人参皂苷是人参中的主要有效成分,其包含原人参二醇(PPD)类、原人参三醇(PPT)类、齐墩果酸(OA)类及其他型皂苷[1]。由于不同来源的人参中皂苷含量有所差异,因此其含量成为人参品质的重要评价指标。目前,人参中皂苷的检测方法主要包括比色法、紫外分光光度法、薄层色谱法、液相色谱法、液相色谱-串接质谱法等[2~6]。此外,使用液相色谱-四级杆-飞行时间串联质谱、超高效液相色谱-三重四级杆-线性离子阱等高端质谱仪检测人参及其制品中的皂苷含量也已经被使用[7~10]。
值得注意的是,人参的前处理方式对人参皂苷的测定亦有较大影响。目前,通过粉碎样品后,使用超声萃取、索氏提取及加压流体萃取人参样品中皂苷是其检测的主要前处理方式[2,11,12],其提取效率高,为人参品质的鉴别提供了重要支持。但是,此类前处理方法对样品的破坏性大,且提取利用的有机溶剂(三氯甲烷、甲醇、正丁醇、石油醚等)[3,7,11,13]皆不是食品行业适宜使用的有机物,导致其提取效率虽高,但测定结果不能真实反馈人参中的皂苷在医药食品行业的实际提取及利用效率。
目前,人参的利用方式主要包括整支入药煎服及制备各类保健制品,其中人参泡酒是人参利用的重要方式之一,其具有保健功效,可辅助治疗各类疾病,且制备方式简单。家庭制备人参酒主要通过静态浸泡,在常温常压下,利用白酒中的乙醇溶解人参中的皂苷。但是,此方法制备人参酒通常需要较长的时间,且采购高品质的人参需要较高的价格,限值了其推广程度。
在已有的研究中,证明人参叶及花中同样存在高含量的人参皂苷[1,11,14],如使用其进行药酒的制备,可减少人参酒的制备成本。但是,目前针对人参各部位皂苷在乙醇中溶出特性的系统研究较少[12,15~17]。本研究中,模拟人参酒的制备条件,在常温常压下考察人参叶、花及根中皂苷的乙醇溶出特性,并分析人参各部位皂苷的分布规律,为人参酒的制备及利用提供支持。
1 实验材料及仪器
1.1 实验材料
购置不同来源及产地经过风干后的人参叶、花及根(根:1~5 年,切片 1~2 mm)编号;采集市售不同来源的人参药酒并编号;人参皂苷标准品Rg1(99.4%,批号:Z6140050)、Re (100%,批号:Y9070100)、Rb1(99.3%, 批号:Y4250050)、Rc (98.5%, 批号:12360025)、Rb2 (98.5%, 批号:Z9980025)、Rd(100%,批号:R7880050)均购置于上海安普实验科技股份有限公司;无水乙醇(国药集团化学试剂有限公司,分析纯);乙腈(Fisher,色谱纯);实验用水为 Milli-Q 超纯水系统制备。
1.2 实验设备
岛津LC 20AT高效液相色谱(二元梯度淋洗,紫外检测器);梅特勒ME204E电子天平;梅特勒MS105DU电子天平。
2 实验方法
2.1 色谱条件
色谱柱:岛津 InertSustain C18色谱柱(5μm,4.6×150mm);流动相为乙腈-水溶液,梯度淋洗程序:0~10 min,10% 乙腈→22% 乙腈;10~16 min,22%乙腈;16~30 min,22% 乙腈→60% 乙腈;30~35 min,60%乙腈→100% 乙腈;35~40 min,100%乙腈;40~42 min,100%乙腈→10% 乙腈;42~55 min,10% 乙腈;流动相流速为1.2 mL/min,柱温20°C,检测器波长203 nm,进样量为20 μL;该条件下标准品分离效果良好,色谱图见图1。

图1 混合标准品色谱图Figure 1 Chromatogram of mixed standard solution
2.2 标准溶液配制
使用十万分之一电子天平精确称取Rg1 4.87 mg,Re 5.04 mg,Rb1 4.62 mg,Rc 5.21 mg,Rb2 5.01 mg,Rd 5.32 mg于50 mL容量瓶中,使用甲醇溶解后定容,得到浓度分别为 97.4,100.8,92.4,104.2,100.2,106.4 mg/L标准储备液。将此溶液稀释后,配制标准系列溶液制作标准曲线,各组分经液相色谱法测定,使用峰面积为纵坐标,浓度为横坐标制作标准曲线(Rg1:y=7084.65 x- 1762.47,R2=0.9999;Re=5799.64 x- 406.33,R2=0.9998;Rb1:y=4511.55 x- 59.7726,R2=0.9999;Rc:y=4858.59 x-152.457,R2=0.9999;Rb2:y=5487.10 x- 274.332,R2=0.9999;Rd:y=5974.40 x+265.557,R2=0.9998)。
2.3 样品浸泡
使用乙醇与水按一定比例混合,配制样品浸泡溶液,取200 mL倒入250 mL磨砂广口瓶中。取完整干净实验材料(人参叶、花及根),用天平称取一定质量后,小心的放入装有浸泡溶液的广口瓶中,轻轻震摇广口瓶,使实验样品全部浸泡于浸泡液中,将广口瓶盖紧,于室温下(25±2°C)避光处保存。
2.4 样品测试
使用1 mL一次性灭菌注射器吸取浸泡液样品,经过0.22 μm有机相过滤膜过滤后,使用液相色谱测定上述六种皂苷浓度,并以其和计算总皂苷含量。风干的人参叶、花及根中皂苷含量计算公式如下:

其中,ρ— 样品中皂苷含量,g/kg;
c—浸泡溶液中皂苷测试浓度,mg/L;
有了和小阿布的亲情后,甲洛洛更关注登子,可对登子几乎没什么跟踪价值,他每天早上六点起床就开始在门口一间用几张木板搭的小房子里叮叮当当地敲打着做一些割草的镰刀,拴狗的链子,挖地的锄头。而且一整天除了吃一坨糌粑,上、下午在院坝的一个角落里去撒尿外,不去任何地方。三五天有个人找上门去买一些这些东西,但大多是用糌粑换的,而且他从来不给人家讨价还价。
v—浸泡液体积,L;
m—样品质量,g;
n—测试溶液稀释倍数。
3 结果与讨论
3.1 乙醇含量对皂苷溶出性能的影响
实验考察不同乙醇含量对人参叶、花及根中人参皂苷溶出性能的影响。实验分别在乙醇-水含量(v/v%)为0~100%的范围内进行,详见图2。如图所示,乙醇含量对人参不同部位皂苷的溶出量有明显影响,使用纯水做浸泡液浸泡人参叶、花及根时,均可获得较好的皂苷溶出效果(叶:623 mg/L,花:674 mg/L,根:51.5 mg/L),但随乙醇浓度的提高,人参叶与花的浸泡液中总皂苷溶出量降低(其规律与Rg1及Re相关性较大),最低值均出现在乙醇含量为10%的实验组。之后,随乙醇含量的继续提高,人参叶、花中的皂苷溶出含量逐渐提高,但当乙醇含量达到100%时,测试的6种皂苷含量均出现断崖上下跌,实验范围内,人参叶、花及根的100%乙醇浸泡液中的总皂苷含量均为实验范围内最低,相似的结论在文献中亦有报道[12,16,18],证明过高的乙醇含量不利于皂苷的溶出。
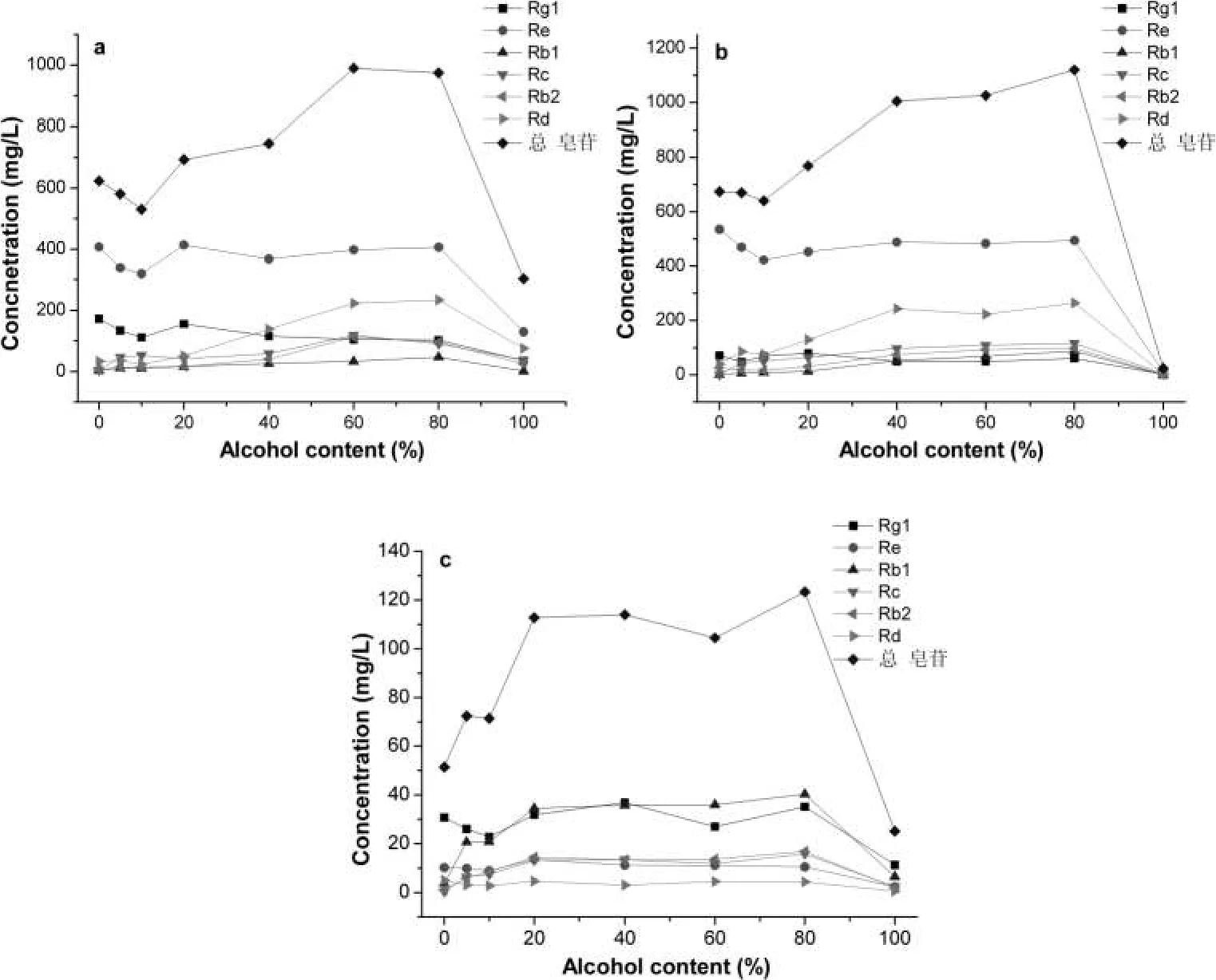
图2 乙醇含量对a)人参叶,b)人参花,c)人参根中皂苷溶出性能的影响,实验条件:固液比(m/v)=1/100,乙醇含量=0-100%,人参叶浸泡时间=20 d,人参花浸泡时间=20 d,人参根浸泡时间=30 dFigure 2 Effect of alcohol content on the dissolution performance of ginsenoside in a)ginseng leaf,b)ginseng flower and c)ginseng root,experimental condition:solid-liquid ratio=1/100,alcohol content=0- 100%,soaking time of ginseng leaf=20 d,soaking time of ginseng flower=30 d,soaking time of ginseng root=30 d
此外,由实验结果可知,人参叶、花及根的最大总皂苷溶出含量出现在乙醇含量为60~80%的范围内,由此可见,使用较高含量乙醇的白酒作为人参酒的浸泡溶液较适合提高液相的皂苷含量。虽然乙醇含量为80%的浸泡溶液可以获得最高的皂苷溶出结果,但高浓度乙醇含量的白酒不便被消费者接受。在我国,53~58°白酒为市面上较易获得的品种,其乙醇含量适宜,较易被广大消费者接受,适合家庭人参泡酒使用。因此后续实验均选择乙醇含量60%做浸泡液进行。
3.2 浸泡时间对皂苷溶出性能的影响
实验分别考察人参叶、花及根中皂苷的溶出量与浸泡时间之间的关系。由图3可知,人参不同部位的皂苷溶出速度有明显区别:人参叶片浸泡液中的皂苷含量在浸泡5天时达到稳定;人参花浸泡液中的皂苷在浸泡10天时达到稳定;人参根则需要浸泡30天后,浸泡液中的皂苷才可以达到稳定,这可能是人参叶、花较易被浸泡液渗透的缘故。由此可见,选择人参叶片及花作为浸泡药酒的材料,可以节约浸泡时间,提高生产效率。
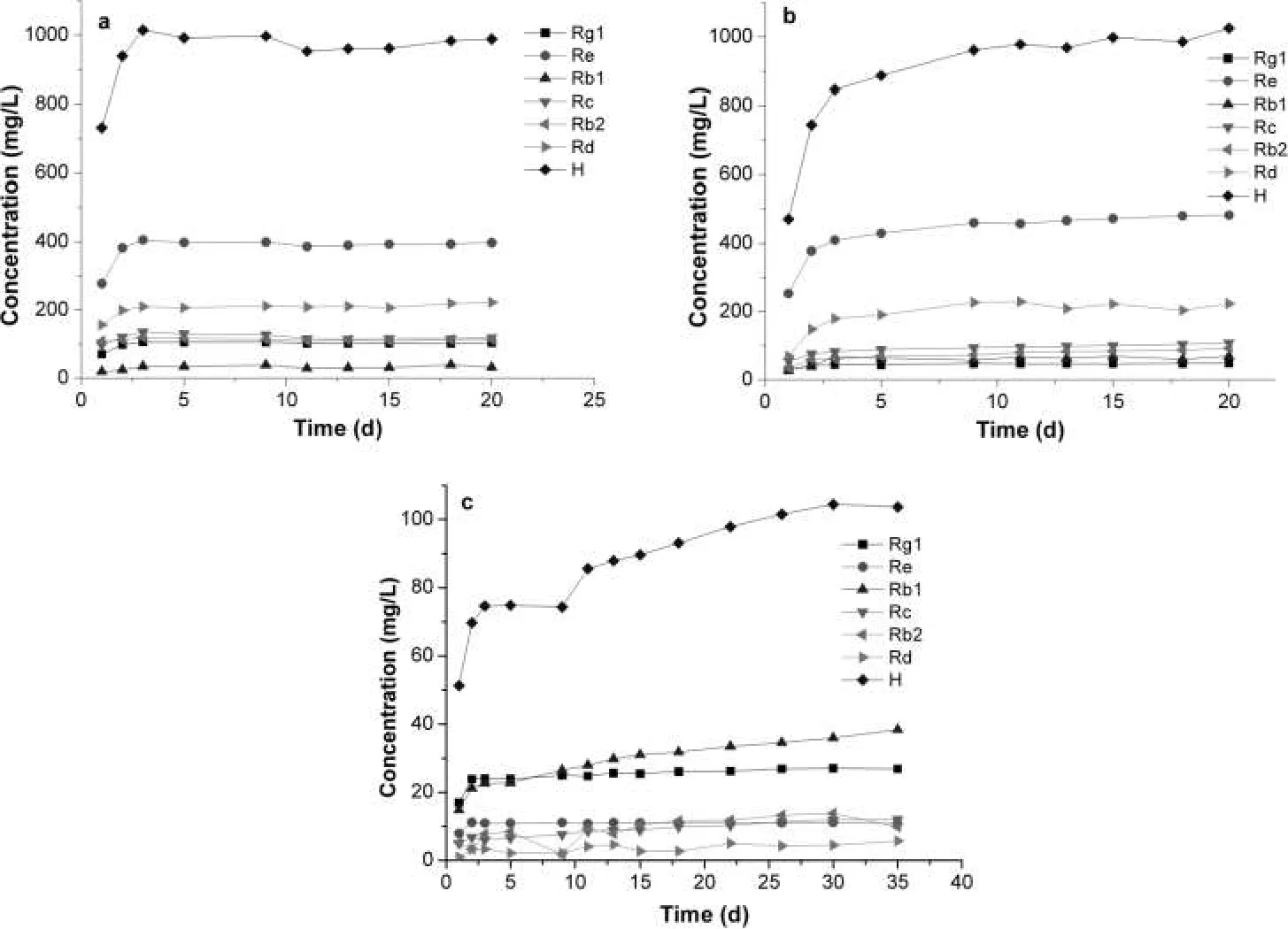
图3 浸泡时间对a)人参叶,b)人参花,c)人参根中皂苷溶出性能的影响,实验条件:固液比=1/100,乙醇含量=60%,浸泡时间=20~30 dFigure 3 Effect of soaking time on the dissolution performance of ginsenoside in a)ginseng leaf,b)ginseng flower and c)ginseng root,experimental condition:solid-liquid ratio=1/100,alcohol content=60%,soaking time=20~30 d
3.3 固液比对皂苷浸出性能的影响
实验分别在广口瓶中加入不同质量的实验样品,考察浸泡实验下的最佳固液比。本研究中,考虑到广口瓶的最大实验样品容纳能力,分别在固液比(m/v%)为 0.125%~1.5%、0.5%~5%、0.5%~7%的范围内考察人参叶、花及根的皂苷溶出效果。经过30 d时间浸泡后发现,详见图4,在60%的乙醇中,浸泡液中的总皂苷含量与固液比间有较好的线性关系 (R>0.994),证明固液比的增加不会影响人参各部位的皂苷溶出能力,因此在人参药酒的制备过程中,可以通过提高浸泡材料的固液比,获得皂苷含量较高的药酒。

图4 固液比对a)人参叶,b)人参花,c)人参根中皂苷溶出性能的影响;实验条件:乙醇含量=60%,浸泡时间=30 d;固液比 m/v:人参叶0.125~1.5%,人参花0.5~5%,人参切片0.5~7%Figure 4 Effect of solid-liquid ratio on the dissolution performance of ginsenoside in a)ginseng leaf,b)ginseng flower and c)ginseng root,experimental condition:alcohol content=60%,soaking time=30 d,solid-liquid ratio:ginseng leaf 0.125~1.5%,ginseng flower 0.5~5%,ginseng root 0.5~7%
3.4 人参皂苷的分布特性
研究收集19种人参叶、花及根样品,考察浸泡条件下人参不同部位皂苷的溶出分布规律。由图5可知,人参不同部位的皂苷含量及比例存在一定差异(结果以样品中含量计算,g/kg)。例如,人参叶中的Rg1显著高于人参花及根中的含量;人参叶与花中的Re、Rc、Rb2及Rd含量显著高于人参根中的含量,导致人参叶及花中的总皂苷含量(114 g/kg与119 g/kg)显著高于人参根中的总皂苷含量(12.3 g/kg)。

图5 人参各部位皂苷含量分布;实验条件:浸泡时间=30d,乙醇含量=60%,固液比m/v=1/100Figure 5 Distribution content of ginsenoside in various part of ginseng,experimental condition:alcohol content=60%,soaking time=30 d,solid-liquid ratio=1/100
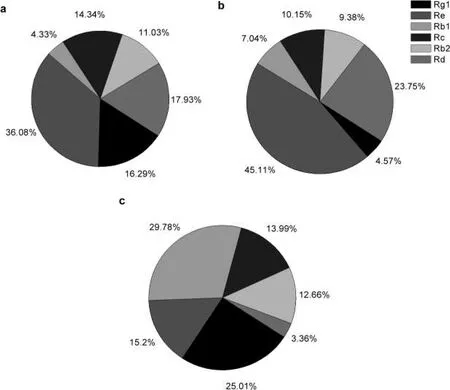
图6 人参各部位皂苷含量分布比例;实验条件:浸泡时间=30d,乙醇含量=60%,固液比m/v=1/100Fig.6 Distribution ratio of ginsenoside in various parts of ginseng,experimental condition:alcohol content=60%,soaking time=30 d,solid-liquid ratio=1/100
此外,人参不同部位的各种皂苷含量比例也存在区别(图6)。例如,在人参叶片及人参根中,Rg1平均含量占比达到16.29%~25.01%,而在人参花中仅为4.57%;人参叶及人参花中的Rb1平均含量仅为4.33%~7.04%,而其在人参根中占29.78%;人参叶及花中的Rd为17.93%~23.75%,但在人参根中Rd含量仅为3.36%。

图7 六种人参皂苷的PCA分析双标Fig.7 Bioplot of PCA based on 6 gnsenosides
为进一步验证人参皂苷的分布规律与人参部位的关系,使用PCA双标图对测定数据进行分析(CANOCO 5.0,图7)。如图所示,主成分1和2共解释了总变量的98.32%,证明其保留了原始数据中大部分的信息量。不同采样部位在PCA图中呈明显分离,表明皂苷含量在这三个部位的差异性较大。其中,根与主成分1表现出极度正相关性,而花与主成分2表现出极度正相关性。PCA双标分析图中,Rg1属性箭头指向叶片,Rb1属性箭头指向人参花,证明此两者在区分皂苷来源上起到重要作用,上述结果在皂苷含量分布规律上亦有体现(图5-6),皂苷在人参不同部位含量差异的机理值得研究。由于不同种类人参皂苷的医药功效存在区别(表1),选择含有适宜皂苷含量较多的人参部位有利于提高人参的利用效果。

表1 不同人参皂苷功能Table 1 Medical function of various ginsenosides
3.5 实际人参酒样品的测定
实验收集了不同来源的16个人参药酒样品 (人参根浸泡),对其中的皂苷成分进行分析。结果见表2。可以发现,测试样品中的总皂苷含量处于71.3~1140 mg/L之间,平均值为359 mg/L,实验样品中皂苷含量存在差异,这可能与泡酒使用的人参质量有关。实验测试的样品中,最大总皂苷含量(S2,1140 mg/L)与上述人参叶片及花于60%乙醇浸泡液浸泡后得到的总皂苷含量相似 (人参叶:1008~1290 mg/L,人参花:1022~1382 mg/L), 然而实验采购的人参叶(50 RMB/500g~100 RMB/500g)及花(100 RMB/500g~200 RMB/500g)相较于人参根(150 RMB/500g~600 RMB/500g,<5年)更加廉价,因此人参叶及花或许可以作为廉价材料,代替人参炮制药酒。
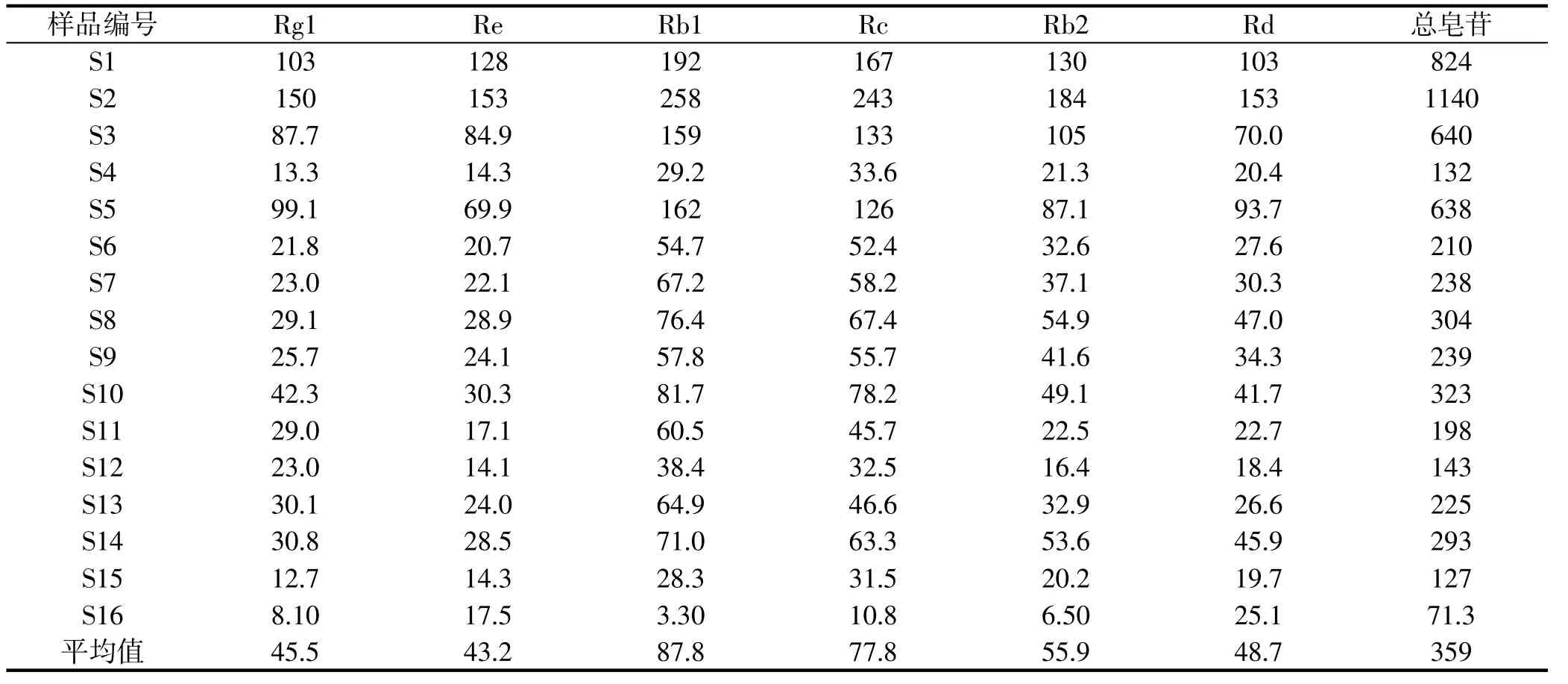
表2 药酒样品皂苷含量分析,mg/LTable 2 Ginsenoside content in liquor samples,mg/L
4 结论
研究优化了人参各部位在乙醇-水溶液中的浸泡条件,提高了人参皂苷的溶出能力。人参各部位的皂苷含量存在一定差异,且人参叶及花中皂苷的平均含量显著高于人参根中的皂苷含量,通过合理使用人参叶、花,可以提高人参酒中皂苷的成分,达到提高药酒质量的作用,其或许可以成为人参酒制备行业的发展方向。

