新型冠状病毒肺炎患者的临床特点及肺部CT变化模式
刘松,谢红,余成新,聂陈
自2019年12月以来,湖北省武汉市陆续发现了多例新型冠状病毒肺炎患者,随着疫情的蔓延,中国其它地区及境外100多个国家也相继发现了此类病例。2020年2月11日WHO将新型冠状病毒肺炎命名为COVID-19[1],同一天国际病毒分类委员会(International Committee on Virus Taxonomy,ICTV)提议根据生物遗传学分析,将此次的新型冠状病毒命名为严重急性呼吸综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)[2]。影像学检查尤其是HRCT对于评估新型冠状病毒肺炎患者肺部改变具有重要作用,是诊断COVID-19的重要检查手段。笔者回顾性分析72例患者住院期间的病历资料,总结肺部CT动态变化模式,对于全面了解COVID-19的疾病转归过程及指导治疗有重要意义。
材料与方法
1.资料收集
根据国家卫健委发布的新型冠状病毒肺炎诊疗方案(试行第六版)[3],搜集72例经PCR病毒核酸检测确诊为COVID-19患者于2020年1月26-2月27日在本院隔离治疗期间的病历资料,分析患者的流行病学、临床症状、检验结果、影像资料、用药信息及治疗过程。
2.CT扫描
使用Siemens Somatom Definition FLASH 16排CT机。检查前训练患者屏气,于吸气末期采集CT图像。扫描范围自肺尖至肺底,扫描参数:130 kV,100 mAs,层厚1.5 mm,间隔1.5 mm,骨算法重建。观察图像的窗位设置为-500 HU,窗宽为1500 HU。
3.CT图像分析
将肺部CT按解剖部位划分为5个肺叶,根据病变在每个肺叶中的累及范围,采用6级评分法[4-5]。0分:无累及;1分:病变累及范围<10%;2分:病变累及范围11%~25%;3分:病变累及范围26%~49%;4分:病变累及范围50%~75%;5分:病变累及范围>75%。CT总得分是各个肺叶得分的总和,取值范围为0~25。
肺内病变分布分为3类。①胸膜下:主要累及肺的外周三分之一;②随机分布:胸膜下和中央区域都有;③弥慢性:累及范围广泛,不局限于肺段。
肺内病变的主要征象记录为:①磨玻璃影(ground glass opacity,GGO);②混合GGO;③实变;④混合实变纤维;⑤纤维条索影;⑥其它影像[6-8]。并记录典型的特殊征象如铺路石征、小支气管空气征、晕征、反晕征和白肺等。
所有肺部影像评估均由2位副主任医师及以上职称的放射科医师共同判定。
4.统计分析
使用SPSS 26.0统计软件对所有数据进行统计学分析。对于正态分布的计量资料采用均值±标准差表示,分类变量采用例数n(构成比,%)表示。历次检查中5个肺叶受累例数差异的比较采用卡方检验,5个肺叶受累范围评分差异的比较采用Kruskal-Wallis检验和Mann-WhitneyU检验。以P<0.05为差异有统计学意义。
结 果
1.患者的一般临床资料
本研究中72例COVID-19患者的基本临床资料见表1。本研究中老年患者(>65岁)较多(29例),既往病史中患有高血压(24%)和糖尿病(22%)病史者较多见。另外,本组中有2例产妇(在感染之后行剖宫产手术)。最常见的症状是发热(71%)和咳嗽(43%)。38例(53%)患者有武汉旅居史或新冠肺炎患者密切接触史,其中12例为家庭聚集感染。

表2 各次CT检查中各个肺叶受累范围的CT评分
注:*为发病至首次CT检查时间。

表3 所有肺部CT检查中5个肺叶受累情况和受累范围评分
注:#历次检查中5个肺叶受累例数差异的比较采用卡方检验。*5个肺叶受累范围评分的差异比较采用Kruskal-Wallis检验。
2.首次实验室检查结果
47例(65%)患者淋巴细胞计数减低,平均值(1.09±0.59)×109/L;48例(67%)嗜酸性粒细胞计数降低,平均值(0.04±0.08)×109/L;12例(17%)单核细胞计数升高,平均值(0.44±0.20)×109/L;41例(57%)C反应蛋白升高,平均值(25.21±31.03)mg/L;31例(43%)血沉升高,平均值(26.32±26.37)mm/h;32例(44%)D -二聚体升高,平均值(681.15±134.52)ng/mL,31例(43%)纤维蛋白原含量升高,平均值(3.80±0.80)g/L;22例(31%)乳酸脱氢酶升高,平均值(228.79±71.62)IU/L。
3.住院治疗情况
本组72例患者中普通型57例(79%),重症13例(17%),危重症2例(3%)。58例(81%)接受了氧疗,10例(14%)重症及危重症患者接受了高流量吸氧。所有患者采用中药(连花清瘟胶囊、清瘟补肺汤等)及抗病毒药物(奥司他韦、阿比朵尔、克立芝、磷酸氯喹、利巴韦林等)进行治疗,34例(47%)患者使用不等剂量的激素(甲强龙、强的松等)进行治疗,32例(44%)联合使用了抗菌药(莫西沙星、拜复乐、头孢类药物等);25例(35%)患者注射了增强免疫力的药物(丙种球蛋白等)。住院期间18例(25%)出现肝功能异常,5例(7%)出现肾功能异常,3例(4%)出现皮疹,3例(4%)出现精神行为异常,1例(1%)出现左下肢静脉血栓。截至2020年2月27日,46例(64%)患者出院,25例(35%)患者仍在院接受治疗中,2例(3%)住进ICU病房,其中1例(1%)患者病变进展迅速,因呼吸衰竭而死亡。
4.肺部CT特点及评估
从发病到首次CT检查时间为0~15d,均值为(4.44±3.06)d;第一次至最后一次CT扫描时间为6~31d,平均(21.15±5.65)d;相邻两次CT扫描间隔时间为1~15d,平均(4.67±2.14天)d。72例患者共进行了374次扫描,3~7次/例,平均(5.19±1.00)次。所有患者第一次至第七次检查的时间间隔及每次CT检查各个肺叶累及范围评分见表2。5例患者首次肺部CT检查未见明显异常。
各次肺部CT检查中5个肺叶受累情况和受累范围评分见表3。历次检查中5个肺叶受累例数及受累范围评分的差异均有统计学意义(P<0.001)。采用Mann-WhitneyU检验对5个肺叶之间受累范围评分进一步进行两两比较,差异有统计学意义的有以下几组:右肺上叶与右肺下叶(P=0.032),右肺上叶与左肺下(P=0.008),右肺中叶与右肺下叶(P=0.001),右肺中叶与左肺上叶(P=0.039),以及右肺中叶与左肺下叶(P=0.000)。各肺叶中,以右肺下叶及左肺下叶发病最多见,历次检查中总出现率分别为78%和77%(P<0.05),平均得分分别为1.84±1.05和1.94±1.15,以左肺下叶累及范围最严重(P<0.05);右肺中叶发病最少,出现率为 52%,且累及范围最轻,平均得分1.61±1.00。

图1 进展-高峰-吸收模式:COVID-19患者,男,54岁,发热4天伴咽痛、肌肉酸痛,家庭聚集感染,首诊时淋巴细胞计数正常。a)发病4天后首次CT检查,显示左肺上叶胸膜下有斑片状GGO;b)第7天复查CT,显示病变沿胸膜下蔓延;c)第10天CT复查,显示病变沿胸膜下继续向背侧进展,病变范围扩大达峰值;d)第24天复查CT,显示肺内仅残留少许斑片影。
病变分布以胸膜下多见,可散在分布,重症者可见双肺弥漫性病变,甚至呈现“白肺”表现(2例)。在整个病程变化期间胸部CT可以动态观察到的影像征象有GGO、铺路石征(4例)、混合GGO、实变影、实性结节(2例)和条索影。1例合并肺不张,2例出现反晕征,6例吸收期可见少量胸水。6例合并慢支肺气肿,3例陈旧性结核,1例肾积水,1例纵隔内少量积气。
以CT扫描时间点观察,病变高峰期约在发病后1~37d,平均(9.92±5.01)d,肺部病变严重程度的平均得分为6.15±4.96。根据每例患者病程期间多次(3~7次)肺部CT累及范围评分百分比,将所有72例患者肺部病变的评分变化归纳为以下5种模式。①进展-高峰-吸收型(图1):36例(50%)患者首次CT图像上午异常改变或病变范围较小,评分较低,随后的CT检查提示病变范围扩大,评分达到峰值之后的CT扫描提示病变范围逐渐减小,最后一次CT检查提示病变完全吸收或残留少许病变。②进展-高峰-缓慢吸收型(图2):15例(21%)患者首次CT图像上评分较低,复查CT检查提示病变范围进展,评分达到峰值之后多次CT复查提示病变较前少量吸收,最后一次CT胸部检查时仍有较多的病变残留,且评分大于5分;其中1(1%)例进展为“白肺”,随后复查显示病变略有吸收。③逐渐吸收型(图3):12例(17%)患者首次CT扫描为评分达到峰值,在随后的CT复查中提示病变范围逐渐吸收,最后一次CT评分较低,病变基本吸收或残留少许病灶。④平台型(图4):6例(8%)患者多次CT检查提示肺部病变范围评分变化不明显。⑤持续进展型(图5):3例(4%)患者胸部CT提示病变范围逐渐扩大,评分逐渐增大,其中1例呈“白肺”。
肺部CT上病变进展方向的变化可以归纳为以下3种模式。①病变沿胸膜下蔓延(图1):32例(44%)患者胸部CT显示GGO进展,沿胸膜下向前后方向蔓延。②病变呈“摊饼”样扩大(图6):17例(24%)患者胸部CT上可以观察到GGO向周围片状扩大,部分病变呈圆形扩大,类似于“摊饼”样改变。③弥漫性进展(图2、5):13例(18%)GGO范围明显扩大,并不局限于肺段,或与其它病变融合呈弥漫性病变,甚至白肺(图2b)。
胸部CT病变密度的变化可以归纳为以下两种模式:①密度增高-实变-吸收模式(图2),51例(71%)胸部CT动态观察可看到GGO病变密度逐渐增高,形成混合GGO或实变或实性结节,吸收过程中可出现或不出现粗大的、纵横交错的条片影或条索影。随着病程延长,纤维条索逐渐变细、变小,最后完全吸收。②病变密度逐渐变淡吸收模式(图3):23例(32%)患者胸部CT可以观察到GGO或者混合GGO病灶密度逐渐减低,直至完全吸收,部分患者残留下少许条索影。
其它征象:3例(4%)可见“沉降征”和“界面征”(图2a,图7)。在病变吸收期,72例患者中66例(92%)可见纤维化灶,其中11例(17%)可见胸膜下线(图8a);19例(29%)可见条索带(图8b);43例(65%)可见粗乱条索影,少数病例表现为“栅栏状”(图8b)或“粗网状”(图8c)。6例(8%)患者肺部未见纤维化灶。
讨 论
COVID-19是一种高度传染性疾病,并且是致命的。本研究中男女比例各占50%,53%有明确接触史而感染,其中17%为家庭聚集感染,因此做好防护、隔离是必要的措施。本组病例中最常见的症状是发热(71%)和咳嗽(43%),嗜酸细胞计数(67%)和淋巴细胞计数减少(65%)可能对诊断有帮助,与Chen等[9]报道的数据接近。本研究中重症占17%,危重患占3%,老年患者(>65岁)较多(40%),最常见的基础疾病为高血压(24%)和糖尿病(22%)。住院隔离治疗期间部分患者(25%)出现了肝功能异常,是由于药物作用还是SARS-CoV-2病毒感染所致肝损伤,目前还没有明确的研究证据。但是这会导致住院治疗时间延长,截至发稿前本组中仍有多例患者(35%)仍在住院治疗。本研究中1例患者肺部病变持续进展,因呼吸衰竭死亡。由于纳入的危重病例数较少,病死率为1.38%,低于其它的相关研究结果[10]。

图2 进展-高峰-缓慢吸收模式:COVID患者,女,79岁,发热5天伴咳嗽、咳痰、乏力和心悸,无明确接触史,合并高血压3级,首诊时淋巴细胞计数减低,嗜酸细胞计数减低。发病5天后首次CT检查在其它层面仅发现少量GGO。a)发病第10天,胸部CT显示胸膜下大范围GGO,后部病变被叶间裂限制,界限清楚,可见“界面征”(箭)和“沉降征”;b)第14天胸部CT显示双肺弥漫性分布的混合性GGO,密度较前不均匀增高,病变进展呈“白肺”表现;c)第19天复查CT,显示病变密度进一步不均匀增高;d)第24天复查CT,显示双肺内可见粗乱的条片状和条索影,部分形成实变结节,胸膜凹陷。 图3 逐渐吸收模式:男,65岁,发热4天伴气喘,无明确接触史,合并高血压、冠心病和糖尿病。首诊实验室检查淋巴细胞计数和嗜酸细胞计数减低。a)发病4天后(2月6日)首次CT胸膜下及中央区均可见多发不规则斑片状GGO,主要位于胸膜下,部分病变呈“反晕征”;b)第8天CT 显示病变范围变化不明显,密度减低,见少许条索影;c)第13天病变密度进一步减低,见少许条索影;d) 第23天CT见病变进一步吸收,仍见少许纤维条索影。 图4 平台型:女,77岁,发热3天伴头痛、乏力、活动后气促、胸闷,有明确接触史,首诊时淋巴细胞计数减低、中性粒细胞计数升高,合并冠心病和糖尿病,伴有肺部细菌性感染及左下肢静脉血栓。a)发病3天后首次CT,显示右肺上叶胸膜下GGO(箭),双下肺实变;b)第6天CT复查显示原右肺上叶GGO呈实变表现(箭),双下肺仍为实变;c)第12天CT复查,病变略吸收,但是评分没有变化;d)第21天复查CT,病变变化不明显,并可见右侧胸腔少量积液。
COVID-19患者双肺下叶受累最多见,病变主要位于胸膜下[7,11]。肺部CT表现大致可分为早期、进展期、危重期及缓解期[12]。以CT扫描时间点观察,病变高峰期约在首次症状出现后约10天,此时肺部异常表现出最大的严重性,与Pan等[5]的研究结果基本一致,CT病变累及范围评分也呈现出了基本相同的变化模式,即进展-高峰-吸收模式(50%),这种模式大部分见于普通型患者。但是本研究中纳入了临床重症型和危重型患者,与PAN等[5]仅选择普通型患者作为研究对象不同,因此影像评分变化模式还呈现了另外4种:进展-高峰-缓慢吸收型(21%)、逐渐吸收型(17%)、平台型(8%)和持续进展型(4%)。由于临床重症及危重患者以老年人较多,既往合并基础疾病及住院治疗中并发症较多,免疫力低下,导致病变迁延不愈,病变吸收较慢,病程较长,此型患者目前均在院继续治疗中。17%的病例首次CT评分即达峰值,经过住院治疗后CT复查显示病变呈逐渐吸收型。平台型中2例患者有较多合并症,病变范围吸收不明显,仍在继续治疗中;另外4例患者病变范围较小,多次CT复查评分变化不明显,事实上病变在大小、形态或密度方面是略有改变的,但是CT范围评分并不能反映出来,这可能是CT半定量评分的缺点,结合病变密度的变化,可以判断病情好转。尤其要重视持续进展型患者,本研究中4%的患者病情变化为这种模式,患者均为临床重症及危重患者,合并症较多,肺功能较差,病情逐渐加重,其中1例死亡、1例行机械通气治疗中。
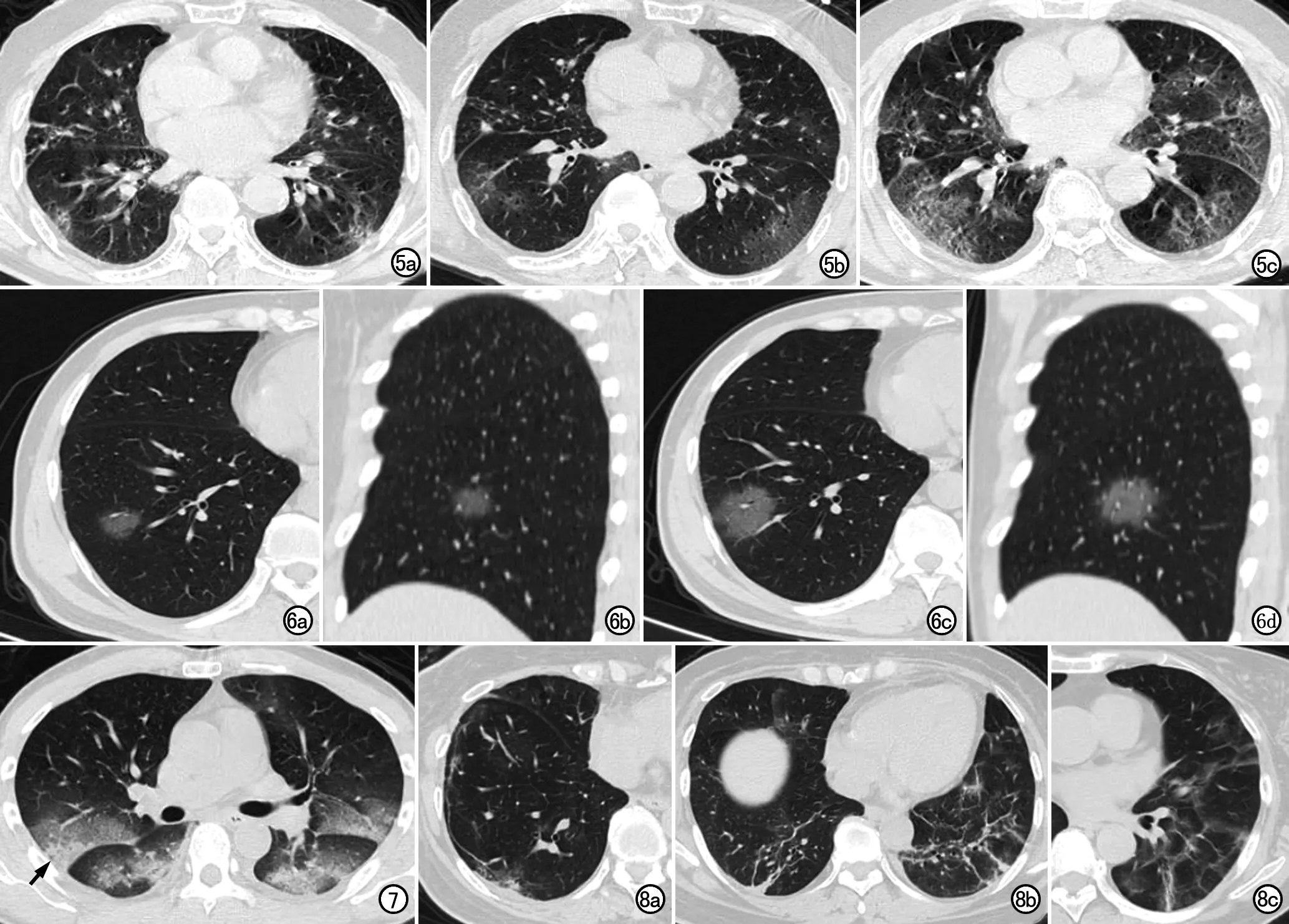
图5 持续进展型:男,83岁,发热5天,有明确接触史,首诊时淋巴细胞计数正常,嗜酸细胞计数减低,合并高血压和慢阻肺。a)发病后5天首次CT检查示双下肺胸膜下有斑片状GGO;b)第7天复查CT显示GGO沿胸膜下蔓延;c)第14天CT复查示病变范围持续扩大,呈弥漫性分布,仍表现为GGO,并可见网格影。患者第20天因呼吸衰竭死亡。 图6 病灶呈“摊饼样”扩大。a)首次CT检查显示右下肺有一类圆形GGO灶;b)首次CT矢状面重组图像,显示肺内单发GGO病灶。c)3天后复查CT显示病灶呈圆形扩大,类似“摊饼样”改变;d)3天后复查CT矢状面重组图像,显示病灶较前扩大。 图7 COVID患者。CT显示双肺上叶内大片GGO,密度由上而下逐渐增高,可见沉降征(箭)和界面征。 图8 吸收期CT图像上3种不同形态的纤维灶。a)平行于胸膜的胸膜下线;b)右下肺内可见垂直于胸膜的条索带,左下肺为形似“栅栏状”纤维条索灶;c)左下肺为杂乱的纤维条索影,纵横交织成“粗网状”。
胸部CT显示44%的患者可见GGO进展沿胸膜下向前后方向蔓延,这也是最常见的一种病变进展模式。24%的患者显示病灶为片状扩大模式,通常见于非胸膜下GGO病灶,因为没有叶间胸膜或壁胸膜的阻挡,呈片状向周围蔓延,部分病例以小支气管血管束为中心向四周均匀“摊饼样”扩大,比较典型。18%的患者呈弥漫性进展模式,比较凶险,通常见于重症患者,病变不仅沿胸膜下扩大,同时沿支气管血管束向肺野内带和中带延伸,或与其它病变融合呈弥漫性病变,甚至呈“白肺”表现。
胸部CT动态观察发现,大部分患者(71%)的肺部病变呈GGO-实变-吸收模式,进展期GGO病变密度逐渐增高,然后形成混合GGO或实变或实性结节,尤其是峰值期为弥漫性病变,在吸收期病变密度减低,边缘固缩,随后出现粗大的、纵横交错的条片影或条索影,随着病程延长,纤维条索逐渐变细、变小,最后吸收。大部分患者(92%)在病变吸收期可见纤维化灶,主要表现为3种形态的条索影:第一种是平行于胸膜的胸膜下线,与胸膜粘连不明显或较轻;第二种是垂直于胸膜的长条状条索带,尾部可延伸至肺野的中带甚至内带;第三种粗乱的条索影,最常见,通常可以引起多处胸膜凹陷,少数病例表现为“栅栏状”或“粗网状”。32%的患者肺部CT病变呈现密度逐渐变淡吸收模式,首检CT表现为GGO或者混合GGO病灶,在动态观察中发现密度逐渐减低,直至完全吸收,或短时间内残留少许纤维条索。
本组中在3例患者的肺部CT上观察到位于双肺上叶的大片混合密度影,病变上部较淡、向下逐渐增密。组织学检查为肺泡腔内充满大量黏液及损伤脱落的肺泡上皮[13],可能是由于患者长时间卧床或者在仰卧位CT扫描时的重力关系造成的“沉降征”,病变的下部因靠近叶间裂附近而被叶间裂所隔断,形成境界清楚的“界面征”。
患者在住院期间的病情变化不单单是体现在临床症状、实验室检查数据和影像变化,而且还体现在心理和精神层面。本研究中有3例(4%)患者出现明显的精神或行为异常,1例患者有自杀倾向,1例患者明显抑郁,还有1例患者烦躁不安、不配合治疗。因此住院隔离期间患者的心理疏导也应该值得关注。
综上所述,COVID-19肺部CT动态变化模式为评估患者的病情变化和及时调整治疗方案提供帮助,结合临床表现和实验室检查结果,对临床治疗具有指导意义。本研究不足之处在于样本量较小,没有对患者进行临床分组研究;其次是所观察的病程时间较短,接下来的研究方向就是扩大样本量、密切追踪患者的病情变化及预后。

