羟考酮对瑞芬太尼致切口痛大鼠痛觉敏化的干预机制研究
卢洋 王子一 杨秀娟
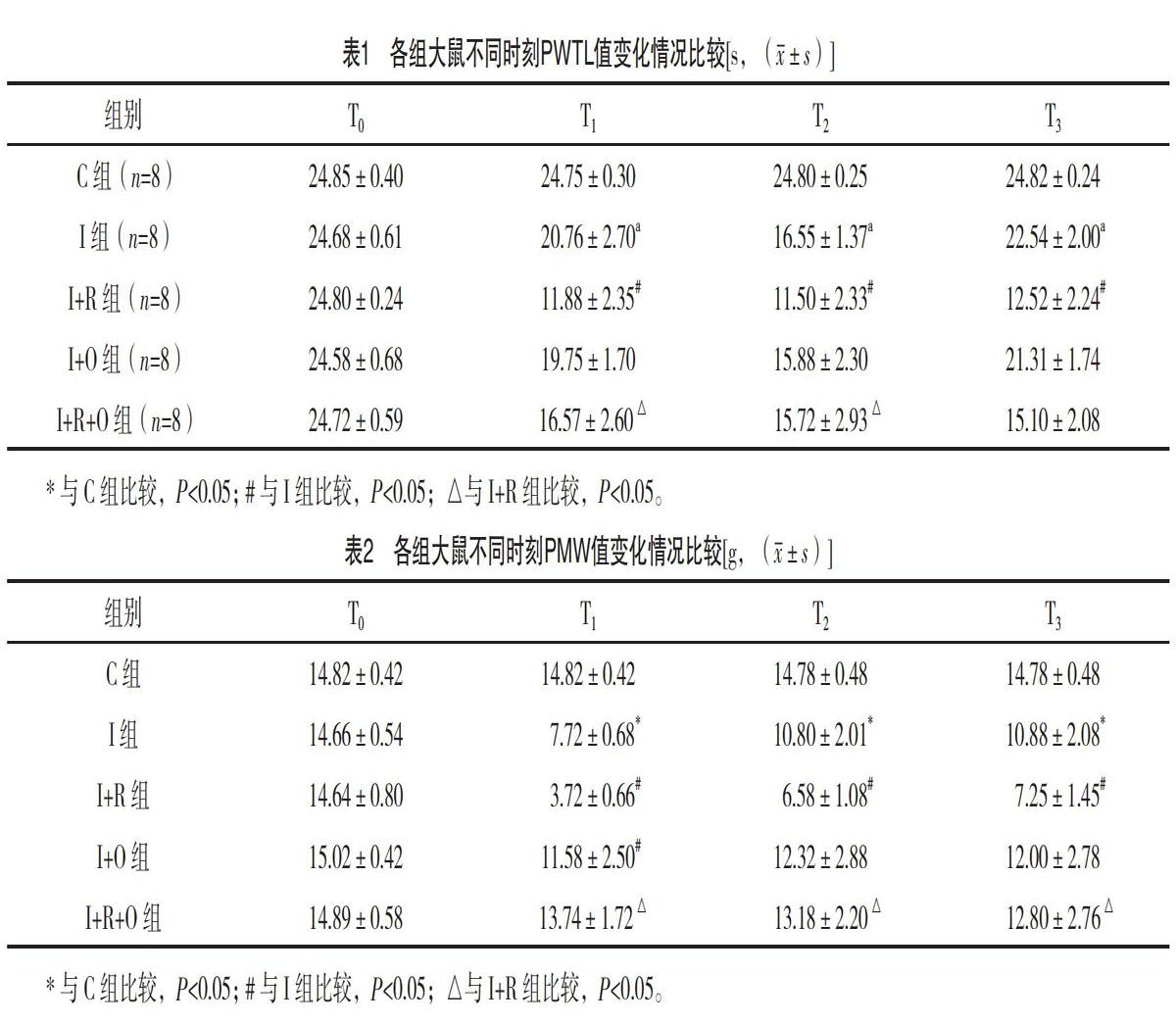
【摘要】 目的:觀察羟考酮对瑞芬太尼致切口痛大鼠痛觉敏化的干预机制。方法:选择健康雄性SD大鼠40只,按照随机数字表法分为5组,每组各8只:切口痛+瑞芬太尼+羟考酮组[I+R+O组,切口痛模型建立前30 min皮下注射10 μg/kg羟考酮,建立切口痛模型同时经尾静脉输注瑞芬太尼1.2 μg/(kg·min)];切口痛+羟考酮组(I+O组,切口痛模型建立前30 min皮下注射10 μg/kg羟考酮);切口痛+瑞芬太尼(I+R组,建立切口痛模型同时经尾静脉输注瑞芬太尼1.2μg/(kg·min)]、切口痛(I组,建立切口痛模型)、空白对照组(C组,皮下注射等量生理盐水)。采用全自动热痛刺激仪和Von Frey纤毛机械刺激针测量各组大鼠术前24 h(T0)、术后6 h(T1)、术后24 h(T2)、术后48 h(T3)测定左后足的热缩足反射潜伏期(PWTL)和机械缩足反射阈值(PMW)。Western免疫印迹检测L4~5脊髓背角磷酸化NR2B表达。结果:T1~T3时刻,与I组比较,I+R组大鼠PWTL值明显减小,差异均有统计学意义(P<0.05);T1~T2时刻,与I+R组比较,I+R+O组大鼠PWTL值明显增大,差异均有统计学意义(P<0.05);T1~T3时刻,与I组比较,I+R组大鼠PMW值明显减小,差异均有统计学意义(P<0.05);T1~T3时刻,与I+R组比较,I+R+O组大鼠PMW值明显增大,差异均有统计学意义(P<0.05)。Western免疫印迹检测显示,与I组比较,I+R组术后48 h L4~5脊髓背角磷酸化NR2B表达增加,差异有统计学意义(P<0.05);与I+R组比较,I+R+O组术后48 h L4~5脊髓背角磷酸化NR2B表达减少,差异有统计学意义(P<0.05)。结论:瑞芬太尼可诱发切口痛大鼠痛觉敏化,而羟考酮可以有效缓解痛觉敏化,这一作用机制可能与抑制脊髓背角NMDA受体亚基NR2B磷酸化有关。
【关键词】 羟考酮 瑞芬太尼 切口痛 大鼠 痛觉敏化
[Abstract] Objective: To observe intervention mechanism of oxycodone on pain sensitization in rats with incision pain caused by remifentanil. Method:A total of 40 healthy male SD rats were randomly divided into 5 groups (8 cases in each group): incision pain + Remifentanil + Oxycodone group [I + R + O group, subcutaneous injection of 10 μg/kg Oxycodone at 30 min before establishment of incision pain model, instilling Remifentanil
1.2 μg/(kg·min) by tail vein while establishing incision pain model], incision pain + Oxycodone group (I + O group, subcutaneous injection of 10 μg/kg Oxycodone at 30 min before establishment of incision pain model), incision pain + Remifentanil [I + R group, instilling Remifentanil 1.2 μg/(kg·min) by tail vein while establishing incision pain model], incision pain group (I group, establishment of incision pain model) and blank control group (group C, subcutaneous injection of the same amount of normal saline). At 24 h before surgery (T0), at 6 h after surgery (T1), at 24 h after surgery (T2) and at 48 h after surgery (T3), full-automatic heat pain stimulator and Von Frey Hairs were applied to measure paw withdrawal thermal latency (PWTL) and mechanical withdrawal threshold (PMW) of left hindfoot in both groups. Western blotting was applied to detect expression of phosphorylated NR2B in the spinal dorsal horn of L4-5. Result: At T1-T3, compared with group I, the PWTL value of rats in group I + R decreased significantly (P<0.05). At T1-T2, compared with the I + R group, the PWTL value of the I + R + O group increased significantly (P<0.05). At T1-T3, compared with I group, the PMW value of rats in group I+R decreased significantly (P<0.05). At T1-T3, compared with the I + R group, the PMW value of the rats in the I + R + O group increased significantly (P<0.05). Western Blot showed that compared with group I, NR2B phosphorylation in L4-5 dorsal horn of spinal cord in I + R group increased 48 h after surgery, with statistically significant difference (P<0.05). Compared with the I + R group, NR2B phosphorylation in L4-5 dorsal horn of spinal cord decreased 48 h after surgery in the I + R + O group, and the difference was statistically significant (P<0.05). Conclusion: Remifentanil can induce pain sensitization in rats with incision pain, and oxycodone can effectively alleviate pain sensitization. This action mechanism may be related to inhibiting phosphorylation of NMDA receptor subunit NR2B in spinal dorsal horn.[Key words] Hydroxycodone Ruifentaini The incision is painful Rat Pain sensitivityFirst-authors address: Jiamusi University, Jiamusi 154000, China
瑞芬太尼是一种具有较强镇痛作用的超短效阿片μ受体激动剂,在临床麻醉及疼痛治疗领域应用普遍,但由于其镇痛效应消失迅速,可能诱发术后痛觉敏化[1]。这一效应在很大程度上限制了瑞芬太尼在临床的应用,目前对其发生机制尚未完全清楚,如何有效预防及治疗瑞芬太尼诱发的痛觉敏化已成为临床研究的热点。N-甲基-D-天冬氨酸(NMDA)受体是疼痛传导的主要调节受体,在中枢敏化过程中背角神经元NMDA受体的激活被认为是关键环节[2]。有研究认为,瑞芬太尼致切口痛大鼠痛觉敏化的作用机制可能与促进NMDA受体向胞膜转运增加及NMDA受体磷酸化有关[3]。羟考酮是μ和κ双受体激动剂,具有镇痛、镇静、抗焦虑、镇咳等多重作用,临床适用于中度疼痛的治疗[4-5]。目前尚无研究报道羟考酮对瑞芬太尼诱发的痛觉敏化有防治作用,本研究旨在观察羟考酮对瑞芬太尼致切口痛大鼠痛觉敏化的影响,并分析这一作用是否与NMDA受体转运有关,为临床应用提供参考,现报道如下。
1 材料与方法
1.1 实验材料 (1)动物选择:健康雄性SD大鼠40只,体重220~250 g,2~3月龄,购自中南大学试验动物中心。24 h昼夜节律,自由饮食,光照时间8:00~20:00,温度24~26 ℃。实验前饲养动物1周,以适应环境。(2)试剂与器械:羟考酮(北京华素制药股份有限公司,国药准字H20090228,规格:2 mL︰20 mg,生产批号090228);瑞芬太尼(宜昌人福药业有限责任公司,国药准字H20030197,规格:1 mg,生产批号100198);七氟醚(美国百特国际有限公司,国药准字H20080680,规格:120 mL,生產批号S062G721);BME-410A型全自动热痛刺激仪(中国医学科学院医学工程研究所,天津);Von Frey纤毛机械刺激针(Stoelting公司,美国);膜蛋白提取试剂盒(Thermo公司,美国)。
1.2 模型建立 大鼠吸入3%七氟醚麻醉,三头肌肌注30 000 IU青霉素,保持自主呼吸。用10%碘伏消毒大鼠左后足,用11号刀片在跖肌位置作长约1 cm的纵向切口切开皮肤和筋膜,用眼科镊将足底肌肉挑起,从离脚后跟0.5 cm处向脚趾方向延伸,保持肌肉起止与附着处完整,按压止血后,用4-0线褥式缝合皮肤,术后用碘伏消毒切口,并用金霉素软膏覆盖预防感染。将大鼠置于安静、温暖、闭强光环境中继续喂养5 d。
1.3 实验分组与处理 采用随机数字表法将实验大鼠分为5组,每组各8只。(1)切口痛+瑞芬太尼+羟考酮组(I+R+O组):切口痛模型建立前30 min皮下注射10 μg/kg羟考酮,建立切口痛模型同时经尾静脉输注瑞芬太尼1.2 μg/(kg·min),输注时间90 min;(2)切口痛+羟考酮组(I+O组):切口痛模型建立前30 min皮下注射10 μg/kg羟考酮;(3)切口痛+瑞芬太尼(I+R组):建立切口痛模型同时经尾静脉输注瑞芬太尼1.2 μg/(kg·min),输注时间90 min;(4)切口痛(I组):建立切口痛模型;(5)空白对照组(C组):皮下注射等量生理盐水。
1.4 行为学观察 模型建立前5 d起,每天将大鼠置于观察箱内1次,使其适应实验环境。并于术前24 h(T0)、术后6 h(T1)、术后24 h(T2)、术后48 h(T3)测定左后足的热缩足反射潜伏期(PWTL)和机械缩足反射阈值(PMW)。(1)PWTL测定:用BME-410A型全自动热痛刺激仪将光辐射焦点对准大鼠左足跖底中部,打开光源照射,记录大鼠出现抬足或逃走的潜伏期为PWTL值,连续测定3次,取平均值。实验中为防止热辐射损伤,热刺激强度保持相同,光照最长时间限定为30 s。(2)PMW测定:以不同力度于术侧大鼠切口旁0.5 cm处用Von Frey纤毛机械刺激针刺激大鼠足底,从2.0 g开始按升序序列重复刺激10次,连续超过5次爪回缩的最小细丝数值为PMW值。
1.5 Western免疫印迹检测L4~5脊髓背角磷酸化NR2B表达 行为学测定完成后,立即在七氟醚深麻醉下取脊髓腰膨大L4~5节段。用膜蛋白提取试剂盒提取各组胞膜蛋白,用胰酶消化后,加入预冷的磷酸盐缓冲液(PBS)洗涤2次,加入200 μL冰预冷裂解缓冲液,充分吹打,4 ℃孵育30 min,同时每隔5 min涡旋震荡10 s,充分裂解。4 ℃,1 000 r/min离心3 min,离心半径10 cm,取上清分装,-70 ℃保存备用。将样本用裂解缓冲液稀释至相同浓度,取适量的上样缓冲液于试管中,蛋白量70 μg,煮沸5 min使其变性,-20 ℃保存。取适量凝胶置于转移缓冲液中平衡15 min,加样至10%十二烷基硫酸钠-聚丙烯凝胶(SDS-PAGE)电泳分离蛋白后,用湿电转移法(转移电压100 V,恒流200 mA,电转1 h)将蛋白转至聚偏氟乙烯(PVDF)膜上。PVDF膜在室温5%脱脂奶粉封闭液中封闭1 h。洗膜后加入封闭液和适量一抗(1︰1 000),摇荡孵育4 ℃过夜,TBST缓冲液(含吐温20的三羟甲基氨基甲烷缓冲盐水)清洗5次,5 min/次。将膜与辣根过氧化氢(HRP)结合的二抗(1︰5 000)室温下摇荡孵育1 h,TBST缓冲液清洗5次,5 min/次。按0.1 mL/cm2计算显影液用量,将显影液加于PVDF膜上,室温静置1 min,用保鲜膜将膜包好,尽量避免气泡。暗室内迅速将膜蛋白贴在X光胶片上显色曝光,扫描成像。采用Gene Tools图像分析软件(SyNGENE公司,英国)测定条带灰度值,分析结果。
1.6 统计学处理 使用SPSS 19.0统计学软件进行处理数据,计量资料以(x±s)表示,组间比较采用单因素方差分析,不同时间点比较采用重复测量方差分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠不同时刻PWTL值变化情况比较 T0时刻各组大鼠PWTL值比较差异均无统计学意义(P>0.05);T1~T3时刻,与C组比较,I组大鼠PWTL值明显减小,差异有统计学意义(t=4.154、16.756、3.201,P<0.05);T1~T3时刻,与I组比较,I+R组大鼠PWTL值明显减小,差异均有统计学意义(t=15.365、16.053、15.066,P<0.05);T1~T3时刻,与I组比较,I+O组大鼠PWTL值差异均无统计学意义(P>0.05);T1~T2时刻,与I+R组比较,I+R+O组大鼠PWTL值明显增大,差异均有统计学意义(t=3.785、3.188,P<0.05)。见表1。
2.2 各组大鼠不同时刻PMW值变化情况比较 T0时刻各组大鼠PMW值比较,差异均无统计学意义(P>0.05);T1~T3时刻,与C组比较,I组大鼠PMW值明显减小,差异均有统计学意义(t=25.126、5.447、5.167,P<0.05);T1~T3时刻,与I组比较,I+R组大鼠PMW值明显减小,差异均有统计学意义(t=11.939、5.231、4.049,P<0.05);T1时刻,与I组比较,I+O组PMW值明显减小,差异有统计学意义(t=4.214,P<0.05);T1~T3时刻,与I+R组比较,I+R+O组大鼠PMW值明显增大,差异均有统计学意义(t=15.384、7.617、5.035,P<0.05)。见表2。
2.3 各组大鼠术后48 h L4~5脊髓背角磷酸化NR2B表达比较 Western免疫印迹检测结果显示,I组术后48 h L4~5脊髓背角磷酸化NR2B表达为(0.37±0.03),C组为(0.06±0.01),I组较C组明显增加,差异有统计学意义(t=27.727,P<0.05);I+R组术后48 h L4~5脊髓背角磷酸化NR2B表达为(0.75±0.12),较I组明显增加,差异有统计学意义(t=8.689,P<0.05);I+O组术后48 h L4~5脊髓背角磷酸化NR2B表达为(0.28±0.03),较C组明显增加,差异有统计学意义(t=19.677,P<0.05),I+O组术后48 h L4~5脊髓背角磷酸化NR2B表达较I组明显减少,差异有统计学意义(t=6.000,P<0.05);I+R+O组术后48 h L4~5脊髓背角磷酸化NR2B表达为(0.13±0.05),较I+R组明显减少,差异有统计学意义(t=13.489,P<0.05)。
3 讨论
痛觉敏化系指组织或神经损伤导致一定阈下伤害性刺激过强的反应,这一过程与神经胶质细胞密切相关,涉及多种细胞因子、递质、受体等的表达,在病理性疼痛中具重要作用,可导致疼痛阈值降低,对刺激反应性增强等,影响患者术后恢复[6]。瑞芬太尼是临床麻醉过程中常用的阿片类药物,其化学结构中甲酯键的存在使其易被体内血液和组织中的假性胆碱酯酶水解,起效快,半衰期短,无蓄积,且无须在肝脏代谢,因而被广泛用于全身麻醉维持、术后镇痛及分娩镇痛[7-8]。但有研究发现,与其他阿片类药物比较,瑞芬太尼所致的痛觉敏化发生率较高,且发生时间也明显提前,不仅会导致药物镇痛效果降低,还会导致术后切口慢性疼痛,增加患者痛苦及家庭负担[9]。本研究I+R组PWTL值和PMW值亦明显低于C组和I组,与以往研究一致,证实了瑞芬太尼会引起切口痛大鼠痛觉敏化,分析瑞芬太尼导致术后疼痛增加的原因可能与手术等伤害性刺激本身所致疼痛及伤害性刺激所致中枢敏化有关。
目前临床对瑞芬太尼所致痛觉敏化的发生机制尚未完全清楚,有学者认为脊髓背角敏化在痛觉敏化发生过程中具有重要作用[10]。谷氨酸是伤害性刺激致敏的主要神经递质,中枢神经系统内分布广泛,通過谷氨酸受体介导可参与中枢神经系统信息传递[11-12]。根据激活受体物质不同可分为NMDA受体和非NMDA受体,NMDA受体是兴奋性氨基酸受体的主要亚型,有研究发现NMDA受体系统对瑞芬太尼所致痛觉敏化的调控具有重要作用[13]。天然的NMDA受体由NR1、NR2、NR3亚基组成,其中NR2B是最重要的调节亚基,研究NR2B可较好地反映NMDA受体的变化[14]。
羟考酮是一种半合成的μ、κ双受体激动剂,作用于中枢神经刺痛及平滑肌,跨膜效应及透过血脑屏障作用突出,药效较强,且对μ受体的亲和力较低,呼吸抑制作用较弱,血流动力学稳定,可在体内维持较长时间、稳定的药物浓度,在增强术后镇痛效果的同时不会增加不良反应的发生[15-16]。此外,还有研究发现羟考酮具有较强的抗伤害性刺激作用,可减少麻醉剂及阿片类药物的用量及副作用[17]。本研究采用经典又简单易建立的大鼠切口痛模型,保证实验的可行性与结果的可靠性,结果发现皮下注射羟考酮可缓解瑞芬太尼所致术后24 h内切口周围组织PWTL值降低和术后48 h内PMW值的降低,可预防瑞芬太尼所致的切口周围组织的痛觉敏化。已有较多研究发现NMDA受体在瑞芬太尼所致痛觉敏化中有重要作用[18-19]。Pergolizzi等[20]研究发现羟考酮可抑制NMDA受体介导的低强度突触后电位及高强度突触后电位的作用,抑制A和C初级传入纤维介导的突触传递,从而发挥抗伤害性刺激效果。因此推测本研究羟考酮可能也是通过抑制瑞芬太尼所致NMDA受体介导的突触后电位,而发挥预防切口周围组织的痛觉敏化的作用。进一步行Western免疫印迹检测结果显示术后48 h L4~5脊髓背角磷酸化NR2B表达与行为学观察结果基本一致。
本研究还发现皮下注射羟考酮可引起术后6 h切口周围组织PWTL值较切口痛组延长,而对切口痛引起的切口周围组织术后24、48 h的PWTL值和PMW值无明显影响,羟考酮消除半衰期为2~3 h,这提示在切口痛痛觉敏化过程中除与脊髓背角磷酸化NR2B有关可能还与其他机制或因子相关,还需进一步研究。
综上所述,瑞芬太尼可诱发切口痛大鼠痛觉敏化,预先皮下注射羟考酮可有效预防切口痛痛觉敏化,这一作用可能与抑制脊髓背角NMDA受体亚基NR2B磷酸化表达增加有关,临床可采用NMDA受体拮抗剂预防痛觉敏化。
参考文献
[1]宋凤香,陈岗,邓立琴,等.脊髓κ受体在瑞芬太尼诱发切口痛大鼠术后中枢敏化中的作用[J].中华麻醉学杂志,2016,36(8):973-977.
[2]黄娅琴,雷卫平,孙建良,等.N-甲基-D-天冬氨酸受体NR2B亚单位在神经病理性疼痛中的作用及其研究进展[J].国际麻醉学与复苏杂志,2015,36(10):933-936.
[3] Hogancann A D,Anderson C M.Physiological Roles of Non-Neuronal NMDA Receptors[J].Trends in Pharmacological Sciences,2016,37(9):750-767.
[4]朱文智,王东信.羟考酮在全身麻醉诱导中的临床应用[J].临床麻醉学杂志,2016,32(4):341-343.
[5]刘晴晴,刘永哲,高明龙.α肾上腺素受体对术后痛觉敏化的调控[J].武警医学,2018,29(2):201-203.
[6] Heusden K V,Ansermino J M,Dumont G A.Robust MISO Control of Propofol-Remifentanil Anesthesia Guided by the NeuroSENSE Monitor[J].IEEE Transactions on Control Systems Technology,2017,PP(99):1-13.
[7]吴碧玲,赖忠盟,陈文华,等.瑞芬太尼诱发切口痛小鼠痛觉过敏时脊髓水通道蛋白4表达的变化[J].中华麻醉学杂志,2016,36(12):1462-1464.
[8]舒瑞辰,张麟临,李楠,等.瑞芬太尼诱发切口痛大鼠痛觉过敏时脊髓铁含量的变化[J].中华麻醉学杂志,2016,36(5):581-583.
[9]孙哲,元元,陈怡,等.右美托咪定对瑞芬太尼诱发切口痛大鼠痛觉过敏时脊髓背角神经元NMDA受体转运的影响[J].中华麻醉学杂志,2016,36(8):968-972.
[10]徐如彬,王春艳,李依泽,等.瑞芬太尼诱发切口痛大鼠痛觉过敏时脊髓和背根神经节CaMKⅡα表达的变化[J].中华麻醉学杂志,2018,38(11):1339-1342.
[11]陈强,纪雷,何雨芩,等.创伤后应激障碍状态下脊髓谷氨酸转运体-1调控内脏高敏感性-痛觉敏化的作用及其机制研究[J].中华内科杂志,2014,53(6):477-481.
[12] Liu A,Wang X,Wang H,et al.Δ-opioid receptor inhibition prevents remifentanil-induced post-operative hyperalgesia via regulating GluR1 trafficking and AMPA receptor function[J].Experimental & Therapeutic Medicine,2018,15(2):2140-2147.
[13]周莹,李国利,滕金亮,等.N-甲基-D-天冬氨酸受体在瑞芬太尼诱发痛觉过敏中作用的研究进展[J].国际麻醉学与复苏杂志,2015,36(3):271-274.
[14]李欢颜,阳巧云,彭良玉,等.NMDA-NR2B亚基受体与神经病理性疼痛的研究进展[J].海南医学,2015,26(23):3503-3506.
[15]李敬平,魏海婷,楊坤渹.不同剂量羟考酮对妇科腹腔镜术后疼痛及应激反应的影响[J].临床麻醉学杂志,2016,32(8):765-768.
[16]王娜,王金国,庞磊,等.盐酸羟考酮注射液超前镇痛对术后舒芬静脉自控镇痛的影响[J].中国实验诊断学,2015,19(8):1398-1399.
[17]吉嘉炜,徐铭军.羟考酮的临床研究进展[J].北京医学,2017,39(6):625-627.
[18] Zhu M,Yuan S T,Yu W L,et al.CXCL13 regulates the trafficking of GluN2B-containing NMDA receptor via IL-17 in the development of remifentanil-induced hyperalgesia in rats[J].Neuroscience Letters,2017,648:26-33.
[19] Ye L,Xiao L,Bai X, et al. Spinal mitochondrial-derived ROS contributes to remifentanil-induced postoperative hyperalgesia via modulating NMDA receptor in rats[J].Neuroscience Letters,2016,634(10):79-86.
[20] Pergolizzi J,Seow-Choen F, Wexner S D, et al.Perspectives on Intravenous Oxycodone for Control of Postoperative Pain[J].Pain Practice,2016,16(7):924-934.
(收稿日期:2019-09-19) (本文编辑:周亚杰)

