子痫前期患者血清miR-195及其启动子区甲基化水平观察
牛三强,于康军,谭宪岩,陈玲,陈东颖
1亳州市人民医院,安徽亳州236800;2安徽省立医院
子痫前期是一种常见且严重的妊娠并发症[1],是全世界孕产妇和婴儿死亡的主要原因之一[2]。子痫前期发病机制尚不明确,症状表现为高血压、显著的蛋白尿、血管内皮功能障碍和全身炎症反应,需要一些可靠标志物以帮助早期诊断。多项研究表明,先兆子痫的发病与相关基因甲基化状态密切相关[3,4]。DNA甲基化通常是在胞嘧啶-磷酸-鸟嘌呤二核苷酸(CpG)的背景下以共价键添加一个甲基到胞嘧啶[5]。先前的研究表明,表观遗传修饰(包括甲基化)可调节基因的表达[6]。已有研究发现miR-195表达异常参与了子痫的发生[7],但关于miR-195启动子区甲基化在子痫前期发病中作用的研究较少。因此,本研究观察了子痫前期患者血清miR-195及其启动子区甲基化水平变化,并分析其与子痫前期临床特征的关系。
1 资料与方法
1.1 临床资料 选择2017年8月~2018年8月在亳州市人民医院就诊的孕妇参与研究。子痫前期孕妇30例为病例组,年龄23~42(29.7±3.5)岁,孕次(1.7±0.6)次,BMI (27.5±2.2)kg/m2,排除有其他并发症者。健康无合并症孕妇30例为对照组,年龄24~41(30.8±2.3)岁,孕次(1.5±0.7)次,BMI (25.5±5.2)kg/m2。两组一般资料差异均无统计学意义。本研究经亳州市人民医院伦理委员会批准,并经患者知情同意。
1.2 血清miR-195检测 采用qRT-PCR法。收集患者外周血2~3 mL,分离血清,-80 ℃冰箱冷冻保存备用。使用TRIzol试剂盒(北京天根生物有限公司)提取细胞总RNA,miR-195和内参U6引物以及探针由上海闪晶分子生物有限公司设计合成,使用FTC-3000P PCR仪器(加拿大枫岭生物公司)进行实验。miR-195上游引物序列为5′-AGCTTCCCTGGCTCTAGCA-3′,下游引物序列为5′-CTGGAGCAGCACAGCCAATA-3′;U6上游引物序列为5′-GCTTCGGCAGCACATA-3′,下游引物序列为5′-CTTCACGAATTTGCGTG-3′。反应条件:95 ℃ 5 min,95 ℃ 20 s、60 ℃ 20 s、50个PCR循环。以2-ΔΔCt表示miR-195相对表达量。
1.3 miR-195启动子区甲基化检测
1.3.1 miR-195启动子区甲基化特异性PCR(MSP)引物设计 通过UCSC数据库,获得miR-195启动子区及其上下游各1 000 bp序列,使用Methprimer预测软件设计miR-195启动子区MSP引物,miR-195甲基化特异性引物(M)上游序列为5′-GGTTTGTAAAAATTTTCGGTATAAAC-3′,下游引物序列为5′-GACATATTTAATATCACACGACGAC-3′,扩增产物157 bp,退火温度57 ℃;miR-195非甲基化特异性引物(U)上游序列为5′-TTGTAAAAATTTTTGGTATAAATGG-3′,下游引物序列为5′-CAACATATTTAATATCACACAACAAC-3′,扩增产物155 bp,退火温度56 ℃。
1.3.2 MSP反应 PCR反应体系为20 L,模板为经去甲基化试剂盒处理的孕妇外周血DNA 2 L,10×PCR buffer 2 L,Mg2+1.6 μL,dNTP mix 0.4 L,DMSO 4 L,上下游引物10 pmol/L各2 L,HSTaq酶 0.2 L,灭菌水11.4 L。取5 L PCR扩增产物,2.0%琼脂糖凝胶电泳25 min,使用凝胶成像系统观察并拍照,根据DNA条带判断结果:甲基化阳性为M引物扩增出目的条带、U引物未扩增出目的条带,M引物和U引物均扩增出目的条带;甲基化阴性为U引物扩增出目的条带而M引物未扩增出目的条带。
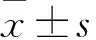
2 结果
2.1 两组血清miR-195水平比较 病例组、对照组血清miR-195水平分别为0.558±0.153、0.955±0.213,病例组血清miR-195水平低于对照组(P<0.01)。
2.2 两组miR-195启动子区甲基化水平比较 病例组、对照组miR-195启动子区甲基化阳性率分别为62%(23/30)、24%(11/30),病例组miR-195启动子区甲基化阳性率高于对照组(P<0.05)。
2.3 miR-195表达及启动子区甲基化与子痫前期临床病理参数的关系 脐动脉S/D≥2.6的子痫前期患者血清miR-195水平高于S/D<2.6者,miR-195启动子区甲基化阳性率低于S/D<2.6者(P均<0.05)。血清miR-195及其启动子区甲基化水平与患者年龄、孕周、BMI及尿蛋白水平无关。见表1。
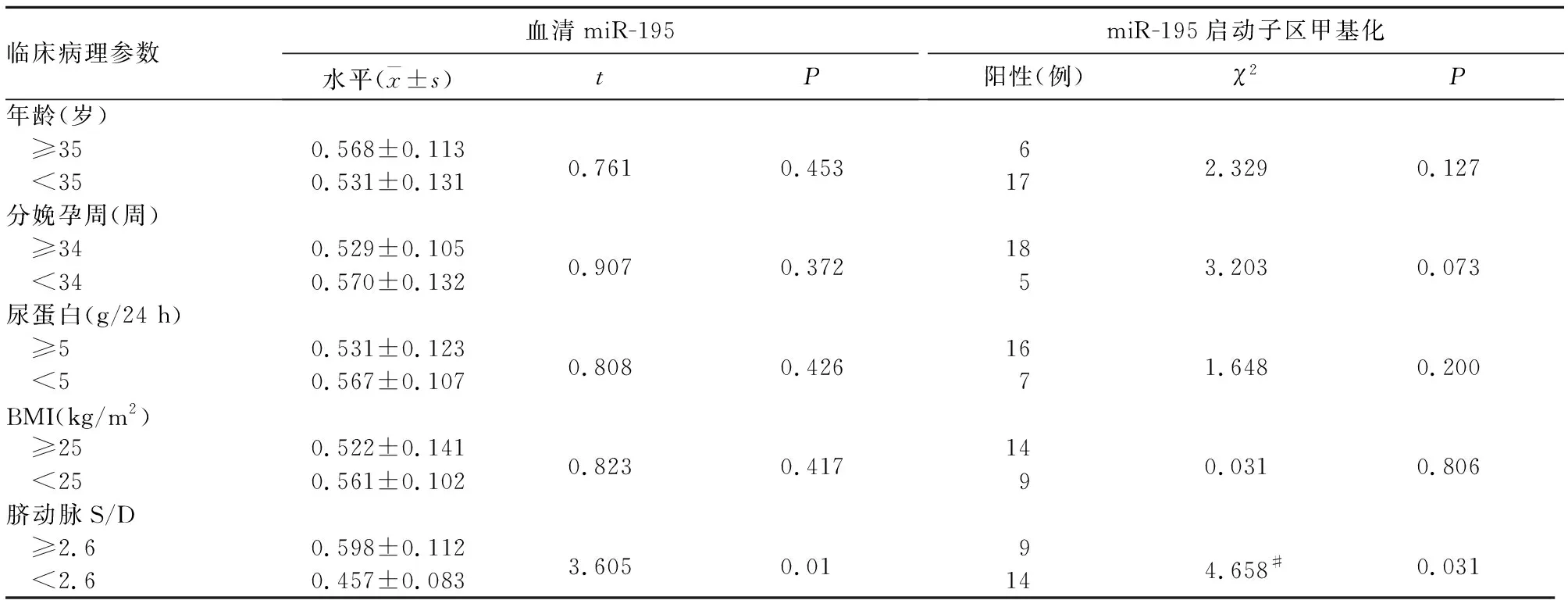
表1 血清miR-195及其启动子区甲基化与子痫前期临床病理参数的关系
注:#Fisher′s检验结果。
3 讨论
miRNA通过调节基因表达来影响几乎所有细胞功能[8]。miRNA是长度为18~22个核苷酸的小非编码RNA,其通过抑制核糖体上的基因翻译过程或通过降解相应的mRNA,在转录后水平上起作用[9,10]。目前已经鉴定了超过1 500种人类miRNA,约50%的蛋白质编码基因都受其调节[9~11]。子痫前期的发病机制复杂,尚未完全了解。对于miRNA在子痫前期发病过程中的调控机制也不完全清楚。目前已知缺氧可能是影响胎盘活动过程的主要因素。一系列miRNA(miR-205、335、224、451、491、210)在低氧水平下表达上调,而miR-424表达减少[12]。miRNA在转录水平受到调节,但表观遗传机制也可以影响miRNA的表达[13]。
滋养细胞分化与DNA甲基化及非甲基化状态有关。滋养细胞分化过程中,一些基因启动子区甲基化及非甲基化状态可以改变基因表达状态,继而影响滋养细胞生理功能,参与子痫前期的发病[14]。胎盘形成的机制是滋养层细胞对蜕膜和子宫肌层的迁移和侵袭[15]。有学者发现,在重度子痫前期状态下,miR-675表达下调可促进过多滋养层细胞增殖[16]。还有研究表明,miR-195、miR-376c和miR-378a-5p通过抑制Nodal/TGF-β信号转导,促进滋养细胞迁移和侵袭,三者在子痫前期患者中表达下调[7,17,18]。血液循环中miRNA的特异性等特点使其具备了作为疾病早期诊断分子标志物的可能[19]。已有研究开始利用外周血miRNA定量检测来评估及预测子痫前期等疾病。本研究采用qRT-PCR法检测了子痫前期患者血清中的miR-195,结果显示,病例组血清miR-195水平低于对照组,提示miR-195表达变化可能参与了子痫前期的发病,具体机制目前尚未明确。
马颖等[20]研究显示,子痫前期与鸟嘌呤核苷酸结合蛋白(GNA12)启动子甲基化水平降低相关,外周血基因甲基化检测对子痫前期的早期诊断也有一定意义。本研究通过MSP检测子痫前期患者和对照组血清miR-195启动子区甲基化水平,结果表明,病例组血清miR-195启动子区甲基化水平高于对照组,且子痫前期孕妇miR-195启动子区甲基化水平与孕妇年龄、分娩时间、BMI及尿蛋白量无关,而与脐动脉S/D有关,可能是miR-195启动子区高甲基化抑制了miR-195表达,通过促进其下游的与子痫前期相关的靶基因过表达,影响相关通路的调节功能,导致子痫前期的发病。已有研究表明,miR-195通过干扰其靶基因ActRIIA表达,影响Activin/Nodal信号转导而导致子痫前期的发生[16]。因此,我们推测miR-195在子痫前期中低表达可能主要与其启动子区高甲基化有关,其甲基化水平变化可能参与子痫前期的发生发展。
总之,本研究结果显示,子痫前期患者血清miR-195水平降低,启动子区甲基化水平升高,推测miR-195表达变化可能参与了子痫前期的发病,具体机制将在后续研究中进一步阐明。

