银杏叶提取物对间歇性低氧小鼠氧化应激及胰腺Nrf2-ARE通路蛋白表达的干预作用
肖丽君,周燕,汤宇飞
桂林医学院附属医院,广西桂林541001
阻塞性睡眠呼吸暂停综合征(OSAS)主要特点是在睡眠期间反复出现间歇性缺氧,可引发氧化应激和全身炎症反应,进而导致活性氧(ROS)、抗氧化酶和炎症因子的释放。核因子E2相关因子2-抗氧化反应元件(Nrf2-ARE)信号通路由转录因子Nrf2、调控蛋白Keap1及抗氧化反应元件ARE组成。研究表明,Nrf2-ARE信号通路是迄今为止发现的最重要的内源性抗氧化应激通路[1]。Nrf2作为氧化应激的重要调节因子,在生理状况下,Nrf2与Keapl结合且以非活性状态存在于胞质中,并经泛素蛋白酶体途径迅速降解,保持低转录活性[2];在受到ROS的刺激后,Nrf2进入细胞核并与ARE序列结合,激活下游靶基因及其产物,如血红素加氧酶1(HO-1)、苯醌氧化还原酶1(NQO1)、γ-谷氨酰半胱氨酸合成酶(γ-GCS)等表达[3],减少ROS的产生,减轻氧化应激对机体的损伤。银杏叶提取物(EGB)是从银杏叶中提取的活性物质,含有22%~27%的银杏黄酮和5%~7%的萜烯内酯[4],这些活性化合物可防止脂质过氧化,减轻氧化应激,减少细胞凋亡,并抑制炎症反应[5]。研究发现,OSAS与2型糖尿病(T2DM)、糖代谢障碍和胰岛素抵抗密切相关[6]。还有研究发现,胰腺组织抗氧化酶的表达相对较少,容易受到ROS等的影响[7]。为探讨慢性间歇性低氧(CIH)对胰腺组织的损伤机制,2018年3月~2019年6月,本研究观察了EGB对CIH小鼠氧化应激及胰腺组织Nrf2-ARE通路相关蛋白表达的干预作用,为OSAS及其并发症的治疗提供理论依据。
1 材料与方法
1.1 实验动物与主要材料 健康8周龄C57BL/6雄性小鼠42只,体质量(20±2)g,购自常州卡文斯实验动物有限公司。所有动物饲养于实验动物中心,12 h明暗周期、温度(23±3)℃、相对湿度45%~65%,给予标准的饮用水和鼠粮。本研究动物处理程序和实验方案已获得桂林医学院附属医院伦理委员会的批准。EGB(EGB761,金纳多)购自德国Schwabe制药集团;Nrf2、HO-1、NQO1、γ-GCS单克隆抗体购自美国Abcam公司;小鼠β-actin抗体、辣根酶标记抗兔IgG二抗、辣根酶标记抗鼠IgG二抗购自北京中杉金桥生物技术有限公司;总抗氧化能力(T-AOC)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒购自上海酶联生物科技有限公司;逆转录试剂盒购自北京天根生化科技有限公司。全自动低氧动物舱(型号JXOC-12)购自南京新飞公司;实时荧光定量PCR仪(CFX96)购自美国伯乐公司;多功能酶标仪购自美国伯腾仪器有限公司。
1.2 动物模型制备及给药方法 健康C57BL/6雄性小鼠42只,适应性喂养1周后按随机数字表法分为常氧对照组、间歇性低氧组、Nrf2激活剂组、抗Nrf2抗体组及EGB低、中、高浓度组,每组6只。间歇性低氧组、Nrf2激活剂组、抗Nrf2抗体组及EGB低、中、高浓度组建立间歇性低氧模型,模拟间隙性的缺氧-复氧状态:小鼠置于间歇性低氧舱内,循环充入氮气和氧气,每循环120 s,充入氮气使最低氧浓度为4%~6%,维持20~30 s,随之充入氧气至21%,8 h/d(9:00~17:00)。常氧对照组每日同时置于相同规格的有机玻璃舱内,空气输入,无缺氧,其余时间置于饲养笼常规饲养。造模10周结束后开始给药,常氧对照组、间歇性低氧组予1 mL/d生理盐水腹腔注射,Nrf2激活剂组予Nrf2激活剂莱菔硫烷5 mg/(kg·d)腹腔注射,抗Nrf2抗体组予抗Nrf2抗体5 mg/(kg·d)腹腔注射,EGB低、中、高浓度组分别给予50、100、200 mg/(kg·d)的EGB灌胃。药物干预第10周末,腹腔注射水合氯醛麻醉小鼠,眼眶后静脉丛采血,4 ℃下3 000 r/min离心20 min,-20 ℃保存。无菌条件下取出小鼠胰腺组织,迅速液氮中速冻,-80 ℃冻存备用。
1.3 血清氧化应激指标检测 采用ELISA法检测血清T-AOC、MDA、GSH-Px含量。
1.4 胰腺组织中Nrf2、HO-1、NQO1、γ-GCS mRNA及蛋白检测
1.4.1 Nrf2、HO-1、NQO1、γ-GCS mRNA检测 使用TRIzol试剂提取胰腺组织总RNA,使用多功能酶标仪测定总RNA浓度。将RNA逆转录成cDNA并扩增。内参GAPDH上游引物序列为5′-TATGTCGTGGAGTCTACTGGT-3′,下游引物序列为5′-GAGTTGTCATATTTCTCGTGG-3′;Nrf2上游引物序列为5′-ACAGTGCTCCTATGCGTGAA-3′,下游引物序列为5′-TCTGGGCGGCGACTTTAT-3′;HO-1上游引物序列为5′-CCCAAAACTGGCCTGTAAAA-3′,下游引物序列为5′-CGTGGTCAGTCAACATGGAT-3′;NQO1上游引物序列为5′-AGGATGGGAGGTACTCGAATC-3′,下游引物序列为5′-AGGCGTCCTTCCTTATATGCTA-3′;γ-GCS上游引物序列为5′-CAGGACAGCCTAGTCTGGGGAA-3′,下游引物序列为5′-CAGGACAGCCTAGTCTGGGGAA-3′。使用Power SYBR Green PCR Master Mix和CFX96 real-time PCR仪进行PCR反应。以2-ΔΔCt表示目的基因相对表达量。
1.4.2 Nrf2、HO-1、NQO1、γ-GCS蛋白检测 用RIPA裂解缓冲液在冰上处理胰腺组织,4 ℃下以12 000 r/min离心15 min,以获得上清液,BCA蛋白质检测试剂盒检测蛋白质浓度;使用SDS-PAGE分离蛋白质,然后将电泳产物转移到PVDF膜上;5%脱脂牛奶在室温下封闭膜2 h,加入一抗(1∶1 000)4 ℃下孵育过夜,TBST洗涤3次(10 min/次);加入二抗(1∶5 000),在室温下放置2 h;洗涤后,将ECL发光液加到膜上,使用压片法观察免疫反应。用Image J软件分析条带光密度值。将β-actin作为内部对照,以目的条带与β-actin的光密度比值作为蛋白的相对表达量。
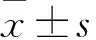
2 结果
2.1 各组小鼠血清氧化应激指标水平比较 间歇性低氧组、抗Nrf2抗体组血清T-AOC、GSH-Px水平低于常氧对照组,MDA水平高于常氧对照组(P均<0.05);Nrf2激活剂组及EGB高浓度组血清T-AOC、GSH-Px水平高于常氧对照组,MDA水平低于常氧对照组(P均<0.05);Nrf2激活剂组及EGB低、中、高浓度组血清T-AOC、GSH-Px水平高于间歇性低氧组,MDA水平低于间歇性低氧组(P均<0.05);抗Nrf2抗体组血清T-AOC、GSH-Px水平低于间歇性低氧组,MDA水平高于间歇性低氧组(P均<0.05)。见表1。
2.2 各组小鼠胰腺组织中Nrf2-ARE信号通路相关蛋白mRNA表达比较 间歇性低氧组、抗Nrf2抗体组胰腺组织中Nrf2、HO-1、NQO1、γ-GCS mRNA相对表达量低于常氧对照组,Nrf2激活剂组及EGB高浓度组Nrf2、NQO1、γ-GCS mRNA相对表达量高于常氧对照组(P均<0.05);Nrf2激活剂组及EGB高浓度组Nrf2、HO-1、NQO1、γ-GCS mRNA相对表达量高于间歇性低氧组,抗Nrf2抗体组Nrf2、HO-1、NQO1、γ-GCS mRNA相对表达量低于间歇性低氧组(P均<0.05)。见表2。
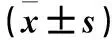
表1 各组小鼠血清T-AOC、MDA、GSH-Px水平比较
注: 与常氧对照组相比,*P<0.05,**P<0.01;与间歇性低氧组相比,△P<0.05,△△P<0.01。
2.3 各组小鼠胰腺组织中Nrf2-ARE信号通路相关蛋白表达 间歇性低氧组及抗Nrf2抗体组胰腺组织中Nrf2、HO-1、NQO1相对表达量低于常氧对照组,Nrf2激活剂组Nrf2、HO-1、NQO1、γ-GCS相对表达量高于常氧对照组(P均<0.05);Nrf2激活剂组及EGB中、高浓度组Nrf2、HO-1、NQO1、γ-GCS相对表达量高于间歇性低氧组,抗Nrf2抗体组Nrf2、HO-1、NQO1、γ-GCS相对表达量低于间歇性低氧组(P均<0.05);EGB高浓度组Nrf2、HO-1、NQO1、γ-GCS表达高于EGB中浓度组(P均<0.05)。见表3。
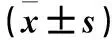
表2 各组小鼠胰腺组织Nrf2-ARE信号通路相关蛋白mRNA表达比较
注:与常氧对照组相比,*P<0.05,**P<0.01;与间歇性低氧组相比,△P<0.05,△△P<0.01。
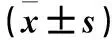
表3 各组小鼠胰腺组织中Nrf2-ARE信号通路相关蛋白表达比较
注: 与常氧对照组相比,*P<0.05,**P<0.01;与间歇性低氧组相比,△P<0.05,△△P<0.01。
3 讨论
OSAS是一种睡眠呼吸障碍疾病,其特征是在睡眠过中反复发生缺氧和再氧合,引起体内ROS增多,破坏了氧化系统和抗氧化系统的平衡,从而导致氧化应激。氧化应激是OSAS产生机体损伤的关键[8,9]。MDA作为氧化应激的主要指标之一,是脂质过氧化的最终产物[10]。此外,T-AOC和GSH-Px在有效去除内源性过量ROS中发挥重要作用。T-AOC、MDA和GSH-Px可反映机体氧化应激水平及抗氧化系统功能。本实验结果显示,与常氧对照组比较,间歇性低氧组血清T-AOC和GSH-Px水平降低,MDA水平升高,提示CIH小鼠体内出现氧化活性物质的堆积、脂质过氧化及氧化-抗氧化系统的失衡,导致氧化应激反应增强。
已有研究发现T2DM患者中合并OSAS的发生率明显升高,近期研究进一步证实OSAS可导致T2DM的发生[11],也是T2DM并发症发生发展的独立危险因素[12]。本课题组前期的研究结果表明,CIH导致的氧化应激是胰岛β细胞氧化损伤的重要机制[13]。研究发现,Nrf2-ARE信号通路是最为重要的内源性抗氧化应激通路。在氧化应激条件下,Nrf2通过从Nrf2-Keap1复合体解离并从细胞质转移到细胞核中而被激活,然后通过与细胞核中靶基因的ARE序列结合来诱导抗氧化酶和Ⅱ期药物代谢酶的产生,增强细胞清除活性氧的能力,从而维持氧化还原平衡并减少氧化应激损伤[14]。Nrf2-ARE信号通路已成为治疗恶性肿瘤、神经系统疾病、肺纤维化、糖尿病及其并发症的药物靶点[15],然而,其在OSAS中的作用及机制鲜有报道。有研究表明,Nrf2-ARE信号通路在中度至重度OSAS患者中通过抑制炎症反应、减少氧化应激和诱导解毒酶的表达发挥保护作用[16]。本研究结果显示,与常氧对照组比较,间歇性低氧组Nrf2、HO-1、NQO1和γ-GCS表达降低,这提示CIH导致的氧化应激能抑制抗氧化应激因子Nrf2及其调控的下游抗氧化酶HO-1、NQO1、γ-GCS的表达。本研究还发现,与间歇性低氧组比较,Nrf2激活剂组Nrf2及HO-1、NQO1、γ-GCS表达升高,这表明Nrf2-ARE信号通路可能与抗氧化应激和减轻胰腺组织损伤有关。
EGB是从银杏叶中分离纯化的活性物质,具有强大的抗氧化、清除自由基和抑制脂质过氧化作用,可有效降低氧化应激,减轻炎症反应。因此,为了研究EGB是否可以通过激活Nrf2-ARE信号通路抑制CIH诱导的胰腺组织损伤,本研究检测了Nrf2-ARE信号通路相关蛋白的表达变化。研究结果显示,与间歇性低氧组比较,EGB高浓度组Nrf2的mRNA和蛋白表达增加,EGB中、高浓度组Nrf2-ARE信号通路下游的HO-1、NQO1和γ-GCS的表达均有不同程度增加,这些结果表明EGB在间歇性低氧模型中对胰腺组织的保护作用可能与Nrf2及其下游抗氧化基因的激活有关。本研究还发现,与间歇性低氧组比较,EGB低、中、高浓度组T-AOC和GSH-Px水平增高,MDA水平降低,这表明EGB可以增强抗氧化能力,减轻氧化应激反应,具有抗氧化作用,并与剂量呈正相关。
综上所述,CIH导致的氧化应激是OSAS胰腺组织损伤的潜在机制,Nrf2-ARE信号通路及其调控的抗氧化蛋白可能通过拮抗氧化应激反应抑制OSAS的胰腺组织损伤。EGB可减轻间歇性低氧小鼠氧化应激水平,上调胰腺组织Nrf2-ARE通路蛋白表达。EGB可能通过减轻氧化应激水平、激活Nrf2-ARE信号通路减轻OSAS胰腺组织损伤。

