绿豆谷氨酸脱羧酶的分离纯化工艺
王宪青,魏 彤,石彦国
(1.哈尔滨商业大学食品科学与工程学院,黑龙江 哈尔滨 153000;2.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
γ-氨基丁酸(GABA)是植物细胞中自由氨基酸库内的重要组成成分之一[1],是由谷氨酸脱羧酶(GAD)催化谷氨酸生成的[2]。研究表明,GABA具有多项生物学活性,如促进生长激素分泌、改善大脑机能、防止老年动脉硬化、大脑中重要抑制性神经递质,还具有治疗癫痫、抗焦虑、镇静、改善肝脏功能等功能[3-4]。但是,动植物内的GABA含量极低,无法大规模从中提取得到并加工利用。目前,常采用生物合成法和化学合成法两种方法进行制备生产GABA。但化学合成法具有易残留化学试剂、副反应不可控、反应条件剧烈等缺陷,不适用于食品的加工应用[5-6]。因此,常使用生物体内的GAD进行催化转化谷氨酸生产GABA。
植物是提取GAD的重要原料之一,且植物内的GAD酶活性对植物生长、发育、成熟和衰老具有重要影响[7]。目前,相关研究也已从植物原料中检测到GAD酶活力并提取分离得到了GAD。Inatami等[8]的研究表明,大麦中含有2种GAD同工酶,且具有极高的催化活性。范军等[9]研究表明,小麦GAD由6个相同的亚基组成,分子量为310 kDa,和大肠杆菌内的GAD酶结构相似。张晖等[10]的研究表明米胚中GAD酶分子量为78 kDa,其活力受到Ca2+/CaM复合物的调节。姚琪等[11]对大豆中的GAD进行了提取、纯化及酶学性质的研究,经纯化后其纯度提高了4.7倍,但热稳定较差且酶活易受金属离子的影响。前期实验表明,绿豆也具有一定的GAD活性,可用来富集生产GABA。但目前为止,并未见到关于绿豆GAD提取纯化的报道。
目前,关于GABA和GDA的生物学活性研究逐渐深入,但食品中的GABA含量和GDA酶活性的测定方法却不多见。由于GABA对紫外、可见光的敏感度较低且酶活力易受外界环境所干扰降解,导致直接传统方法对其进行测定比较困难。通过构建一种稳定性好、重复性佳的测定方法是研究绿豆GAD酶的前提。有研究表明,柱前衍生法较纸层析法、比色法、液相法等稳定性更高[12-13],但关于OPA柱前自动衍生-紫外检测法测定绿豆中GAD酶活性和GABA含量的可行性和测定方法还尚未有文献报道。因此,通过构建绿豆GABA含量和GAD酶活性的检测方法,并采用硫酸铵沉淀法、离子交换色谱、葡聚糖凝胶分离等方法构建分离纯化工艺体系,进而得到酶活较高且成分单一的绿豆GAD组分,对绿豆精深加工和新型GABA的生产具有深远的意义,同时也能丰富对植物GAD的了解,并从理论上为绿豆富集GABA提供支持。
1 材料与方法
1.1 主要实验材料
绿豆:产地海伦市,黑龙江国峰粮贸有限公司;2,4-二硝基氟苯(FDNB),天津市永大化学试剂有限公司;甲醇,色谱纯,中国医药集团上海化学试剂公司;GABA,美国Sigma公司;谷氨酸,上海生物试剂公司;硫酸铵,西陇化工股份有限公司;乙腈,色谱纯,中国医药集团上海化学试剂公司;磷酸吡哆醛(PLP),郑州生化有限公司。
1.2 主要实验设备
PC-2025高效液相色谱仪,上海天普有限责任公司;SG2型pH计,梅特勒-托利多仪器(上海)有限公司;HD-3紫外检测器,上海沪粤明科学仪器有限公司;ACPHAI-4 冷冻干燥机,CHRIST公司;色谱柱:汉邦Lichrospher C18色谱柱。
1.3 实验方法
1.3.1GABA蛋白质含量的测定方法
准确配置GABA浓度为5 g/L的标准溶液,并将其稀释至0.08、0.16、0.24、0.32、0.40、0.48、0.56、0.64、0.80 g/L,配置体积分数1%FDNB的乙腈溶液作为衍生剂,取1 ml的标准GABA溶液或待测样品于20 ml的棕色容量瓶中,并加入1 ml NaHCO3(浓度为0.5 mol/L,pH值为9.0)溶液,混匀后加入1 ml体积分数1%的2,4-二硝基氟苯的乙腈溶液,放置于暗处60℃水浴1 h,冷却至室温后,加入pH7.0的磷酸盐缓冲液至容量瓶刻度,混合均匀后8 000 r/min离心10 min,过0.45 μm滤膜暗处避光冷藏备用。在该衍生化条件下可保证衍生剂过量,样品中的GABA完全被衍生化。采用液相色谱法进行测定各组分的峰面积,制作峰面积和GABA含量的标准曲线,根据标准曲线计算待测样品中的GABA含量。检测条件:检测波长为360 nm;进样量为20 μl;柱温为35℃;流速为1.0 ml/min;洗脱条件A∶B=4∶6,其中A:CH3CN∶H2O=1∶1,B:pH7.0的磷酸盐缓冲液。
1.3.2GAD酶活性测定
取0.5 ml待测样品液,加入底物体积分数为1%的谷氨酸10 ml,于40℃下水浴2 h后,90℃灭酶处理5 min,8 000 r/min的条件下离心10 min,取上清液,柱前衍生法测定GABA含量,并以每30 min生产1 μmol GABA 作为一个谷氨酸脱羧酶酶活力单位。
1.3.3绿豆GAD的提取
准确称取绿豆细粉200 g,加入提取液1 000 ml(50 mmol/L磷酸盐缓冲液,pH5.6,2 mmol/L巯基乙醇,2 mmol/L EDTA,1 mmol/L PLP,1 mmol/L PMSF和10%甘油),用高速分散器(10 000 r/min,10 min)打成匀浆,4层纱布过滤,5 000 r/min,4℃离心25 min,上清液即为绿豆GAD提取液。
1.3.4绿豆GAD分离纯化
1.3.4.1(NH4)2SO4沉淀纯化法
由于绿豆GAD粗提液中的有效物质含量有限,为了达到较好的沉淀效果, 采用(NH4)2SO4固体进行盐析,考察了(NH4)2SO4浓度(质量分数10%、20%、30%、40%、50%、60%、70%、80%、90%)因素对绿豆GAD粗提液上清液和沉淀中GAD酶活性的影响。
1.3.4.2DEAE树脂分离纯化GAD
(1)最佳树脂的选择实验
在250 ml具塞锥形瓶中加入预先处理好的三种树脂各15 g,分别加入经硫酸铵沉淀纯化后的绿豆GAD溶液50 ml,使树脂完全浸泡,封好放入180 r/min、30℃恒温振荡器中振荡12 h后,吸取上清液1 ml,与4 ml双缩脲试剂混合后,静置30 min,在540 nm下分光光度测定蛋白质浓度,计算树脂的吸附率。
吸附率=(C-C0)/C×100%,
式中,C、C0分别为吸附前后的蛋白质质量浓度,mg/ml。
(2)静态吸附曲线实验
向250 ml锥形瓶中加入5 g筛选出来的树脂,向其中加入不同pH值(4.0、5.0、6.0、7.0、8.0、9.0、10.0)条件下的绿豆GAD提取液100 ml,用塞子封好后放入恒温摇床中振荡(30℃,180 r/min),隔1、4、8、12 h取液,测定吸附后溶液中的蛋白质含量,计算绿豆GAD吸附率,绘制静态吸附曲线。
(3)静态解吸验及洗脱剂的选择
按照1.3.4.2中的(2)进行静态吸附,恒温振荡器吸附震荡12 h,待其充分吸附后去除过滤,再将吸附后的树脂重新置于250 ml锥形瓶中,选择不同离子浓度的洗脱溶剂进行洗脱,洗脱剂分别选用离子浓度为0、0.2、0.4、0.6、0.8 mol/L的氯化钠溶液各100 ml,在同条件下振荡,待解吸10、20、30、40、50 min后,测定解吸液的体积及蛋白质含量,计算树脂解吸前后的蛋白质质量,绘制静态解吸曲线。
解吸率=(m0-m)/m0×100%,
式中,m0为解吸前的树脂内的蛋白质量,mg;m为解吸后树脂内的蛋白质量,mg。
(4)动态吸附和解吸实验
将处理过的DEAE-Cellulose树脂装入1.0 cm×100 cm的层析柱中,在30℃条件下将 pH7.0的绿豆GAD提取液分别以1.0、1.5、2.0 ml/min流速上柱,并检测流出液的蛋白质质量浓度,绘制动态解吸曲线,确定最佳进样体积及进样质量。
1.3.4.3葡聚糖凝胶层析纯化
实验选择葡聚糖凝胶Sephadex G-100作为层析纯化的树脂,将预处理后的葡聚糖凝胶Sephadex G-100装入1.6 cm×100 cm的玻璃层析柱,然后洗脱3个柱体积的超纯水。上样5 ml,洗脱流速0.2 ml/min,于280 nm 下测吸收度,绘制洗脱曲线,并收集各峰的洗脱液,冻干后测GAD酶活性。
1.4 数据处理
每组实验都进行3组平行实验,采用 Origin 8.5软件分析数据并作图。利用SPSS Statistics 22 软件对数据进行差异显著性分析,P<0.05 为显著性差异。
2 结果与分析
2.1 GABA浓度标准曲线的确定
衍生剂其衍生物的液相色谱图见图1。
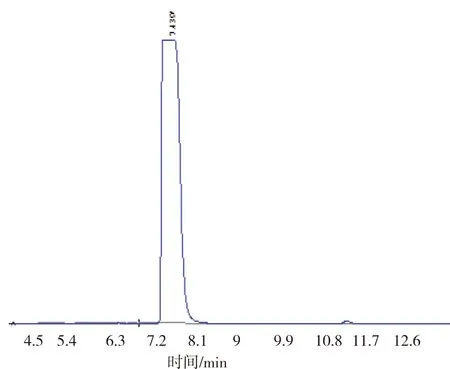
(a)
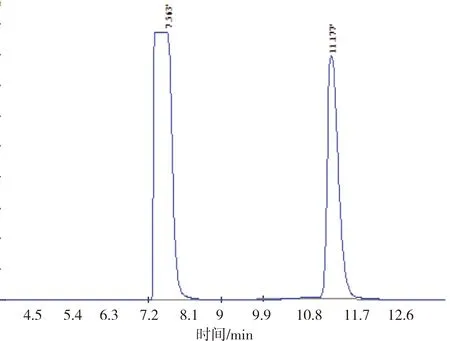
(b)
将衍生剂和衍生化处理后的样品进行液相色谱分析发现,衍生剂峰在7.348 min处,衍生物的峰在10.953 min处。将浓度为0.08、0.16、0.24、0.32、0.40、0.48、0.56、0.64、0.80 g/L GABA标准品分别进行衍生化处理,进样检测,计算GABA衍生化产物的峰面积,以GABA浓度为横坐标,峰面积为纵坐标,绘制标准曲线,得到回归方程:
Y=1.112 7X+0.000 286,
R2=0.998 92,
线性范围为0.08~0.80 g/L,精密度RSD为0.054%。
2.2 绿豆GAD粗提液的衍生化处理实验
绿豆GDA粗提液衍生化反应液相色谱图见图2。
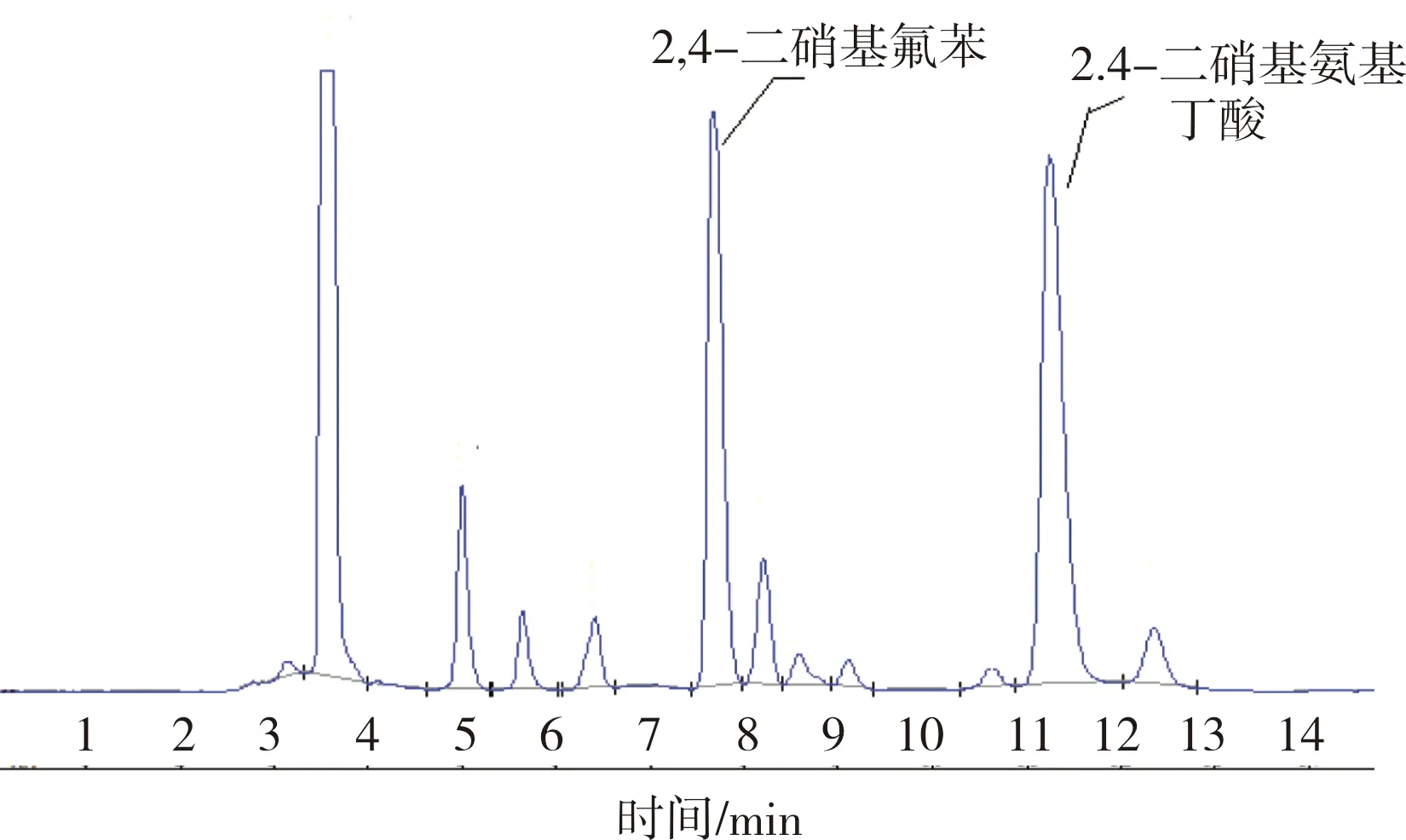
图2 绿豆GDA粗提液衍生化反应的液相色谱图
绿豆组织的酶活测定反应液经上述衍生化反应后,用RP-HPLC测定生成的GABA含量,并由此来计算植绿豆的GAD活力。在选定的衍生化和色谱条件下,绿豆样品中的GABA衍生物得到良好的分离效果,且RSD=0.91%。这表明FDNB衍生测定方法适用于绿豆中GAD活性的测定。

2.3 (NH4)2SO4沉淀纯化绿豆GAD
(NH4)2SO4浓度对绿豆GAD酶活力的影响见图3。

图3 (NH4)2SO4浓度对绿豆GAD酶活力的影响
由图3可知,当(NH4)2SO4质量分数为10%~30%时,上清液中的酶活力基本没有下降,而沉淀中的蛋白质在(NH4)2SO4质量分数为10%~20%时,也没有GAD酶活性。这表明较低浓度的(NH4)2SO4并不能有效沉淀出具有GAD酶活性的蛋白质。随着(NH4)2SO4浓度的继续升高,上清液中的酶活性开始下降。当质量分数超过70%时,上清液的GAD酶活性几乎完全丧失;而沉淀中的酶活性达到最大,且梯度间差异不显著。这表明(NH4)2SO4的质量分数为70%~90%时,能将具有谷氨酸脱羧酶的蛋白质沉淀下来。考虑到成本问题,将(NH4)2SO4的质量分数70%作为较适纯化条件。
2.4 DEAE-Cellulose法纯化绿豆GAD
2.4.1树脂类型对绿豆GAD吸附率的影响
不同树脂对绿豆GAD的吸附率见图4。

图4 不同树脂对绿豆GAD的吸附率
由图4可知,不同树脂类型对绿豆GAD的吸附率不同,DEAE-Cellulose树脂对绿豆GAD的吸附率最高。这与树脂的制备条件、活性基团的组成、种类、形状和大小有关。因此,后续实验选择DEAE-Cellulose树脂进行绿豆GAD的纯化实验。
2.4.2不同pH值的绿豆GAD溶液静态吸附曲线
不同pH值条件和吸附时间下的绿豆GAD溶液静态吸附率见图5。

图5 不同pH值条件和吸附时间下的绿豆GAD溶液静态吸附率
由图5可知,绿豆GAD溶液的pH值和吸附时间对吸附率均具有显著影响。在同一pH值的条件下,随着吸附时间的延长,DEAE-Cellulose树脂对绿豆GAD的吸附率呈现上升趋势。在同一吸附时间的条件下,随着pH值的升高,DEAE-Cellulose树脂对绿豆GAD的吸附率呈现先上升后下降再上升的趋势,但均在绿豆GAD溶液pH值为7时达到最高。这是因为谷氨酸脱羧酶属于两性物质,在不同pH值的环境下与水溶液的离子化程度不同,其暴露的基团和表面电荷的正负及带电量均不相同,进而影响树脂与GAD之间的相互结合作用,造成树脂的吸附效果不同[14-15]。因此,选择绿豆GAD溶液的pH值为7.0作为较适pH值。
2.4.3静态解吸实验及解吸剂的选择
不同离子浓度的洗脱剂对绿豆GAD解吸率的影响见图6。
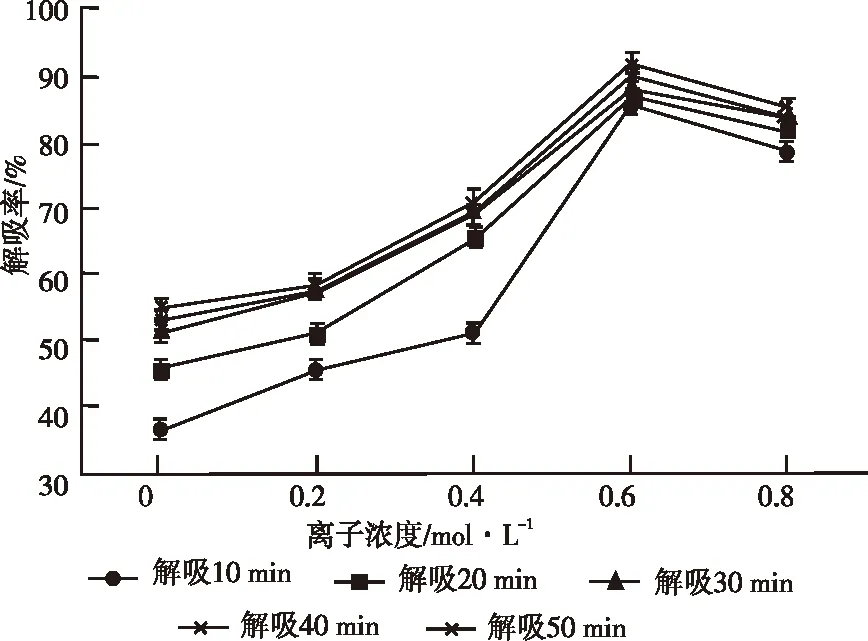
图6 不同离子浓度的洗脱剂对绿豆GAD解吸率的影响
由图6可知,随着离子浓度的提高,解吸剂对绿豆GAD的解吸率呈现先升高后下降的趋势,且在离子浓度为0.6 mol/L时达到最高。随着解吸时间的延长,解吸剂对绿豆GAD的解吸率呈现先升高后趋于平稳的趋势;且解吸时间超过30 min后,解吸量基本趋于平稳。这是随着解吸时间的延长,解吸液和吸附在树脂上的GAD接触的几率就更多,更易将GAD从树脂上洗脱下来[12,16-17]。但是当达到一定的解吸时间后,树脂对GAD的吸附和解吸达到动态平衡,再随着解吸时间的延长,其解吸量不会随之增加。因此,选择解吸液中离子浓度0.6 mol/L作为较适的洗脱剂浓度。
2.4.4DEAE-Cellulose树脂动态吸附与解吸实验
2.4.4.1最佳进料速度及进料量的选择
不同流速和进料量对绿豆GAD吸附率的影响见图7。

图7 不同流速和进料量对绿豆GAD吸附率的影响
由图7可知,随着进料量的增大,树脂对绿豆GAD吸附率呈现下降趋势;随着流速的增大,树脂对绿豆GAD吸附率现下降趋势,且流速超过1.5 ml/min后,吸附量急剧下降。这主要是因为树脂的最大吸附量是一定的,当进料量过小,无法对资源进行充分利用,而进料量过大超过了树脂的最大吸收范围后会造成原料的浪费[18-19]。进料流速直接决定了吸附物质向树脂的扩散程度和结合率,当流速过低,虽然样品可以和树脂进行充分接触,但是会延长工业化处理时间和生产成本;而流速过高,会造成吸附物质还尚未及时和树脂进行相互结合就被冲刷下来,造成吸附量太少[20]。因此,综合考虑原料成本、生产周期和吸附量多方面因素,选择上样流速1.5 ml/min为较适流速,进料量为6 ml为较适进样量。
2.4.4.2动态解析实验
绿豆GAD的动态解析曲线见图8。
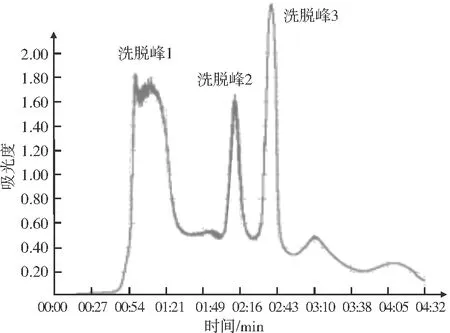
图8 绿豆GAD的动态解析曲线
由图8可知,在pH 7.0的缓冲溶液和离子强度为0.6 mol/L的洗脱剂条件下,绿豆GAD共被洗脱出三个蛋白质峰。分别收集三个峰的蛋白质溶液进行GAD酶活性检测发现,洗脱峰2具有较高的酶活性。这表明通过DEAE-Cellulose树脂分离纯化后,具有GAD酶活性的组分主要集中在洗脱峰2内。由于洗脱峰1和洗脱峰3的酶活性较小,因此只收集洗脱峰2进行后续纯化实验。
2.5 葡聚糖凝胶Sephadex G-100纯化绿豆GAD
绿豆GAD的Sephadex G-100纯化色谱图见图9。
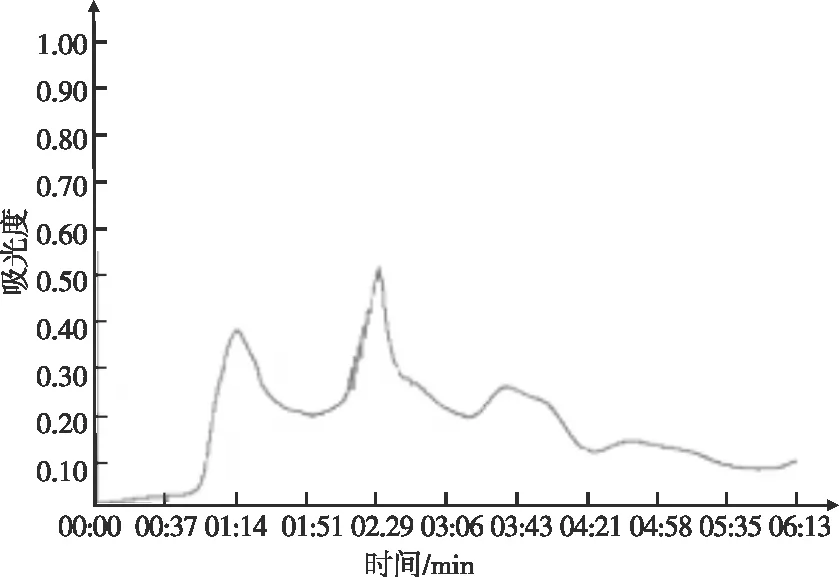
图9 绿豆GAD的Sephadex G-100纯化色谱图
由图9可知,绿豆GAD经葡聚糖凝胶色谱纯化后,得到三个分子量的小峰,富集各峰值管的蛋白质溶液,透析脱盐后冷冻干燥。通过GAD酶活性检测发现,峰1和峰2具有较高的酶活性,并将峰1和峰2收集得到的蛋白质分别命名为GAD1和GAD2。这表明经过葡聚糖凝胶层析柱洗脱分离后,得到2个具有谷氨酸脱羧酶活性的组分,即GAD1和GAD2。
2.6 GAD分离纯化结果
分别测定绿豆GAD 分离纯化过程中,各步所收集酶液的酶活力、蛋白质含量,结果见表1。
由表1可知,色谱法纯化后的绿豆GAD1纯化倍数为100.63,酶的比活力达到240.56 U/mg,酶回收率为17.77%;GAD2的纯化倍数为118.52,酶的比活力为283.32,酶回收率为20.08%。由此可见,通过(NH4)2SO4分级沉淀、DEAE-Cellulose树脂纯化、葡聚糖凝胶Sephadex G-100纯化可进行绿豆GAD的分离纯化,并得到了绿豆中的两种GAD同工酶。
3 结论
本实验采用柱前衍生法测定GABA含量的标准曲线为:Y=1.112 7+0.000 286,R2=0.998 92,线性检测范围为0.08~0.80 g/L,精密度RSD为0.054%;并建立了硫酸铵沉淀法、DEAE-Cellulose离子交换色谱法、葡聚糖凝胶Sephadex G-100层析法分离纯化体系,经纯化后得到2种绿豆GAD同工酶,绿豆GAD1纯化倍数为100.63,酶的比活力达到240.56 U/mg,酶回收率为17.77%;GAD2的纯化倍数为118.52,酶的比活力为283.32,酶回收率为20.08%。

