双氢青蒿素对SLE小鼠巨噬细胞mRNAm6A甲基化的影响研究
李姝玉 杨诗帆 洪岭
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种免疫紊乱引起的自身免疫性疾病,常引起多器官损伤。目前临床只能使用会引发严重不良反应的激素类和免疫抑制剂类药物治疗SLE,探寻SLE的特效药物是科研工作者关注的焦点[1]。作为传统中药的代表,青蒿素在治疗和控制疟疾上效果显著,为世界人民的健康做出了巨大的贡献。近来研究发现青蒿素对SLE的治疗也具有一定的效果。青蒿素类衍生物可以抑制SLE小鼠产生自身抗体、减轻组织损伤并延长SLE小鼠的生命[2]。DNA甲基化在SLE发生、发展中起重要作用,低甲基化状态可诱导SLE发病或加重。N6-腺嘌呤(m6A)甲基化是真核生物中最广泛的一种化学修饰[3]。m6A甲基化修饰主要位于外显子的终止密码子及3′-UTRs附近区域[4-5]。m6A甲基化修饰可影响mRNA的剪接、出核、稳定性和翻译等RNA代谢过程,并且经过甲基化修饰后的mRNA可调节基因的表达。m6A甲基化修饰的可逆调控和发挥其生物学功能需要甲基化转移酶(METTL3)、去甲基化修饰酶(ALKBH5和 FTO)以及特异性的识别甲基化位点蛋白(TLR7和TLR9)的参与。基于此,本研究采用实验室研究的方法,探讨双氢青蒿素是否通过影响SLE小鼠巨噬细胞mRNA m6A甲基化修饰水平发挥治疗作用,现报道如下。
1 材料和方法
1.1 材料 6周龄SPF级雌性MRL/lpr SLE小鼠20只,购自上海南方模式实验动物有限责任公司。DMSO和双氢青蒿素(纯度98%)购自美国Sigma公司;Antimouse METTL3、Anti-mouse ALKBH5、Anti-mouse FTO、Anti-mouse TLR7、Anti-mouse TLR9 和 Anti-mouse β-Actin均购自于美国Abcam公司;m6A(202003)抗体购自德国Synaptic Systems公司。DMEM和FBS均购自美国PAA公司。实时荧光定量PCR仪购自美国ABI公司;化学发光凝胶成像系统购自美国Bio-Rad公司。
1.2 方法
1.2.1 小鼠巨噬细胞的分离 具体参照文献[6]。将3%脱水硫羟乙酸培养基2ml注入小鼠腹腔,3~4d后将小鼠以颈椎脱臼法处死;处死后的小鼠以75%乙醇溶液浸泡5min,取出小鼠,腹面朝上,用镊子撕开皮肤,完全暴露腹膜;然后用20ml注射器往腹腔注入10ml无血清培养基,针尖朝上,避开肠道和脂肪,从不同方向反复抽洗腹腔液,重复此步骤2次,将收集的腹腔液置于50ml的离心管;细胞悬液以1 200 r/min离心5min,用含有10%FBS的DMEM培养基重悬后进行细胞计数;细胞悬液铺入6孔培养板,37°C培养1h后用预热培养基洗1次,留下贴壁细胞即为新鲜分离的小鼠腹腔巨噬细胞。以上细胞均在含10%FBS的DMEM培养基中维持生长,置于37℃、5%二氧化碳的培养箱中培养。
1.2.2 巨噬细胞mRNA m6A甲基化水平检测 采用Dot Blot法。将双氢青蒿素稀释到培养基中至终浓度分别为 20、40、60μmol/L,分别培养巨噬细胞 72h,设为观察组;另采用空白培养基培养巨噬细胞72h,设为对照组。两组巨噬细胞均用Trizol试剂提取总RNA,然后用多聚胸腺嘧啶(oligo-dT)磁珠纯化获得mRNA;将各组1μg mRNA滴加到PVDF膜上,紫外线交联后用含5%牛血清白蛋白(BSA)的TBST缓冲液封闭2h,加入用封闭液稀释后的m6A抗体4℃孵育过夜,TBST洗膜3次;然后加入偶联辣根过氧化物酶的兔二抗室温孵育2h,TBST洗膜3次,最后用ECL法显影。用ImageJ软件对曝光图片进行灰度分析,将对照组的灰度定义为1,观察组做相对应的均一化处理,得出甲基化水平数据。
1.2.3 巨噬细胞 METTL3、ALKBH5、FTO、TLR7、TLR9 mRNA表达水平检测 采用RT-PCR法。两组巨噬细胞总RNA的提取按Trizol试剂说明书进行。用PBS洗2次细胞,按1×107个细胞加入1ml Trizol试剂抽提;加入0.2ml氯仿震荡混匀,室温静置3 min后4℃14 000 r/min离心15min;吸取上层水相置于新管中,加入0.5ml异丙醇,充分混匀,室温静置10min后再离心30 min弃上清液,沉淀以75%乙醇溶液洗涤1次后空气干燥;RNA溶解于40μl DEPC水中,用Nanodrop分光光度计(美国赛默飞公司)进行浓度和纯度测定后保存于-80℃。取 2μg细胞总RNA按照反转录试剂盒(日本TOYOBO公司)说明书逆转录合成 cDNA,于 42℃孵育30min,反转录酶经99℃灭活5 min后加入80μl双蒸水稀释混匀,作PCR反应的模板。采用SYBRGreen荧光定量PCR混合试剂(日本TOYOBO公司)进行定量PCR扩增。PCR扩增反应体系(20μl):2×SYBR Premix Ex TaqTM(10μl),上游引物(10μmol/L,1.0μl),下游引物(10μmol/L,1.0μl),模板 cDNA(8.0μl)。反应条件:95(3min);40 个循环(95℃,15s);60℃,40s(收集荧光)。mRNA 相对表达水平是以β-Actin做参照,即每次定量PCR的Ct值减去对应样品中β-Actin的Ct值,样品扩增的倍数变化计算采用2-ΔΔCt法。溶解曲线分析确认定量PCR引物扩增的特异性。引物序列如下:ALKBH5 F:5′-CGCGGTCATCAACGACTACC-3′,R:5′-ATGGGCTTGAACTGGAACTTG-3′;METTL3 F:5′-CTGGGCACTTGGATTTAAGGAA-3′,R:5′-TGAGAGGTGGTGTAGCAACTT-3′;FTO F:5′TTCATGCTGGATGACCTCAATG-3′,R:5′-GCCAACTGACAGCGTTCTAAG-3′;TLR7 F:5′-ATGTGGACACGGAAGAGACAA-3′,R:5′-GGTAAGGGTAAGATTGGTGGTG-3′;TLR9 F:5′-ATGGTTCTCCGTCGAAGGACT-3′,R:5′-GAGGCTTCAGCTCACAGGG-3′;HPRT F:5′-TCAGTCAACGGGGGACATAAA-3′,R:5′-GGGGCTGTACTGCTTAACCAG-3′;β-Actin F:5′-AGTGTGACGTTGACATCCGT-3′,R:5′-GCAGCTCAGTAACAGTCCGC-3′。
1.2.4 巨噬细胞 METTL3、ALKBH5、FTO、TLR7、TLR9蛋白表达水平检测 采用Western blot法。将两组巨噬细胞均用PBS洗1遍;在细胞裂解液中加入适量鸡尾酒(cocktail)蛋白酶抑制剂和苯甲基硫酰氟(PMSF),混匀加入到待收的细胞中,冰上孵育5min后,刮下细胞并置于离心管中4℃震荡,以最大转速4℃离心15min,取上清液,采用BCA蛋白定量试剂盒测定蛋白浓度,加入6×上样缓冲液,100℃煮5 min,制备好的样品于-20℃保存备用。取30μg总蛋白进行电泳分离,将蛋白质转到PVDF膜上。用含5%BSA的TBST封闭2h,加入用封闭液稀释后的待测蛋白的抗体4℃孵育过夜,TBST洗膜3次,然后加入偶联辣根过氧化物酶的相应二抗室温孵育2h,TBST洗膜3次,最后用ECL法显影[6-7]。用ImageJ软件对曝光后的灰度图片进行灰度分析,将对照组的灰度定义为1,观察组做相对应的均一化处理,得出蛋白表达水平数据。
1.2.5 巨噬细胞TLR7和TLR9 mRNA m6A甲基化修饰水平检测 采用m6A-qRT-PCR法。实验操作参考文献[8-9]。两组巨噬细胞总RNA的提取按Trizol试剂说明书进行。总RNA先用多聚Poly(A)选择纯化mRNA(FastTrack MAG micro mRNA分离试剂盒,美国Invitrogen公司),但mRNA不随机打断片段化,以便于用oligo-dT逆转录与PCR扩增。然后按照m6A免疫共沉淀和测序的实验操作,但不构建cDNA文库。为比较m6A丰度的变化,相对富集首先做归一化处理,然后再在m6A免疫沉淀的样品数据之间进行比较。
1.3 观察指标 观察并比较观察组与对照组巨噬细胞(1)mRNA m6A 甲基化修饰水平;(2)METTL3、ALKBH5和 FTO mRNA 表达水平;(3)METTL3、ALKBH5 和 FTO蛋白表达水平;(4)TLR7和TLR9 mRNA m6A甲基化修饰水平;(5)TLR7和TLR9蛋白表达水平。
1.4 统计学处理 应用GraphPad Prism 8统计软件,所有数据均由独立的3次重复实验得到。计量资料以表示,组间比较采用两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组巨噬细胞mRNA m6A甲基化修饰水平比较 与对照组比较,观察组巨噬细胞mRNA m6A甲基化修饰水平明显降低(P<0.05),见图1。
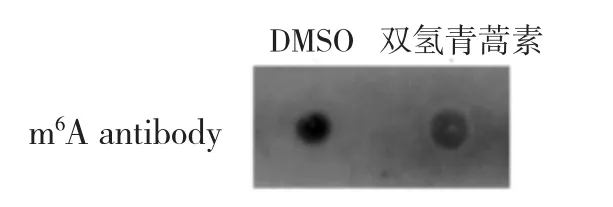
图1 两组巨噬细胞mRNA m6A甲基化修饰水平比较Dot Blot图
2.2 两组巨噬细胞 METTL3、ALKBH5、FTO mRNA表达水平比较 见表1。
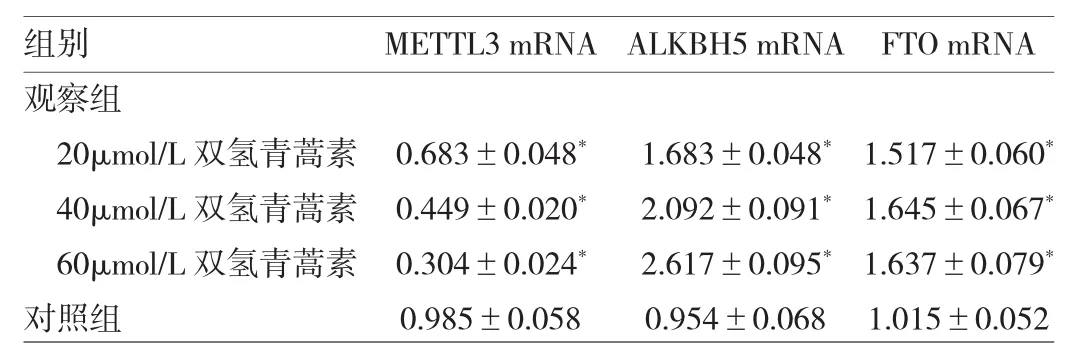
表1 两组巨噬细胞METTL3、ALKBH5、FTOmRNA表达水平比较
由表1可见,与对照组比较,双氢青蒿素处理后观察组巨噬细胞METTL3 mRNA表达下调,而ALKBH5、Fto mRNA表达上调,差异均有统计学意义(均P<0.05);且双氢青蒿素处理浓度越高,METTL3 mRNA表达水平越低,ALKBH5 mRNA表达水平越高,而FTO mRNA表达水平对浓度不敏感。
2.3 两组巨噬细胞METTL3、ALKBH5、FTO蛋白表达水平比较 见图2。
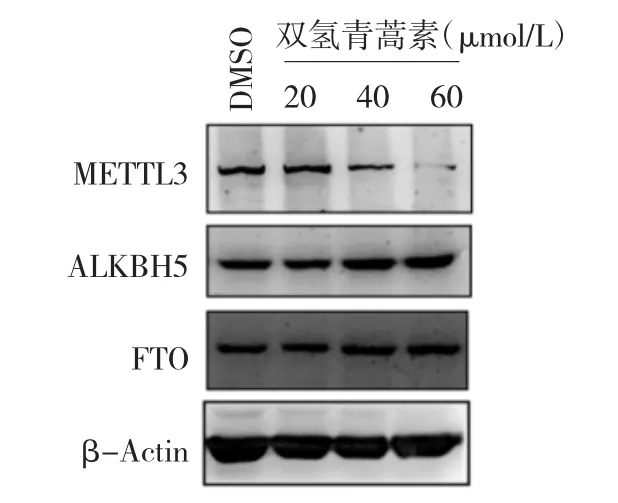
图2 两组巨噬细胞METTL3、ALKBH5、FTO蛋白表达水平比较电泳图
由图2可见,与对照组比较,双氢青蒿素(40、60μmol/L)处理后观察组巨噬细胞中METTL3蛋白表达下调,而ALKBH5蛋白表达上调,对FTO蛋白表达几乎没有影响;且双氢青蒿素浓度越高,METTL3蛋白表达水平越低,ALKBH5蛋白表达水平越高。
2.4 两组巨噬细胞TLR7、TLR9 mRNA m6A甲基化修饰水平比较 见表2。

表2 两组巨噬细胞TLR7、TLR9 mRNA m6A甲基化修饰水平比较
由表2可见,与对照组比较,用60μmol/L双氢青蒿素处理后,观察组巨噬细胞TLR7、TLR9 mRNA m6A甲基化修饰水平明显下调。
2.5 两组巨噬细胞TLR7、TLR9蛋白表达水平比较见图3。
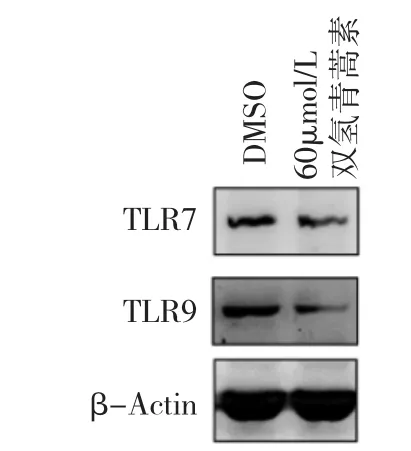
图3 两组巨噬细胞TLR7、TLR9蛋白表达水平比较电泳图
由图3可见,与对照组比较,用60μmol/L双氢青蒿素处理后,观察组巨噬细胞TLR7、TLR9蛋白表达水平明显下调。
3 讨论
SLE是一种发生于多器官、以病情反复为特征的自身免疫性疾病,其主要发病机制是机体的细胞凋亡异常以及B、T淋巴细胞活化阈值的改变,导致自我耐受能力下降和自身抗体的过量产生,随后诱发一系列炎症反应从而导致多个组织器官的损伤[10]。METTL3是m6A甲基化过程中关键的甲基化酶,其酶活性和表达与m6A甲基化修饰水平呈正相关,ALKBH5和FTO是重要的m6A去甲基化修饰蛋白[11]。本研究发现在SLE小鼠的巨噬细胞中,60μmol/L的双氢青蒿素能通过抑制METTL3的mRNA和蛋白的表达,促进ALKBH5和FTO的表达,进而从巨噬细胞整体水平上抑制mRNA m6A的甲基化修饰水平,但双氢青蒿素如何调控METTL3、ALKBH5和FTO表达的机制需要进一步的探讨。
屠呦呦团队发现双氢青蒿素治疗SLE的一期临床疗效显著,且无明显不良反应。天然免疫系统在SLE的发病机制中起到重要的作用,特别是Toll样受体,其异常表达或过度激活均可能导致SLE的发病[12-13]。研究发现,SLE患者的外周血中Ⅰ型干扰素浓度偏高[14-15]。双氢青蒿素可能通过抑制TLR4/IRF/IFN信号通路,从而抑制脂多糖(LPS)诱导的炎症因子和Ⅰ型干扰素的表达,进而对SLE小鼠发挥治疗作用。青蒿素及其类似物的抗炎作用是通过抑制TLR受体和关键炎症信号转导途径,包括核因子κB(NF-κB)、STAT1和增殖蛋白激酶(MAPK)等[14-15]。TLR7和TLR9这两个核酸受体能感受细胞内和外的核酸,进而触发下游的炎症信号通路。本研究发现用60μmol/L双氢青蒿素处理巨噬细胞后能明显的降低TLR7和TLR9上的m6A甲基化修饰水平,进而抑制TLR7和TLR9蛋白的表达,从而缓解巨噬细胞TLR7和TLR9表达异常所触发的炎症,减缓SLE的症状。本研究主要是在体外细胞实验中证实了双氢青蒿素对SLE小鼠的治疗作用,在小鼠体内探讨双氢青蒿素生物学作用将是接下来的研究方向。
综上所述,双氢青蒿素可能通过调控巨噬细胞mRNA m6A甲基化修饰水平抑制TLR7和TLR9蛋白表达的机制发挥治疗SLE的作用。

