吡哆胺干预对2型糖尿病大鼠行为及认知功能改变的影响
贾 贺 李惠勉
郑州大学第二附属医院,河南 郑州 450003
2型糖尿病是一种慢性代谢性疾病,这种疾病在病程逐步进展之后,会对全身多系统造成损害,其中以中枢神经系统损伤最为普遍,脑卒中是最为常见的形式,在发病早期其最主要的临床表现是认知功能障碍。2型糖尿病在临床上的最主要特征是并发大脑损伤,并由此引发认知和行为障碍,存在相应的大脑血管重塑、血管损伤、神经元形态的病理生理学改变、突触可塑性异常、脑白质病变等[1-3]。研究显示,2型糖尿病是认知功能障碍的独立危险因素。通过进行横断面研究显示,2型糖尿病患者普遍会出现某个或多个方面的认知功能减退,尤其是学习、记忆以及空间执行能力等方面,出现显著功能减退[4]。
吡哆胺(pyridoxamine )具有抑制AGEs 的生成的作用[5-6]。原理是其可以作为亲核试剂,捕获Maillard 反应中产生的活性羰基,生成具有良好的稳定性的反应产物含呱嗪环的五元环加合物,抑制AGEs生成。相关研究显示,对于延缓糖尿病视网膜并发症,吡哆胺具有良好的临床效果[7-8],但目前缺少其在糖尿病并发脑损伤中的相关研究。因此,本次研究通过实验对吡哆胺在2型糖尿病大鼠神经功能方面的作用进行探讨。
1 材料与方法
1.1实验动物和主要仪器8~9周龄SD大鼠,体质量180~200 g(郑州大学实验动物中心提供),吡哆胺(美国Sigma公司),One-Touch-Ⅱ型血糖仪及试纸(美国强生公司),Morris水迷宫仪。
1.22型糖尿病动物模型的制备及分组[9]采用随机法对SD大鼠分为3组,分别作为对照组、模型组(糖尿病组)和干预组(吡哆胺组),每组8只。3组大鼠的喂养方式如下:对照组作为对照,按照常规的大鼠喂养方式提供饮食;其余2组作为实验组,建立糖尿病大鼠模型,按照文献[10-11]方法建立模型,采用高脂高糖的饮食进行喂养。饮食中各种物质的比例为猪油:蔗糖:胆固醇:胆盐:普通饲料=10:20:2.5:1:66.5,在喂养6周以后对其进行血糖测定,测定使用ONETOUCH血糖仪。糖尿病模型的标准:随机非空腹血糖>16.7 mmol/L。成功建立糖尿病模型后,对干预组使用吡哆胺溶液进行灌胃处理,具体的方式是每天用剂量为150 mg·kg-1·min-1的吡哆胺溶液进行灌胃。模型组将吡哆胺换为生理盐水,其他均保持不变。对照组不进行灌胃。
1.3行为功能评价采用卒中指数评分[12]评价行为功能。于12周、16周观察各组大鼠神经症状,计算卒中指数评分,具体的评分方式如表1所示。
1.4认知功能评价[13]12周、16周时分别对各组大鼠进行定位航行训练,训练4 d,每天训练3次,训练在Morris水迷宫中进行。具体的训练过程如下:每天进行按此训练,每次训练选择不同的入水点,训练时长为120 s。如大鼠能够在120 s内找到平台,则保持其在平台上停留,停留时间15 s;如果在120 s内其未能找到平台,则需要将其诱导到平台上,并使其停留1 s,一次训练结束。按照相同的方法连续训练4 d,并对每只大鼠的潜伏期进行详细记录,潜伏期越短,路程越近,说明大鼠学习记忆能力越好[14]。

2 结果
2.1各组大鼠卒中指数评分比较对各组大鼠进行评分,结果如表2所示。其中,对照组内的所有大鼠均未出现神经功能障碍症状;模型组、干预组大鼠卒中指数显著高于对照组(P<0.05或P<0.01);干预组大鼠卒中指数较模型组明显下降。通过对结果进行分析认为,2型糖尿病大鼠会出现神经功能障碍,而通过使用吡哆胺进行干预,能够有效改善其神经功能。
2.2各组大鼠Morris水迷宫评价结果通过Morris水迷宫对大鼠进行评价,结果见表3、表4。相对于对照组,模型组、干预组在潜伏期方面出现明显增加,相应的穿越平台位置的次数出现显著降低,差异有统计学意义(P<0.05或P<0.01)。相对于模型组,干预组潜伏期明显缩短,穿越平台次数显著增加(P<0.05)。
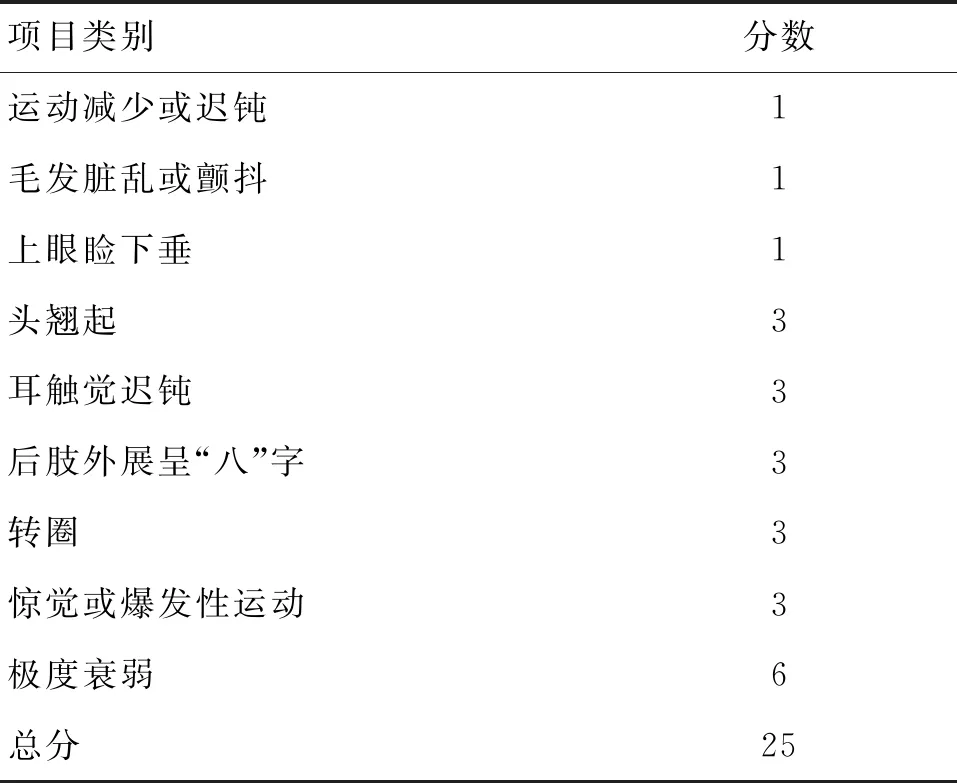
表1 卒中指数评价表
注:评分0~3分,为无症状;3~9分,可能存在脑卒中性损伤;评分>10分,有明显症状,说明其出现脑卒中损伤
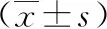
表2 各组大鼠卒中指数比较
注:与对照组相比,#P<0.05,*P<0.01;与模型组相比,△P<0.05
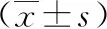
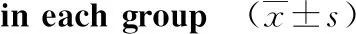

组别n12周16 周对照组86.7±1.716.7±2.03模型组83.6±1.31*1.8±0.25*干预组86.1±1.66#△4.3±1.23#
注:与对照组相比,#P<0.05,*P<0.01;与模型组相比,△P<0.05
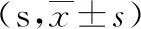


组别n12周16 周对照组831.06±24.1632.97±22.42模型组884.65±24.13#94.13±21.34*治疗组852.83±15.12#△51.24±21.45#△
注:与对照组相比,#P<0.05,*P<0.01;与模型组相比,△P<0.05
3 讨论
糖尿病是脑卒中危险因素之一[15-16],其也是影响认知功能的一个重要独立危险因素[1]。相关研究显示,糖尿病患者出现认知功能障碍的可能性达70%[17]。通过对糖尿病患者进行磁共振检查,可以发现其会出现脑组织萎缩[18]。研究发现,糖尿病患者脑组织会出现神经元丢失及轴突变性[19]。慢性高血糖、氨基化终产物等代谢紊乱,引起颅内大血管及微血管的病变,血管内皮不稳定、通透性增加、病理血管生成[20-22],造成慢性脑缺血缺氧,这些病理改变都与糖尿病脑损伤有关。研究发现,糖基化终产物(AGEs)是最为主要的致病物质,其能够和细胞膜上特异性受体结合激活细胞内多种信号转导机制,促进氧化应激反应,进而产生活性氧自由基,促进炎症因子表达,最终造成血管内皮细胞损伤及神经损伤[23]。
吡哆胺是维生素B6的一种天然存在形成,是AGEs形成的一种抑制剂[23],可抑制Amadori产物(糖基化中间产物) 转变成AGEs,能通过俘获低分子量的活性羰基前体,进而抑制AGEs的形成[24]。在乙醛和核糖核酸酶的反应过程中,吡哆胺抑制赖氨酸残基修饰、保护核糖核酸酶的活性,抑制糖基化反应,明显抑制AGEs的形成,并随剂量增加,其抑制作用明显增强,进而阻断其与受体结合后激发的多种信号转导机制[25]。在糖尿病肾病大鼠模型中,吡多胺能与AGEs的前体反应,增强依那普利的作用,减缓糖尿病肾病的进展[26]。吡哆胺无明显的直接降糖作用,但可降低大鼠血清及视网膜AGEs的含量,减少AGEs血管壁及组织堆积,还可以降低AGEs受体的表达,进而减少对血管及视网膜的损伤。研究发现,AGEs与受体RAGE的结合可激活核因子κB,诱导多种功能蛋白表达增加,使内皮细胞的通透性增加,进而促进炎性细胞黏附,引起血管内皮炎性反应,加速血管内皮损伤,最终可导致动脉粥样硬化斑块形成[27],但吡哆胺可很好抑制糖尿病大鼠动脉粥样硬化斑块的形成并减缓其进展,改善血管损伤[26]。目前已经在糖尿病患者的Ⅱ期临床试验中肯定了吡哆胺的有效性及安全性[28]。
本文显示,2型糖尿病大鼠会出现明显脑神经损伤,并出现一定的认知功能障碍。在使用吡哆胺进行干预后,2型糖尿病大鼠的脑神经损伤情况以及认知行为障碍问题得到明显改善。因此,推测吡哆胺能够抑制AGEs生成,减少其在脑微血管壁上的积聚,降低其对脑微血管的影响,改善血流灌注,从而改善糖尿病脑缺血缺氧状态及大脑海马区神经损伤的进程。

