鱼皮胶原蛋白肽复方制品对小鼠免疫功能的影响
石举然,李丽杰*,张曾亮,王 敏,卢 赛,杨 迪,王鲁慧,邹圣灿
1颐海产业控股有限公司,青岛 266100;2内蒙古医科大学中医学院,呼和浩特 010110
机体免疫功能是一个与衰老有密切关系的因素,一般在30岁左右开始减退,这种变化是悄然、缓慢、持续进行的,生活节奏加快与竞争压力增大加剧了这个变化趋势。因此,增强免疫功能产品的开发显得尤为重要。增强免疫功能的产品原料来源广泛,其中海洋资源及天然植物提取物效果良好但开发利用程度较低,如鱼皮胶原蛋白肽[1]、壳寡糖[2]、人参[3]、黄芪[4]、当归[5]等均具有一定的增强免疫作用,且已在相关领域内有所应用。
鱼皮胶原蛋白肽是鱼皮胶原蛋白经分子链解体、断裂得到的一种产物,分子量较小,易于吸收,是一种新型来源的胶原蛋白肽,因其具有安全性好等特点,已经成为研究热点,但是目前其抗氧化功能研究较多,而免疫功能研究相对较少。Si等[6]研究了不同途径给予胶原蛋白肽对小鼠免疫功能的影响,结果发现腹腔注射和灌胃给予小鼠胶原蛋白肽都对小鼠免疫功能指标有显著影响,且腹腔注射效果更加显著。壳寡糖(COS)是壳聚糖经酶促反应或者化学降解得到的低聚物,聚合度2~20,是唯一带正电荷的碱性氨基寡糖,近年来发现其具有免疫调节、抗炎、抗肿瘤等多种活性[7],聚合度为3~8的COS在体外可显著增强原代264.7巨噬细胞的增殖活性和对中性红细胞的吞噬能力,小鼠口服COS后脾脏指数和血清免疫球蛋白IgG含量增加[8]。Singh等[9]通过实验研究表明,人参具有增强小鼠免疫力的作用,在特异性抗体形成、淋巴细胞增殖及巨噬细胞吞噬能力增强等多方面均有所体现。黄芪多糖(APS)是黄芪发挥效应的主要成分,经体内代谢后分解为单糖或低聚糖,生物学功能呈现多样性,具有增强机体免疫、提高抗氧化能力、抗炎症等多种药理学作用,APS已被广泛应用于临床医药领域[10]。Zhou等[4]研究表明,黄芪多糖能通过促进机体免疫器官发育和增强T细胞、B细胞及自然杀伤细胞等免疫细胞的功能来提高动物细胞免疫和体液免疫水平。当归为甘肃道地药材,现代药理研究表明,当归具有补血活血、调节机体免疫、抗衰老、改善肝功能等生理作用[11]。文献报道百分之五的当归多糖可显著增强小鼠腹腔细胞对鸡红细胞(CRBC)的吞噬功能对小鼠腹腔细胞吞噬功能的抑制作用[12]。
现代免疫理论认为,人体的免疫力是免疫器官、免疫细胞及细胞因子共同作用的结果,而不同生物活性物质的作用机理也各不相同,鱼皮胶原蛋白肽能够调节免疫相关活性指标[6],壳寡糖[8]、当归[12]可以增强巨噬细胞吞噬能力,人参多糖能够促进特异性抗体形成[9],而黄芪能够促进免疫器官发育[10],不同原料作用于不同靶点,在提高免疫方面起到协同作用,因此调节机体免疫力也应该从多种方面考虑。目前关于调节机体免疫方面的研究多集中在植物提取物的复配上,未见海洋活性物质与植物提取物配伍并应用在调节动物免疫方面的研究,本研究自制了分子量为2 000~3 000 Da的鱼皮胶原蛋白肽,同时与壳寡糖、人参提取物、黄芪提取物和当归提取物进行复配,研究复方制品对免疫调节的效果,为海洋生物资源与天然植物提取物配伍开发产品,并应用在免疫调节方面提供一定的理论支持。
1 仪器与试剂
SPECTRAMAX plus酶标仪(北京龙跃生物科技有限公司)、PL203型电子天平(上海速展机电有限公司)、CO2-80A-IR CO2培养箱(上海丙林电子科技有限公司)、HHS-21-8振荡水浴槽(上海添时科学仪器有限公司)、TDL-4高速冷冻离心机(上海安亭科学仪器厂)、XSP-2CA显微镜(上海光学仪器一厂)、24孔和96孔细胞培养板(上海古朵生物科技有限公司)等。
SRBC(北京博尔西科技有限公司)、补体(豚鼠血清)(北京博尔西科技有限公司)、Hanks液(武汉卡诺斯科技有限公司)、SA缓冲液(上海晶抗生物工程有限公司)、印度墨汁(南京杜莱生物技术有限公司)、都氏试剂(上海羽朵生物科技)、YAC-1细胞(南京科佰生物科技有限公司)、RPMI1640完全培养液(上海圻明生物科技有限公司)、Giemsa染色液(上海哥凡生物科技有限公司)等。
2 受试药物
壳寡糖购自山东卫康生物医药有限公司;人参提取物(10∶1,人参皂苷5%,批号NW17052201)、黄芪提取物(10∶1,黄芪甲苷0.8%,批号NW17040503)、当归提取物(10∶1,阿魏酸0.08%,批号NW17051801)购自威海松龄诺可佳中药饮片有限公司;清洁级全价鼠颗粒饲料购自北京科澳协力饲料有限公司。
鱼皮胶原蛋白肽:自制,以鳕鱼皮为材料,选用胰蛋白酶和木瓜蛋白酶同步酶解,获得分子量为2 000~3 000 Da的肽段产品,其溶解性好,易吸收。
鱼皮胶原蛋白肽复方制品:将自制的鱼皮胶原蛋白肽与壳寡糖、人参提取物、黄芪提取物、当归提取物按照230∶5∶12∶30∶42比例复配而成。
3 动物分组与饲养
3.1 实验动物与饲养环境
SPF级健康ICR雌性小鼠,体重18~22 g,共336只,购自济南朋悦实验动物繁育有限公司。饲养环境为屏障环境,实验环境温度20~22 ℃,相对湿度45%~65%。
3.2 动物分组
实验前小鼠在动物房适应性喂养2天后开始正式实验。小鼠随机分为4批(N = 84),第一批进行脏器/体重比值、迟发型变态反应、抗体生成细胞检测及血清溶血素测定;第二批进行碳廓清实验;第三批进行小鼠腹腔巨噬细胞吞噬鸡红细胞实验;第四批进行ConA诱导的小鼠脾淋巴细胞转化实验和NK细胞活性测定实验。将每批的84只小鼠随机分为7组,每组12只,其中1组作为阴性对照组,3组为复方制品低、中、高剂量组,另外3组为鱼皮胶原蛋白肽低、中、高剂量组。
3.3 受试物剂量选择与给予方式
复方制品和鱼皮胶原蛋白肽设置的3个剂量组分别为低(0.5 g/kg)、中(1.0 g/kg)、高(3.0 g/kg)剂量组,分别相当于人体推荐摄入量的5、10、30倍。以纯化水为溶剂将受试物分别配至所需浓度,即分别称取1、2、6 g受试物用纯化水定容至40 mL,同时设立阴性对照组灌胃纯化水,按每天0.2 mL/10 g连续灌胃30天,测试各项功能指标。
4 实验方法
4.1 小鼠体重及脏器/体重比值测定
小鼠在初始(给药前)、中期(给药15天)、末期(给药30天)分别称重,记录各组体重的平均值。腹腔注射SRBC 5天后处死动物,取胸腺、脾脏称重,计算脏器/体重比值。
4.2 迟发型变态反应(DTH)-足跖增厚法[13]
小鼠腹腔注射2%(V/V)SRBC,致敏后4天测量左后足跖厚度,然后在测量部位皮下注射20%(V/V)SRBC,每鼠注射20 μL,注射后24 h测量左后足跖部厚度,同一部位测量三次,取平均值。以攻击前后足跖厚度差值来表示DTH的程度。
4.3 ConA诱导的小鼠脾淋巴细胞转化实验(MTT法)[14]
无菌取脾,制备脾细胞悬液,用Hanks液洗2次,每次离心10 min(1 000 rpm),将细胞悬浮于1 mL RPMI1640完全培养液中,调整细胞浓度为3×106个/mL。细胞悬液分两孔加入24孔培养板中,每孔1 mL,一孔加入75 μL ConA 液,另一孔作为对照,置于5% CO2、37 ℃培养箱中培养72 h。培养结束前4 h,每孔吸取上清液0.7 mL,加入0.7 mL不含小牛血清的RPMI1640完全培养液,同时加入MTT 50 μL,继续培养4 h,培养结束后,每孔加入1 mL酸性异丙醇,吹打均匀使紫色结晶完全溶解,在570 nm波长处测定OD值,以加Con A 孔的OD值减去不加ConA的OD值表示淋巴细胞增殖能力。
4.4 血清溶血素测定[15]
小鼠腹腔注射SRBC 5天后,摘眼球取血,离心取血清稀释100倍,进行半数溶血值测定。同时制备脾细胞悬液,进行抗体生成细胞测定。
4.5 抗体生成细胞检测(Jerne改良玻片法)[16]
取脾制成细胞悬液。将表层培养基加热溶解后与等量双倍Hanks液混合,分装小试管,每管0.5 mL,再向管内加50 μL 10%(V/V)SRBC(使用SA液配制)、25 μL脾细胞悬液,迅速混匀后,倾倒于已刷琼脂糖薄层的玻片上,待琼脂凝固后,将玻片水平扣放在玻片架上,放入CO2培养箱温育1.5 h,然后用SA液稀释的补体(1∶8)加入到玻片架凹槽内,继续温育1.5 h后,计数溶血空斑数。
4.6 小鼠碳廓清试验[17]
小鼠尾静脉注射1∶3稀释的印度墨汁,待墨汁注入立即计时,注入墨汁后2和10 min,分别从内眦静脉丛取血20 μL,并将其加到2 mL NaCO3溶液中,在600 nm波长处测OD值。将小鼠处死,取肝和脾脏称重,计算吞噬指数。
4.7 小鼠腹腔巨噬细胞吞噬鸡红细胞试验[17]
小鼠腹腔注射20%(V/V)鸡红细胞悬液1 mL,间隔0.5 h处死,固定于鼠板上,剪开腹壁皮肤,注射生理盐水2 mL,转动鼠板1 min,吸出腹腔洗液1 mL,分滴于2片玻片上,37 ℃温育30 min,用生理盐水漂洗,晾干,以1∶1丙酮甲醇溶液固定,Giemsa染液染色10 min,用纯化水漂洗晾干,用油镜镜检,计算吞噬率和吞噬指数。
4.8 NK细胞活性测定[15]
实验前24 h将靶细胞传代培养,应用前以Hanks液洗3次,用RPMI1640完全培养液调整细胞浓度为4×105个/mL。小鼠颈椎脱臼处死,无菌取脾,制备脾细胞悬液,用Hanks液洗2次,每次离心10 min(1 000 rpm)。弃上清将细胞浆弹起,加入0.5 mL灭菌水裂解红细胞,20 s后再加入0.5 mL 2倍Hanks液及8 mL Hanks液,离心10 min(1 000 rpm),用1 mL含10%(V/V)小牛血清的RPMI1640完全培养液重悬,用1%冰醋酸稀释后计数,调整细胞浓度为2×107个/mL,将靶细胞加入96孔培养板,每孔100 μL,试验孔加入100 μL脾细胞(效靶比50∶1),自然释放孔加入100 μL培养液,最大释放孔加入100 μL 1%(V/V) NP40,37 ℃培养4 h。离心,取上清100 μL置于96孔酶标板中,加入LDH基质液100 μL,反应3 min,以1 mol/L的HCl终止反应,在酶标仪490 nm处测定OD值。
5 数据统计与分析
以Excel软件建立数据库,用SPSS软件进行统计分析,采用方差分析,先进行方差齐性检验,方差齐,计算F值,F值
6 结果
6.1 受试物对小鼠体重的影响
分别测定各组实验小鼠的初始体重、中期体重和末期体重,并计算小鼠增重,由表1可知,在30天喂养试验过程中,鱼皮胶原蛋白肽和复方制品各剂量组小鼠各个阶段的体重及最终的体重增加值与阴性对照组相比均无显著差异(P>0.05),说明受试物喂养对小鼠增重没有影响。
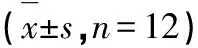
表1 受试物对小鼠体重的影响
6.2 受试物对小鼠迟发型变态反应(DHT)的影响
由表2可知,鱼皮胶原蛋白肽和复方制品各剂量组小鼠的足跖肿胀度与对照组相比无显著差异(P>0.05),说明这两种受试物不会引起小鼠迟发型变态反应。
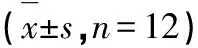
表2 受试物对小鼠迟发型变态反应(DHT)的影响
6.3 受试物对ConA诱导的小鼠脾淋巴细胞转化实验的影响
由表3可知,与阴性对照组比较,复方制品组和鱼皮胶原蛋白肽组的低、中、高剂量组小鼠的脾淋巴细胞增殖能力存在极显著性差异(P<0.01),说明复方制品和鱼皮胶原蛋白肽在低、中、高剂量下都有增加脾细胞增殖的能力,复方制品组小鼠淋巴细胞增殖能力更强,说明鱼皮胶原蛋白肽与其他生物活性成分按照合适比例复配之后效果更佳。
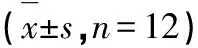
表3 受试物对ConA诱导的小鼠脾淋巴细胞转化实验的影响
6.4 受试物对小鼠脏器/体重比值的影响
由表4可知,与阴性对照组相比,复方制品和鱼皮胶原蛋白肽的各剂量组小鼠的脾脏/体重比值和胸腺/体重比值无显著性差异(P>0.05),说明两种受试物喂养对于小鼠脏器均没有影响。
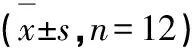
表4 受试物对小鼠脏器/体重比值的影响
6.5 受试物对小鼠抗体生成细胞数的影响
由表5可知,与阴性对照组相比,复方制品和鱼皮胶原蛋白肽各剂量组小鼠的抗体生成细胞数均无显著性差异(P>0.05),说明两种受试物对于小鼠抗体形成细胞的增殖没有影响。
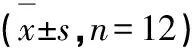
表5 受试物对小鼠抗体生成细胞数的影响
6.6 受试物对小鼠血清溶血素的影响
由表6可知,复方制品组的低剂量组小鼠血清溶血素水平与阴性对照组相比,无显著差异(P>0.05);中、高剂量组小鼠的血清溶血素水平与阴性对照组相比有极显著性差异(P<0.01)。鱼皮胶原蛋白肽组中、低剂量组小鼠血清溶血素水平与阴性对照组相比,无显著差异(P>0.05);高剂量组小鼠的血清溶血素水平与阴性对照组相比有极显著性差异(P<0.01)。说明一定剂量的复方制品和鱼皮胶原蛋白肽均可以增加小鼠血清溶血素水平,增强小鼠免疫。相比于鱼皮胶原蛋白肽组,复方制品组达到相同效果所需要的剂量更小。
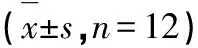
表6 受试物对小鼠血清溶血素的影响
6.7 受试物对小鼠单核-巨噬细胞碳廓清能力的影响
由表7可知,复方制品组的高剂量组与阴性对照组比较,小鼠的单核-巨噬细胞碳廓清吞噬指数明显增高,有显著性差异(P<0.05);而鱼皮胶原蛋白肽各个剂量组与对照组相比,均无显著性差异(P<0.05),说明一定剂量的鱼皮胶原蛋白肽复方制品能显著提高小鼠的单核-巨噬细胞碳廓清吞噬指数。
6.8 受试物对小鼠腹腔巨噬细胞吞噬鸡红细胞能力的影响
由表8可知,复方制品和鱼皮胶原蛋白肽高剂量组小鼠的腹腔巨噬细胞吞噬百分率与阴性对照组比较,均有极显著性差异(P<0.01),说明两种受试物的各个剂量组对于提高小鼠巨噬细胞吞噬作用均有显著作用,且随着剂量的增强效果增强。从表中数据可以看出,相同剂量的复方制品组效果优于鱼皮胶原蛋白肽组。
6.6 受试物对小鼠NK细胞活性的影响
由表9可知,复方制品组的中、高剂量组小鼠的NK细胞活性与阴性对照组相比有极显著性差异(P<0.01)。鱼皮胶原蛋白肽组的高剂量组与阴性对照组相比,有极显著性差异(P<0.01),说明一定剂量的复方制品和鱼皮胶原蛋白均能够增强小鼠NK细胞活性,且复方制品组效果要优于鱼皮胶原蛋白肽组。
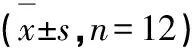
表7 受试物对小鼠单核-巨噬细胞碳廓清能力的影响
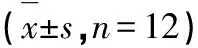
表8 受试物对小鼠腹腔巨噬细胞吞噬鸡红细胞能力的影响
表9 受试物对小鼠NK细胞活性的影响
通过灌胃给予小鼠不同剂量的鱼皮胶原蛋白肽和鱼皮胶原蛋白肽复方制品,探究两者是否具有增强免疫力功能。结果表明,鱼皮胶原蛋白肽及其复方制品均能提高小鼠脾淋巴细胞转化能力和血清溶血素水平,具有促进单核-巨细胞碳廓清的能力,能够提高腹腔巨噬细胞吞噬百分率和促进NK细胞活性,而且,在提高淋巴细胞增殖能力、增强NK细胞活性等方面,相同剂量的复方制品较单一的鱼皮胶原蛋白肽效果更好;两种受试物对小鼠的足距肿胀度、抗体生成细胞数、腹腔巨噬细胞吞噬指数、脾脏/体重比值、胸腺/体重比值无显著影响。因此,鱼皮胶原蛋白肽与壳寡糖、人参提取物、黄芪提取物、当归提取物按照一定比例复配后的复方制品能够提高小鼠免疫力,且效果优于单一的鱼皮胶原蛋白肽。
7 讨论
我国是拥有丰富鱼类资源的海洋国家,近年来,海洋资源的开发与利用成为研究的热点。深海鱼胶原蛋白肽因具有来源广、低抗原性、低过敏性和使用安全等特点[18]逐渐替代了传统的胶原蛋白,成为一种海洋来源新型胶原蛋白资源。受制备技术的限制,目前的海洋肽类通常是非常复杂的混合物,分子量范围较为宽泛,特定分子段活性肽的制备已成为其工业化生产的瓶颈,影响了活性肽的构效关系和相关活性机制及应用研究[19]。同时,在应用方面,目前对于单一鱼皮胶原蛋白肽抗氧化等活性的研究较多,而以其为原料复配天然提取物开发增强免疫功能食品的研究很少。
本研究以深海鳕鱼皮为原料,采用复合酶同步水解法高效制备了分子量为2 000~3 000 Da的鱼皮胶原蛋白肽,将其按照一定比例与壳寡糖、人参提取物等复配得到一种增强免疫的复方制品,进行该胶原蛋白肽及其复方制品在增强免疫效果方面的研究,发现其具有显著的提高免疫效果,且与天然提取物原料复配之后效果更加明显,这可能是因为不同分子量的鱼皮胶原蛋白肽特定的活性功能,2 000~3 000 Da显示出较好的增强免疫功能,而且与天然提取物复配之后,其中的有效成分在增强机体免疫方面具有协同作用。特定分子量鱼皮胶原蛋白肽不仅安全性高、具有不同的生物活性[20],而且解决了海洋渔业资源在利用过程中资源浪费的问题,同时海洋资源与天然植物提取物的组合应用也为其他功能食品的开发提供了一条新的途径。

