大枣水提液还原制备纳米银材料及抗氧化和抗菌活性研究
魏思敏,王英辉,唐志书*,苏 瑞,许洪波,陈 琳,刘世军,李 琛
1陕西中医药大学陕西省中药资源产业化协同创新中心 秦药特色资源研究开发国家重点实验室(培育)陕西省创新药物研究中心,咸阳 712083;2长安大学理学院,西安 710064
纳米银材料作为近年来新兴的纳米材料[1],因为其既可以克服细菌的耐药性[2],又对微生物具有很好的抑制作用、且对正常细胞毒性低[3],已被广泛应用于生物医药领域,因此研究纳米银材料的制备方法及理化性质具有重要的意义。传统的制备纳米银材料的方法包括物理法[4]和化学法[5];其中物理法对大型仪器依赖较强,且会造成高的能量损耗;而化学法中会使用大量的有毒化学试剂,这些特点在一定程度上限制了这两种制备方法的应用范围。生物制备法[6]主要利用微生物或植物作为还原剂,是一种环境友好、绿色节能的制备方法,近年来已在纳米材料制备领域被逐渐使用[7,8]。
中药是一类天然的植物资源,关于中药成分分析的研究表明其含有生物碱[9]、糖类[10]、黄酮类化合物[11]等多种活性成分。前期利用植物作为还原剂制备纳米材料的研究显示:生物碱、糖类和黄酮类等化合物会在制备过程中起到还原剂作用,这一特点为中药作为还原剂制备纳米银材料提供了先决条件;其次,前期关于植物法制备纳米材料的研究表明,植物中的活性成分会进一步吸附在纳米材料的表面起稳定作用;因为中药的生物相容性较好,因此中药制备得到的纳米银材料更利于其在临床研究中的应用[12]。
大枣又名红枣,为鼠李科植物枣(ZizyphusjujubaMill)的干燥成熟果,味甘、性温,有补脾胃、益气生精、调和诸药的功效,还具有补中益气、缓和药性、养血安神之功效[13],在我国已有几千年的种植史,其药用价值在《神农本草经》、《本草纲目》、《证类本草》中均有记载。大枣的化学成分中糖类占大枣果肉总干物的80%以上,还原糖占总糖含量的70.8%~95.0%[14],此外还有蛋白质、生物碱、三萜、皂苷、黄酮和环腺苷酸、环鸟苷酸以及氨基酸等多种活性成分[15]。因此本文首先利用大枣水提液中丰富的化学成分作为还原剂和稳定剂成功制备了纳米银材料,并探讨溶液pH、料液比以及反应时间对还原反应效率的影响;随后通过激光粒度仪以及TEM对所制得纳米银材料的理化性质进行了表征并且探讨了可能的还原反应机理;最后对大枣纳米银材料的抗氧化和抗菌活性进行了研究。这些结果不仅可以为纳米银材料的制备提供新的方法,同时也为大枣的综合开发利用提供新的思路和途径。
1 材料与方法
1.1 仪器与试剂
UV-2600型紫外可见分光光度计,岛津(日本)公司;ZEN 3600激光粒度仪,英国马尔文仪器有限公司;JEM-2010型透射电子显微镜,东京理化株式会社(日本);CAP225D电子天平,北京赛多利斯科学仪器有限公司;Zirbus Vaco 5 冻干机,德国Zirbus有限公司;SHA-B数显水浴恒温振荡器,金坛市双捷实验仪器厂;TGL-20B离心机,上海安亭科学仪器厂;LDZX-50KBS立式压力蒸汽灭菌器,上海申安医疗器械厂。
硝酸银(AgNO3,质量分数>99%)、聚乙烯吡咯烷酮(PVP K30)、柠檬酸钠、胰蛋白胨、氯化钠、酵母粉、琼脂粉均为分析纯,购于成都科隆化学品有限公司。1,1-二苯基-2-三硝基苯肼(DPPH)为分析纯,购买于上海阿拉丁生化科技股份有限公司。实验所用中药材大枣购于陕西兴盛德药业有限公司,经陕西中医药大学刘世军副教授鉴定为鼠李科植物枣(ZizyphusjujubaMill)的干燥成熟果,符合《中国药典》2015年版相关规定。供试菌种大肠杆菌(ATCC25922,Escherichiacoli)、金黄色葡萄球菌(ATCC25923,Staphylococcusaureus)均由陕西中医药大学陕西省中药资源产业化协同创新中心提供。
1.2 方法
1.2.1 大枣水提液的制备
准确称取干燥大枣药材5.0 g(粉碎),加入100 mL纯化水超声提取4 h,过滤得滤液,备用,经测量大枣水提液的pH为5.0。
1.2.2 不同pH大枣水提液与AgNO3的反应
取5 mL大枣水提液原液一份,另取四份5 mL大枣水提液,用10 mol/L的NaOH水溶液分别调节pH至6.0、7.0、8.0、9.0,向不同pH的大枣水提液中均加入0.01 mol/L的AgNO3溶液5 mL,室温下超声反应。因为纳米银在紫外-可见吸收光谱(UV-Vis)410 nm附近有特征的吸收,所以在合成过程中使用UV-Vis光谱监测纳米银材料的生成。
1.2.3 不同料液比时大枣水提液与AgNO3的反应
确定最佳pH之后,考察不同料液比对于反应的影响,控制大枣水提液与硝酸银用量比分别为2∶1、1∶1、1∶2、1∶4、1∶5,室温下超声反应,过程中通过使用UV-Vis光谱测量410 nm附近吸收峰的强度,确定最佳的料液比。
1.2.4 大枣水提液还原制备纳米银材料
取5 mL大枣水提液,调节pH至优化出来的最适pH,向其中加入0.01 mol/L的AgNO3溶液5 mL,室温下超声反应,过程中使用紫外-可见光谱监测410 nm附近吸收峰的变化,待反应完成后取反应悬浮液,9 000 rpm离心30 min,弃上清液取沉淀,用超纯水洗涤3次,收集沉淀,冷冻干燥至恒重。
1.2.5 化学还原法制备纳米银材料
取硝酸银溶于超纯水,加入PVP搅拌均匀备用,称取柠檬酸钠溶于超纯水中,按照柠檬酸钠-硝酸银的物质的量比为5∶1,将柠檬酸钠溶液逐渐滴入硝酸银溶液中,滴加完毕后加热回流反应1 h,取悬浮液,9 000 rpm离心30 min,弃上清液取沉淀,用超纯水洗涤3次,收集沉淀,冷冻干燥至恒重。
1.2.6 纳米银材料的表征
分别采用UV-2600型紫外-可见分光光度计(日本岛津公司)、ZEN 3600激光粒度仪(英国马尔文仪器有限公司)、JEM-2010型透射电子显微镜(日本电子株式会社)对纳米银材料进行表征。
1.2.7 纳米银材料抗菌性能研究
1.2.7.1 菌悬液的制备
将测试用的细菌E.coli、S.aureus分别接种于LB固体培养基的培养皿中划线,37 ℃培养18 h。取灭菌好的试管两支分别加入LB液体培养基约15 mL,用接种环挑取一环单菌落于试管中,放置于水浴摇床,37 ℃,150 rpm培养18 h。超净工作台上,取少许活化的菌体置于培养基试管中,摇匀,制备成1×106CFU/mL的菌悬液备用。
1.2.7.2 最小抑菌浓度的测定
采用倍比稀释法测定最小抑菌浓度(MIC)[16]。称取一定量的大枣纳米银材料、化学法制备的纳米银材料,用无菌水进行配制,使其最终浓度为4 000 μg/mL,随后依次用无菌水稀释成系列浓度;将待测的药液分别加入96孔板上,每孔中加入50 μL的药液与50 μL制备好的菌悬液,每次都加有无菌水100 μL阴性对照和100 μL菌液作为阳性对照。将96孔板置于37 ℃的培养箱中培养24 h后观察,以不产生浑浊的孔所对应的最低浓度为该药液对该菌的最小抑菌浓度。
1.2.7.3 最小杀菌浓度的测定
在得到MIC后,从实验组的澄清孔中取10 μL培养物,再向其中加入90 μL的LB液体培养基,每个样品重复3次,放入37 ℃培养箱中培养,每次伴有阴性对照和阳性对照。分别观察培养 24 h平板上有无菌落生长,无细菌生长的最低浓度为该药液对该菌的最小杀菌浓度(MBC)。
1.2.8 纳米银材料对DPPH自由基清除能力测定
按照文献报道的方法[17],准确称取2.5 mg DPPH溶解定容于100 mL容量瓶中,于冰箱避光保存。将纳米银材料配制成不同质量浓度梯度的样品液,精密量取1 mL样品溶液加入5 mL试管中,再加入1 mL DPPH溶液,将上述反应液置于室温下暗反应30 min,测定517 nm处的吸光度,每个实验重复三次。按下列公式计算清除率,并用同等质量浓度的维生素C(VC)溶液作为阳性对照:
自由基清除率= [1-(A1-A2)/A0]×100%
式中A0:1 mL DPPH+1 mL超纯水;A1:1 mL DPPH + 1 mL样品;A2:1 mL样品+1 mL乙醇。
2 结果与分析
2.1 大枣水提液还原制备纳米银材料
表面等离子体共振(surface plasmon resonance,SPR)是描述金属的导电电子在电磁场作用下集体振荡的一个物理概念[18],这种共振在宏观上表现为金属纳米粒子对光的吸收;纳米银材料在UV-Vis光谱410 nm附近会出现特征的等离子体共振吸收峰。因为大枣水提液和硝酸银溶液在410 nm附近没有明显的吸收,因此可以通过UV-Vis吸收光谱在410 nm附近的吸收峰来判断纳米银材料的生成。首先,我们用大枣水提液原液(pH5.0)直接与AgNO3溶液超声反应1 h,通过UV-Vis光谱测量判断是否有纳米银生成。如图1所示,大枣水提液原液与AgNO3反应1 h后UV-Vis光谱在410 nm附近有明显的吸收峰,表明大枣水提液中的活性成分可以还原AgNO3生成纳米银材料。基于我们前期的研究基础[19],提高反应液的pH可以进一步增强水提液中还原性物质的活性,使还原反应更加高效的进行;这主要是因为在碱性条件下,具有还原性的多糖分子以及黄酮类化合物等可能会以负离子形式存在,这种存在形式会使其与Ag+的相互作用增强,从而使还原反应更容易进行,因此我们进行了pH依赖实验。从图1可以看出,随着大枣水提液pH逐渐增大,反应液在410 nm附近的吸光度逐渐升高,更大的吸光度数值表明生成了更多的纳米银材料,这和我们前期的研究结果一致。此外,我们也注意到:(1)当大枣水提液的pH从6.0变化到7.0时其吸光度值的变化最大,这可能是因为大枣水提液中活性成分在此区间内变为负离子形式,这更有利于还原反应的进行,所以使还原反应的效率大大提升;但是当pH大于7.0时,随着溶液pH值增大,410 nm附近吸光度的变化值逐渐减小,这意味增大大枣水提液pH至7.0后其与AgNO3反应效率降低,因此我们并没有尝试在更高pH值(大于9.0)时进行实验;(2)不同pH值大枣水提液还原得到的纳米银材料等离子体共振峰最大吸收并没有在同一波长处,根据文献[20],纳米银粒径的不同会导致其在UV-Vis光谱上最大吸收波长不同,这说明大枣水提液的pH不但影响纳米银的生成效率,同时也影响纳米银的粒径大小。基于以上pH依赖实验,我们在pH9.0时对还原反应条件进行了进一步的筛选。
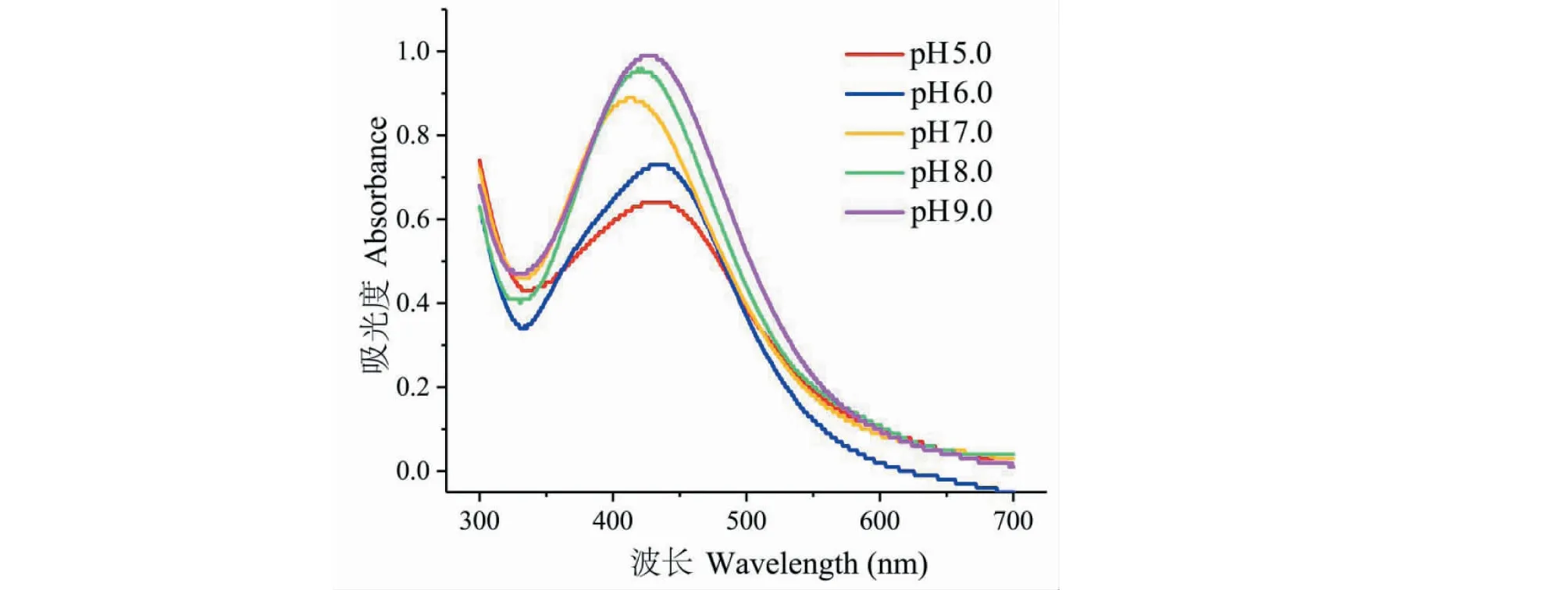
图1 不同pH大枣水提液与硝酸银反应后混合液的紫外-可见吸收光谱Fig.1 UV-Vis spectra of the mixtures after the reaction between jujube aqueous extract and AgNO3 at different pH
随后我们在大枣水提液(pH9.0)与硝酸银溶液的比为1∶1、1∶2、1∶4、1∶5时进行了反应,考察料液比对还原反应的影响。超声反应1 h后我们发现:随着硝酸银溶液比例增加,UV-Vis光谱上410 nm附近的吸光度值逐渐变小,当两者比例为1∶1时,410 nm附近的吸光度最大(图2),表明在此料液比之下生成的纳米银材料最多;这是因为随着AgNO3用量增大,Ag+周围的还原性物质数量减少,反应速率变慢,所以反应相同时间后(1 h)生成纳米银材料的量减少。进一步的,我们尝试增加反应液中还原性物质的量(大枣水提液∶AgNO3=2∶1)来提高反应效率,但实际上,当料液比为2∶1时,410 nm附近的吸光度值却相对于1∶1时减少近一半,如图2所示,这表明在此条件下纳米银材料生成的效率降低。我们推测这主要是因为反应液中还原性物质的含量太多,纳米银材料的成核速度太快,以至于来不及生长为稳定的纳米银粒子所导致,而在UV-Vis光谱上我们只能监测到生长完全且稳定的纳米银,所以当将大枣水提液的用量提高至2∶1,反应相同时间后生成纳米银材料的量反而变少。
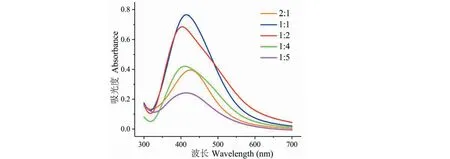
图2 不同料液比反应1 h后混合液的紫外-可见吸收光谱Fig.2 UV-Vis spectra of the mixtures after the reaction between jujube aqueous extract and AgNO3 at different ratios
进一步的,我们在pH9.0,大枣水提液和硝酸银比例为1∶1时,研究了反应时间的影响。我们将0.01 mol/L的AgNO3溶液加入大枣水提液中,分别观测反应0、1、3、4、6 h后纳米银材料的生成。图3为反应不同时间后,将反应液稀释20倍后测得的UV-Vis光谱。从图中我们发现:在反应0 h时(大枣水提液),410 nm附近并没有显著的吸收;随着AgNO3溶液加入反应时间增加后,410 nm处出现了明显的吸收峰,其强度随着反应时间增加逐渐增加,这说明随着反应时间的增加体系中生成了更多的纳米银材料;但是当反应进行到4 h后,其反应速率明显变慢(4和6 h时吸光度值的变化值减小),这是因为随反应的不断进行,大枣水提液中的活性成分被不断消耗,所以反应速率逐渐减小。反应条件的筛选表明大枣水提液在pH9.0,与AgNO3的料液比为1∶1,反应4 h时效率最高。
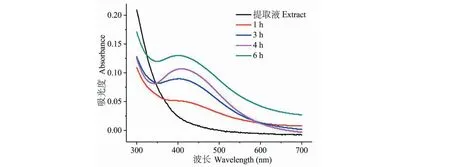
图3 大枣水提液与硝酸银溶液反应不同时间后反应混合液的UV-Vis吸收光谱Fig.3 UV-Vis spectra of the mixture after the reaction between jujube aqueous extract and AgNO3 at different times
2.2 透射电镜(TEM)表征纳米银材料的形貌
我们使用TEM对在反应效率最高条件下制备的纳米银材料形貌进行了表征。具体步骤如下:将制备得到的大枣纳米银材料悬浮液稀释3倍,滴加一滴在铜网附有碳膜支持的一面,铜网自然晾干3 h后,利用TEM对其形貌进行表征。结果如图4(a)所示,从图中可以看出,我们制备得到的纳米银材料呈近球形,分散较均匀、粒径大部分分布在20~30 nm之间;这与我们通过化学制备法得到的纳米银形貌基本类似(图4(b)),粒径也相当。
2.3 大枣纳米银材料的平均粒径及zeta电位
取1 mL大枣纳米银材料溶液置于激光粒度仪的测试皿中,测试温度25 ℃,测量三次。我们分别测量了不同pH值以及料液比时纳米银材料的粒径,结果如图5所示。可以看出:随着反应液pH逐渐升高,纳米银的平均粒径从130 nm左右减小到30 nm左右;这主要是因为当大枣水提液在较大pH时,大枣水提液中具有还原性的活性成分大多处于负离子的形式,这种存在形式有利于其与Ag+的相互作用,并导致还原反应速率加快,纳米银的成核速度大于生长速度,因此在较大pH时生成的纳米银粒径变小。同时,我们也考察了不同料液比对纳米银材料粒径的影响,结果如图5所示。从图4可以看出:随着硝酸银比例增大,反应生成的纳米银材料粒径逐渐增大,这主要是因为在Ag+周围具有还原性的活性成分含量减少,所以还原反应的速率将会变慢,使得纳米银的成核速度小于生长速度,所以纳米银颗粒会不断生长形成粒径更大的材料。最后,我们也对在反应液pH9.0,料液比为1∶1,反应时间为4 h时制得的纳米银材料平均粒径和zeta电位进行了测量,其中平均粒径为25.99 ± 1.3 nm,和我们通过TEM得到的结果完全一致;zeta电位为-29.6 mV(图5),说明纳米银材料表面吸附了带有负电荷的化合物,这进一步证实了我们上文推测的在反应液pH为碱性时,大枣水提液中参与还原反应的活性物质可能是以负离子形式存在的结果一致。正是由于这些负电荷之间的静电排斥作用使得我们制备得到的纳米银材料不发生团聚,具有较高的稳定性。
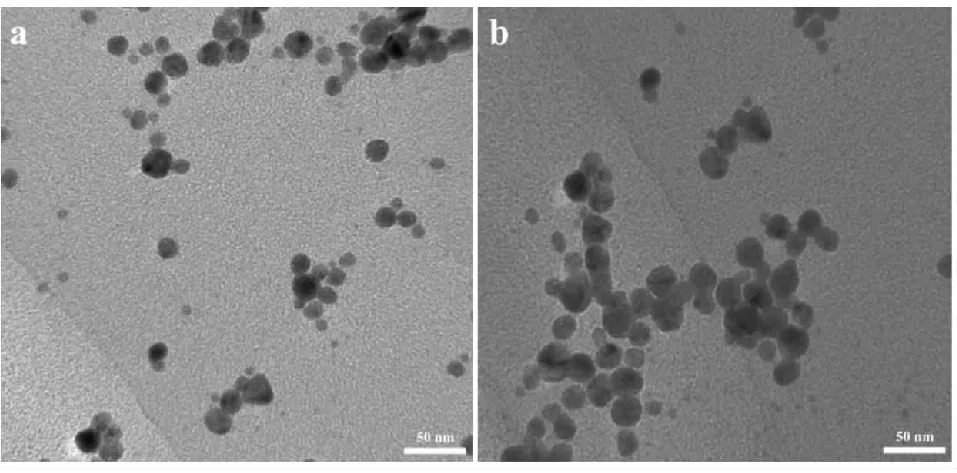
图4 (a)大枣水提液;(b)化学法还原AgNO3制备得到纳米银材料的TEM图像Fig.4 TEM image of the synthesized AgNPs by (a) jujube aqueous extract;(b) citrate sodium
2.4 纳米银材料对DPPH自由基的清除能力
接着我们对所制得的纳米银材料对于DPPH自由基的清除能力进行了评价。由图7可以看出:大枣纳米银材料对DPPH有清除作用,并且清除率随着大枣纳米银材料浓度增大显著增加,在0~200 μg/mL范围内呈一定量效关系;当大枣纳米银材料的浓度达到100 μg/mL时,对DPPH自由基的清除率可以达到83%,这说明制得的纳米银材料具有较强的自由基清除能力;但是当纳米银材料的浓度大于100 μg/mL后,清除率随浓度的变化增加缓慢。
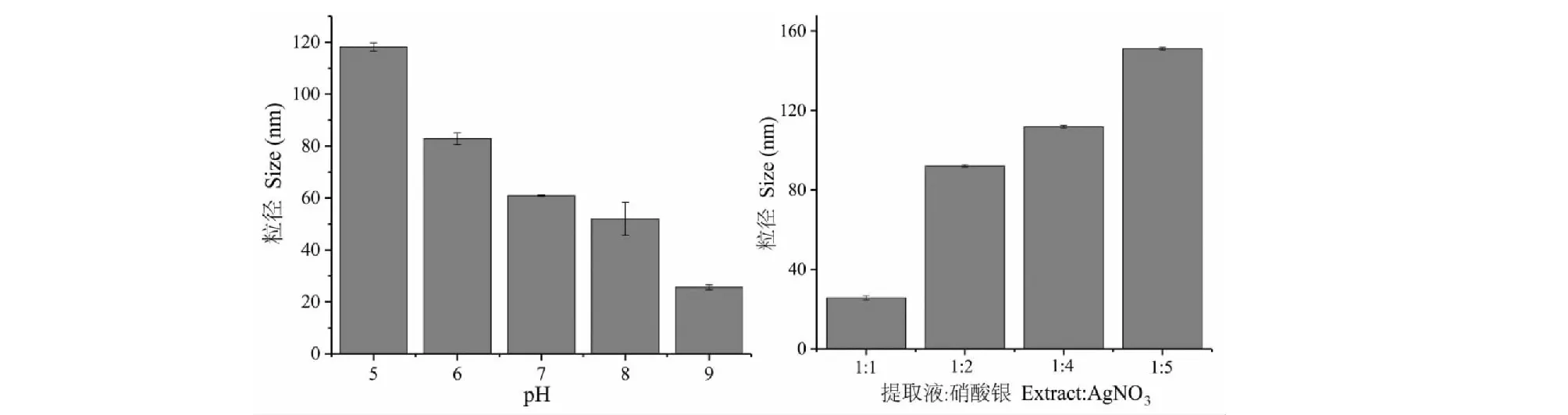
图5 不同条件下纳米银材料的粒径Fig.5 Size distribution of AgNPs at different conditions
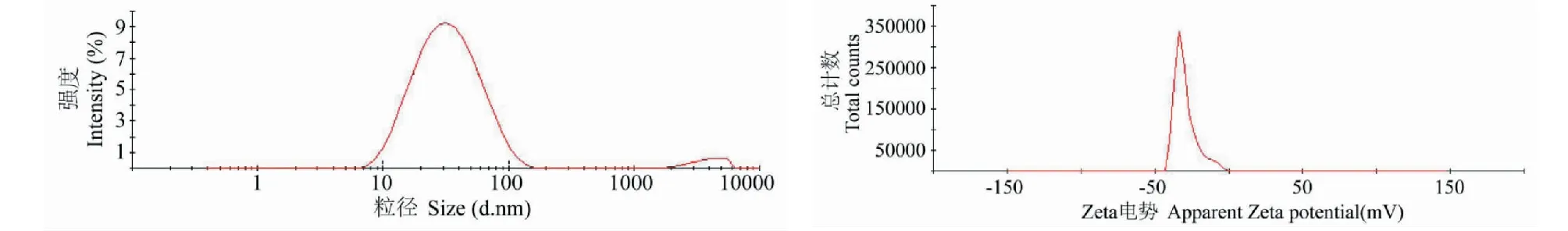
图6 纳米银材料的粒径和zeta电位Fig.6 The zeta potential and size of synthesized AgNPs
2.5 大枣纳米银材料的抑菌活性实验
随后,我们进行了抗菌实验,发现:大枣水提液制备得到的纳米银材料相比化学方法制备的纳米银材料(制备方法详见“1.2.5”,表征数据见“2.2”),抗菌活性大大提高,大枣纳米银材料对大肠埃希菌的最小抑菌浓度(MIC)为100 μg/mL,对比化学方法制备的纳米银材料(500 μg/mL)活性增加了5倍。大枣纳米银材料对金黄色葡萄球菌的最小抑菌浓度(MIC)为125 μg/mL,相比于化学方法制备的纳米银材料(500 μg/mL)其活性增加了4倍,详见表1。大枣水提液还原法制备的纳米银材料对大肠埃希菌和金黄色葡萄球菌均有很强的抑制作用,优于化学方法制备的纳米银材料和大枣水提液单独使用时的效果。根据文献报道,中药制备的纳米银材料表面会吸附中药的活性成分,因此我们推测纳米银材料表面吸附的大枣水提液活性成分,使得该方法制备的纳米银材料比化学方法有更好的抗菌活性。此外,有文献报道[21]:纳米银材料与细菌细胞膜接触进入细菌细胞后,在光的催化作用下会与细菌细胞中的水或者氧反应生成活性氧物种(reactive oxygen species,ROS),产生的活性氧物种既会与细菌的DNA发生反应,干扰细菌DNA的转录和复制过程,也会与细菌的蛋白质作用使其变性,最终导致细菌死亡从而产生抗菌效果。利用大枣水提液制备得到的纳米银材料其表面可能被还原性多糖分子所覆盖,这导致其更容易通过细胞膜进入细胞内部,使细菌细胞内的大枣纳米银材料数量多于化学法制备的纳米银材料,更多的纳米银材料会产生更多的活性氧物种,最终会导致更多的细菌细胞死亡,进一步增强纳米银材料的抗菌活性,因此使用大枣水提液还原法制备的纳米银材料其抑菌效果更为明显。
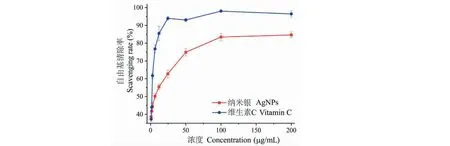
图7 大枣纳米银材料对DPPH自由基的清除作用Fig.7 Free radical scavenging assays of AgNPs against DPPH
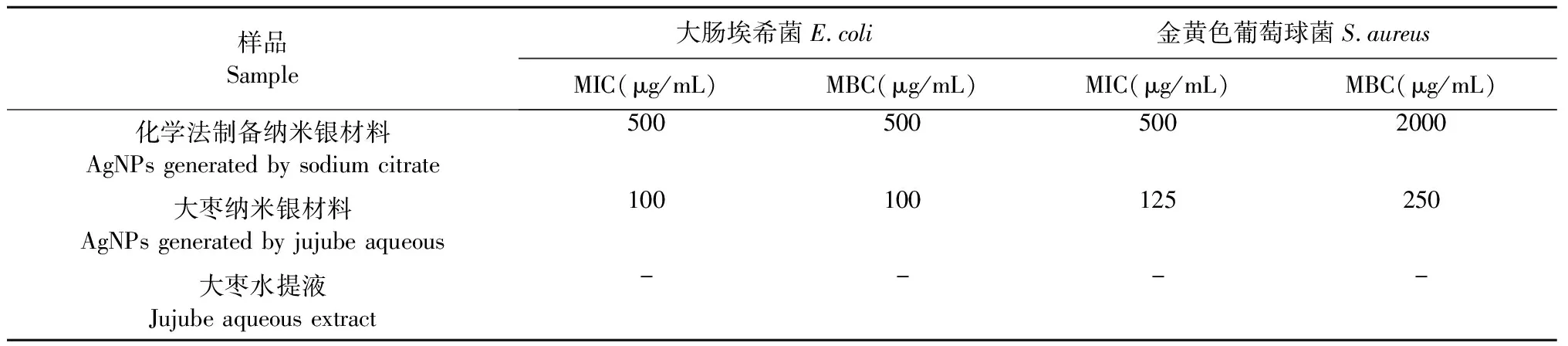
表1 不同方法制备的纳米银材料及大枣水提液的抑菌活性
注:“-”表示待测中药液的MIC>10 mg/mL。
Note: “-” represents the MIC value of jujube aqueous extract is greater than 10 mg/mL。
2.6 纳米银材料的形成机理
根据文献报道[22],植物还原法制备纳米材料过程中还原性糖类化合物可能起到重要作用。大枣中含有大量还原性多糖,因此我们推测在反应过程中,还原性多糖作为主要的活性成分参与还原反应。具体过程可能为:还原性多糖分子中所含有的还原性醛基作为还原剂,经过反应之后自身会被氧化成羧基(图8所示);此外,由于糖类分子上有着大量的极性羟基和醚氧基团,在碱性条件下,糖类化合物中羟基更容易失去质子带有负电荷,带有负电荷的氧原子能通过静电相互作用将与带正电荷的Ag+束缚在其周围,较短的距离更利于还原反应的进行,因此还原速率增大,这可以从我们的pH依赖实验得到证实。同时这些静电相互作用还能够降低Ag+的活动性,较快的反应速率使纳米银材料的成核速度大于生长速度(如果生长速度较快容易造成纳米银粒子团聚),能阻止纳米银材料生长为粒径更大的材料;我们使用大枣水提液在最佳反应条件时制备得到的纳米银材料粒径很小,主要分布在20~30 nm,这从一定层面能证实我们的推测。最后,带有负电性的多糖分子会吸附在纳米银材料的表面,因为带有负电性的羟基之间会产生静电排斥作用,防止了纳米银材料之间发生团聚作用形成粒径更大的纳米银材料甚至于聚沉。
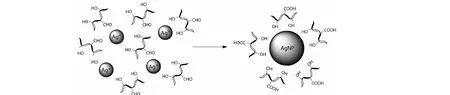
图8 纳米银材料形成的可能机制Fig.8 The proposed mechanism for formation of silver nanoparticles
3 结论
本研究以大枣水提液作为还原剂,利用超声法在室温下成功制备了纳米银材料,通过对反应条件(溶液pH、料液比和反应时间)的筛选,得到了最佳反应条件(pH9.0,料液比1∶1,反应时间4 h)。进一步的理化性质表征发现:(1)反应液的pH和料液比对纳米银材料的粒径具有较大的影响;(2)在最佳反应条件时制得的纳米银呈近球形、分散较均匀,平均粒径为25.99±1.3 nm;(3)纳米银材料表面带负电性,还原反应机理的初步探讨显示可能是还原性多糖等活性物质以负离子的形式吸附在纳米银表面使其带有负电荷,最终起到稳定纳米银的作用。最后,生物活性研究显示:利用大枣水提液还原法制得的纳米银材料对DPPH自由基具有很高的清除率(83%);同时对大肠杆菌和金黄色葡萄球菌具有明显的抑制作用,最小抑菌浓度分别为100和125 μg/mL,为传统化学法制得的纳米银材料的5倍和4倍。我们的这些结果不仅为纳米银材料的制备提供了新的方法,也为大枣资源的开发利用提供了新的思路。

