基于HPLC-Q-Exactive Orbitrap/MS技术分析不同剂型太子参的差异化学成分
华愉教,谢 芬,周少丹,王敏伟,仰晓云,陆元杰
江南大学附属医院药学部,无锡 214000
太子参为大宗常用中药材,系石竹科假繁缕属Pseudostellariarupestris(Turcz.) Pax植物孩儿参Pseudostellariaheterophylla(Miq.) Pax ex Pax et Hoffm.的干燥块根[1],具益气健脾、润肺生津之传统功效及促进免疫、止咳、抗肿瘤、抗菌抗氧化、保护心肌功能等药理作用,临床上用于脾虚体倦、食欲不振、病后虚弱、气阴不足、自汗口渴、肺燥干咳等症,是治疗小儿脾虚而食欲不佳之要药,疗效确切,临床用量大[2]。目前医院中药房使用的太子参主要有两种形式:传统中药饮片和中药配方颗粒,其中中药配方颗粒由单味中药饮片经过水提、浓缩、干燥、制粒而成,在中医临床配方后,供患者冲服使用的一种颗粒制剂,是一种新的饮片使用形式[3]。两种剂型各有优劣[4],但是剂型的不同势必会对太子参有效成分的积累产生影响,因而无法保证临床使用的有效性,并且目前尚未对两者有效成分进行过深入研究。为了更加全面地了解不同剂型对太子参代谢物合成积累的影响以及太子参饮片和颗粒品质的差异,有必要建立基于不同剂型太子参整体化学成分的质量分析方法。
植物代谢组学技术是对植物提取物中代谢组进行高通量、无偏差的全面分析技术,特别适用于中药多组分复杂体系的分析[5]。高效液相色谱-串联四级杆静电场轨道阱质谱(HPLC-Q-Exactive Orbitrap/MS)采用高效液相色谱对复杂混合物进行快速分离,结合高性能四级杆的母离子选择性与高分辨的准确质量数Orbitrap检测技术实现对复杂样品的定性和定量分析,具有灵敏度高、准确度高、检测效率高等特点。目前已广泛用于多种中药材,如赤芍、人参、宣木瓜等[6-8]。本研究借鉴植物代谢组学的研究思路和方法,采用HPLC-Q-Exactive Orbitrap/MS技术分析太子参饮片和颗粒化学成分的差异性,并通过多元统计和信号通路分析找出差异化学成分和主要代谢通路,探究其变化规律,从而为揭示不同剂型对太子参代谢产物合成积累的影响规律及探讨太子参传统中药饮片和配方颗粒品质形成机制提供基础资料。
1 材料
1.1 仪器
Ultimate 3000 HPLC高效液相色谱仪(美国Thermo Fisher Scientific公司);Q-Exactive Orbitrap/MS四级杆轨道阱质谱(美国Thermo Fisher Scientific公司);Compound Discovereru处理软件(美国Thermo Fisher Scientific公司);SIMCA-P 13.0多元统计分析软件(瑞典Umetrics公司);Anke TGL-16B离心机(上海安亭科学仪器公司);BSA224S电子天平(德国Sartorius公司);KQ-500B型超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药
乙腈、甲醇、超纯水(德国Merck公司);甲酸、L-2-氯苯丙胺酸(美国Sigma-Aldrich公司)。收集太子参传统中药饮片(苏州天灵中药饮片有限公司)(批号:190730010)和太子参颗粒(江阴天江药业有限公司)(批号:19042031)样品各5份。所有样品均由南京中医药大学药学院刘训红教授鉴定为各自种属药材,留样凭证保存于江南大学附属医院中药房。
2 方法
2.1 供试品溶液的制备
太子参中药饮片:精密称取饮片10 g,加8倍量的蒸馏水浸泡30 min,武火煮沸后改文火再煎20 min,趁热滤出药液,药渣再加相当药材量6倍量的蒸馏水,煮沸后文火再煎煮30 min,滤过,合并滤液,蒸干。残渣加入800 μL甲醇和10 μL内标(2.8 mg/mL,二氯苯丙氨酸),置于组织研磨仪中65 Hz研磨90 s,随后40 KHz冰浴超声30 min,在-20 ℃下静置1 h,以12 000 rpm离心15 min(置于4 ℃离心机中),取上清液,过0.22 μm微孔滤膜,即得。太子参配方颗粒:精密称取配方颗粒10 g,加适量沸水溶解后稀释至与太子参饮片水煎液相同体积,之后制备方法同上。
2.2 测定条件
色谱条件:色谱柱:Hyper gold C18色谱柱(100 mm×2.1 mm×1.9 μm);流动相:水+5%乙腈+0.1%甲酸(A)和乙腈+0.1%甲酸(B);梯度洗脱程序:0~1.5 min(100%~80%A),1.5~9.5 min(80%~0%A),9.5~14.5(0%~0%A),14.5~14.6(0%~100%A),14.6~18(100%~100%A);流速0.35 mL/min;柱温40 ℃;进样量10 μL。
质谱条件:电喷雾离子源(ESI),在正离子模式下数据采集范围m/z50~1 000,加热器温度300 ℃;鞘气流速:45 arb; 辅助气流速:15 arb;尾气流速:1 arb;电喷雾电压:3.0 kV;毛细管温度:350 ℃;S-Lens RF Level,30%。在负离子模式下数据采集范围m/z50~1 100,加热器温度300 ℃;鞘气流速:45 arb;辅助气流速:15 arb;尾气流速:1 arb;电喷雾电压:3.2 KV;毛细管温度:350 ℃;S-Lens RF Level,60%。
2.3 数据处理与统计分析
采用Compound Discoverer软件对LC/MS检测数据进行提取和预处理,并在Excel 2010中对数据进行归一化及后期编辑,最后整理成二维数据矩阵形式,包含保留时间、分子量、峰强度等信息。将编辑后的数据矩阵导入SIMCA-P 13.0软件进行多元统计分析。采用PCA分析通过初步观察各样品的聚集情况,直观地表达不同剂型太子参之间的化学组成差异;随后采用PLS-DA和OPLS-DA进一步对样品进行分类,其中判别模型质量好坏的主要参数为R2Y(该值为模型的解释率)及Q2值(该值为模型的预测率),R2Y越接近1,表示模型越稳定,Q2>0.5表示预测率高。根据OPLS-DA模型的常用变量载荷评价参数(VIP)(VIP>1),并结合t-test的P值(P<0.05)来寻找差异性表达代谢物[9]。
2.4 差异化学成分的鉴定及其代谢通路分析
通过一级质谱确定精确的相对分子质量,二级质谱获得裂解信息,结合METLIN(http://metlin.Scripps.edu/,比较质谱的质荷比m/z或者精确分子质量mass)数据库在线搜索定性差异化学成分,将得到的差异化学成分导入MetaboAnalyst 3.0中,获得其所在代谢通路。
3 结果
3.1 总离子流色谱图
本实验供试品溶液制备分别考察了100%甲醇、70%甲醇、50%甲醇、30%甲醇4种溶剂对实验结果的影响,同时考察了15、30、45、60、75 min超声提取时间,结果表明,以100%甲醇作为溶剂的色谱峰形最优且超声提取30min的相对峰面积最大。因此,最终选择这种样品处理方法。流动相的选择分别考察了甲醇-水、乙腈-水、甲醇-0.1%甲酸水、乙腈-0.1%甲酸水、乙腈+0.1%甲酸水-乙腈+0.1%甲酸、5%乙腈+0.1%甲酸水-乙腈+0.1%甲酸,结果表明5%乙腈+0.1%甲酸水-乙腈+0.1%甲酸的峰形较好且分离度较高,因此将其确定为流动相。太子参传统中药饮片和配方颗粒样品在正负离子模式下的HPLC-Q-Exactive Orbitrap/MS总离子流色谱图(TIC)示于图1。
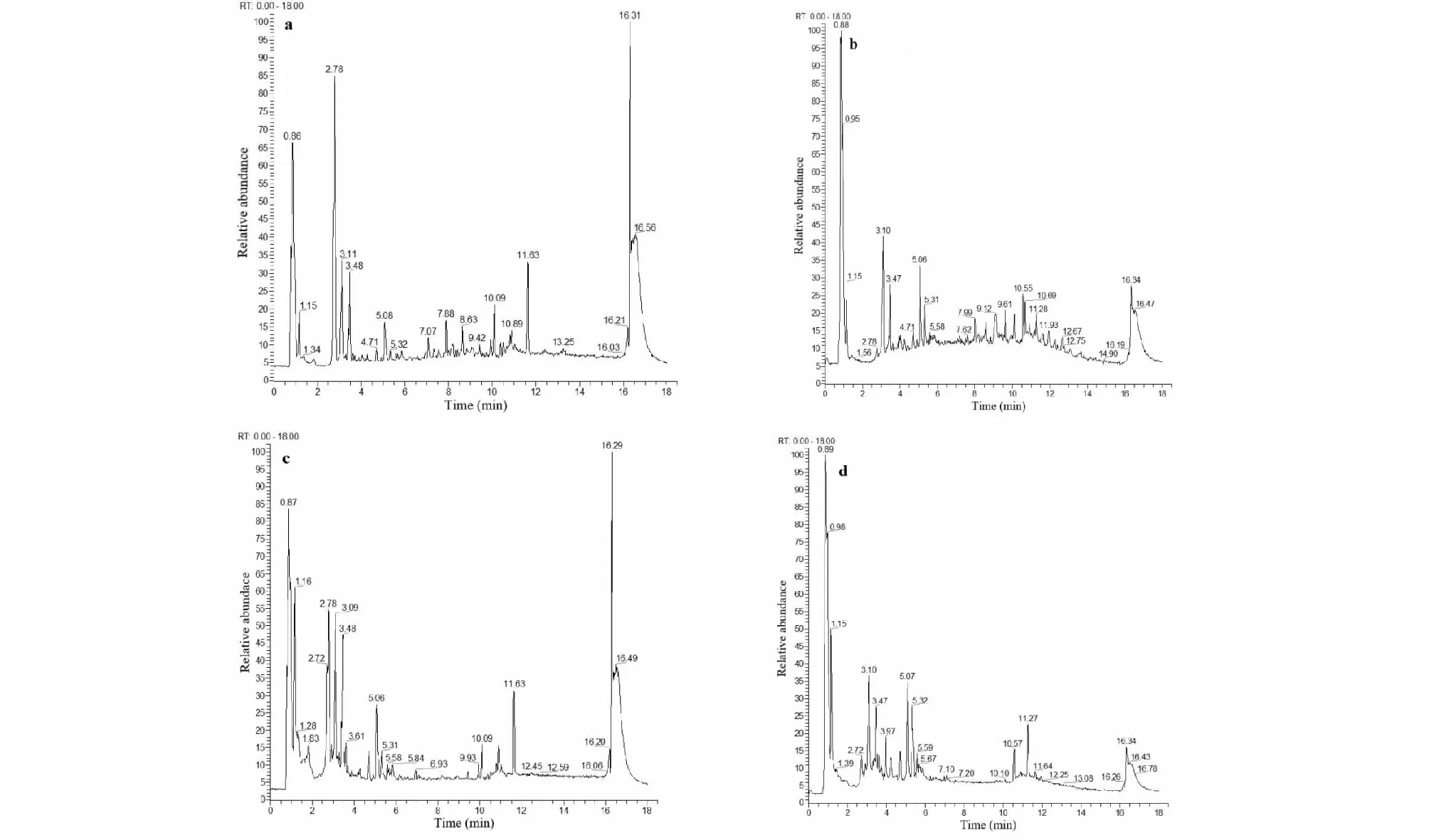
图1 总离子流图Fig.1 Total ion flow diagram注:a,c为正离子模式;b,d为负离子模式;a,b为太子参传统中药饮片;c,d为太子参配方颗。Note:a and c represent the positive mode;b and d represent the negative mode;a and b represent traditional Pseudostellariae Radix (PR) Chinese medicine decoction pieces;c and d represent PR formula particles.
3.2 多元统计分析
3.2.1 PCA分析
采用的PCA多变量模式识别方法对不同剂型太子参进行降维分析,图2为其PCA得分散点图,(正离子模式下,R2X=0.805,Q2=0.686;负离子模式下,R2X=0.886,Q2=0.654)。结果显示在正、负离子模式下,不同剂型太子参之间均具有很好的区分度,这表明太子参传统中药饮片和配方颗粒的化学成分存在明显差异。
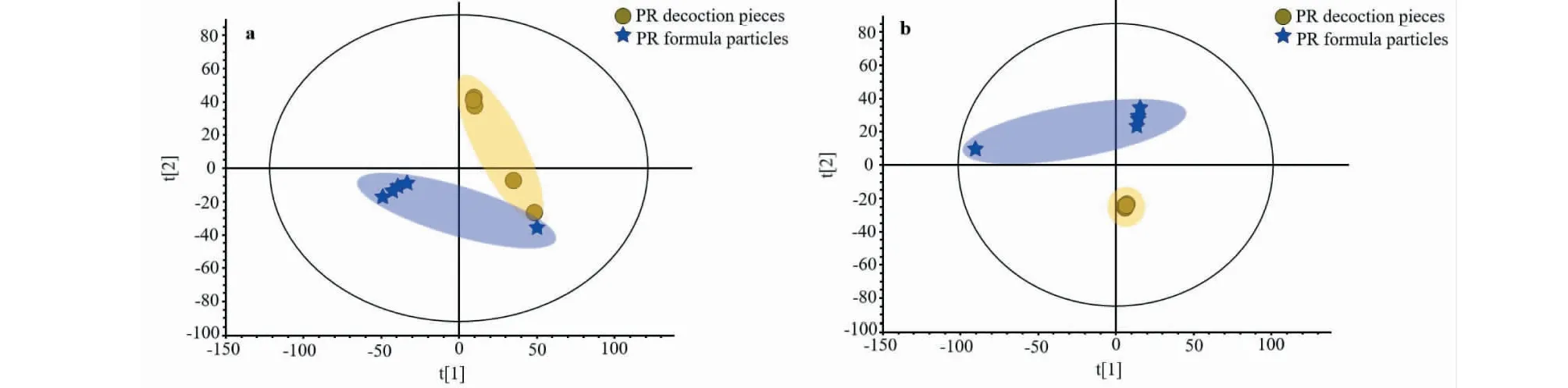
图2 PCA得分散点图Fig.2 Scatter plot of PCA 注:a为正离子模式;b为负离子模式。Note:a represents the positive mode;b represents the negative mode.
3.2.2 PLS-DA分析
PCA是无监督的分析方法,在确定差异成分时无法忽略组内误差和随机误差。因此采用有监督模式识别的方法PLS-DA来确定不同剂型太子参之间差异化学成分[10]。图3a和3c为不同剂型太子参在质谱正、负离子模式下PLS-DA得分散点图 (在正离子模式下,R2X=0.799,R2Y=0.84,Q2=0.452;在负离子模式下,R2X=0.884,R2Y=0.993,Q2=0.885),可以看出两类太子参样品明显分开,化学成分差异明显。排列实验是一种外部模型验证方法,主要用于验证PLS-DA 模型的拟合程度[11]。通过排列试验随机多次(n=200)改变分类变量y 的排列顺序得到相应不同的随机。从图3b和3d 可见,PLS-DA 模型排列实验中左端随机排列产生的R2和Q2值均小于右端的原始值,表明原始模型的预测能力大于随机排列y 变量的预测能力,即模型有效,可以进行后续的差异成分分析[12]。
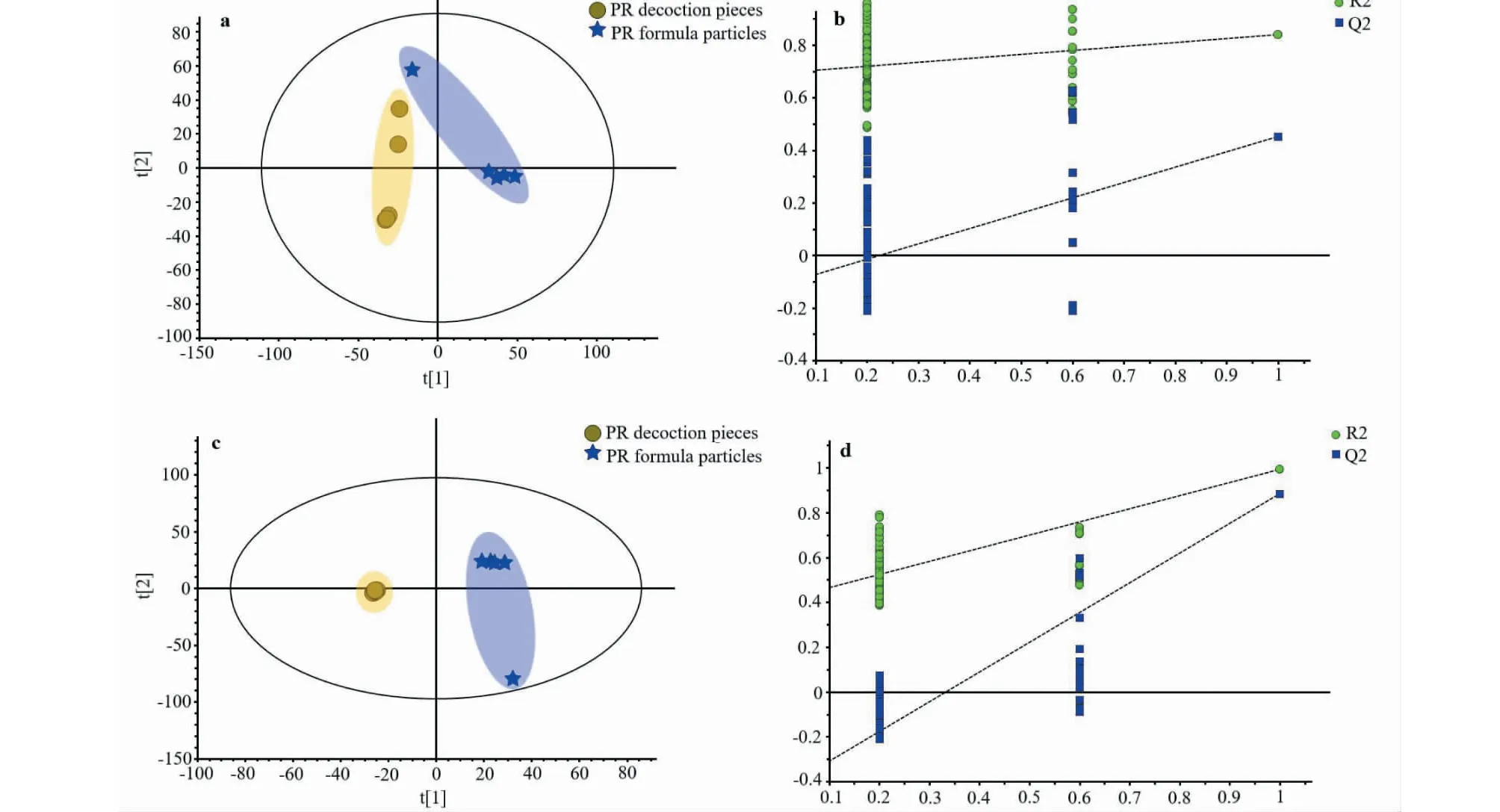
图3 PLS-DA得分散点图(a,c)和200个排列模型验证(b,d)Fig.3 Scatter plot of PLS-DA (a,c) and 200 permutation test model validation plot (b,d)注:a,b为正离子模式;c,d为负离子模式。Note:a and b represent the positive mode;c and d represent the negative mode.
3.2.3 OPLS-DA分析
OPLS-DA是以PLS模型的通过验证为基础,用于寻找差异化学成分的一种有监督式的分析方法[13]。图4为太子参饮片和颗粒OPLS-DA散点图(在正离子模式下,R2X=0.933,R2Y=1,Q2=0.673;在负离子模式下,R2X=0.884,R2Y=0.993,Q2=0.984),可以看出两种不同剂型太子参可以显著分开,且分类效果优于PCA分析,组内差异降低,更有利于准确地确定组间差异。图4c和4d是基于OPLS-DA分析,正负离子模式下的S-Plot,距离中心区域越远代表代谢物就是组间分离贡献越大的代谢物。使用常用VIP值描述变量的贡献程度,当VIP>1时,认为存在潜在的差异化学成分。

图4 OPLS-DA得分散点图(a,b)和S-Plot分析(c,d)Fig.4 Scatter plot of OPLS-DA (a,b) and analysis of S-Plot (c,d)注:a,c为正离子模式;b,d为负离子模式。Note:a and c represent the positive mode;b and d represent the negative mode.
3.3 差异化学成分的鉴定及其相对含量分析
采用OPLS-DA模型的VIP>1,并结合t检验(P<0.05)来寻找差异性表达代谢物。通过METLIN数据库在线搜索差异化学成分的精准质荷比,进而鉴定差异化学成分。在正离子模式下共找到98个差异化学成分,负离子模式下共找到52个差异化学成分,具体见表1和表2。
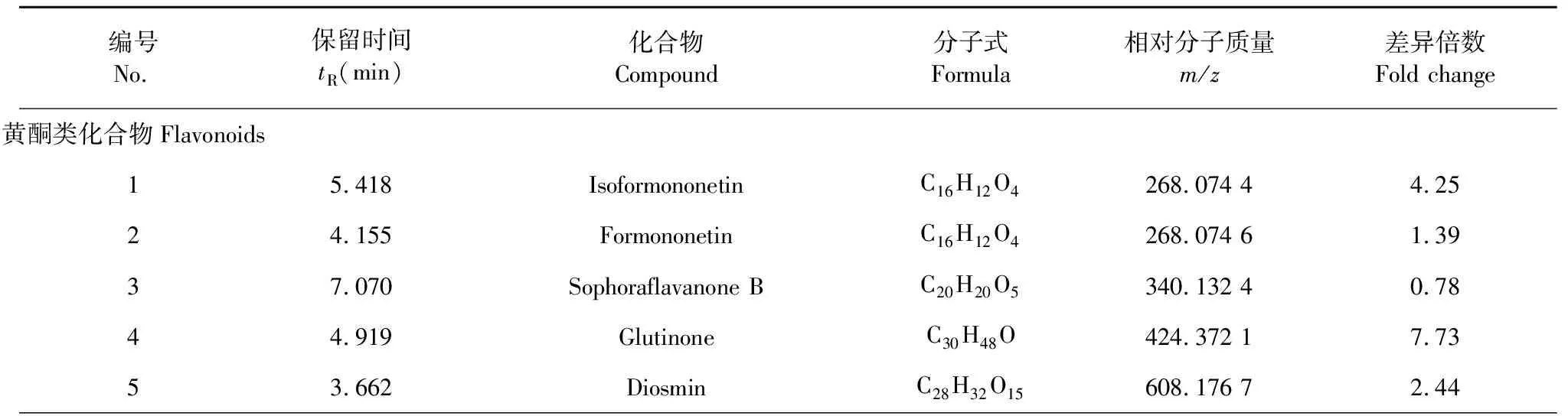
表1 正离子模式下鉴定出的不同剂型太子参差异化学成分(P<0.05)
续表1(Continued Tab.1)
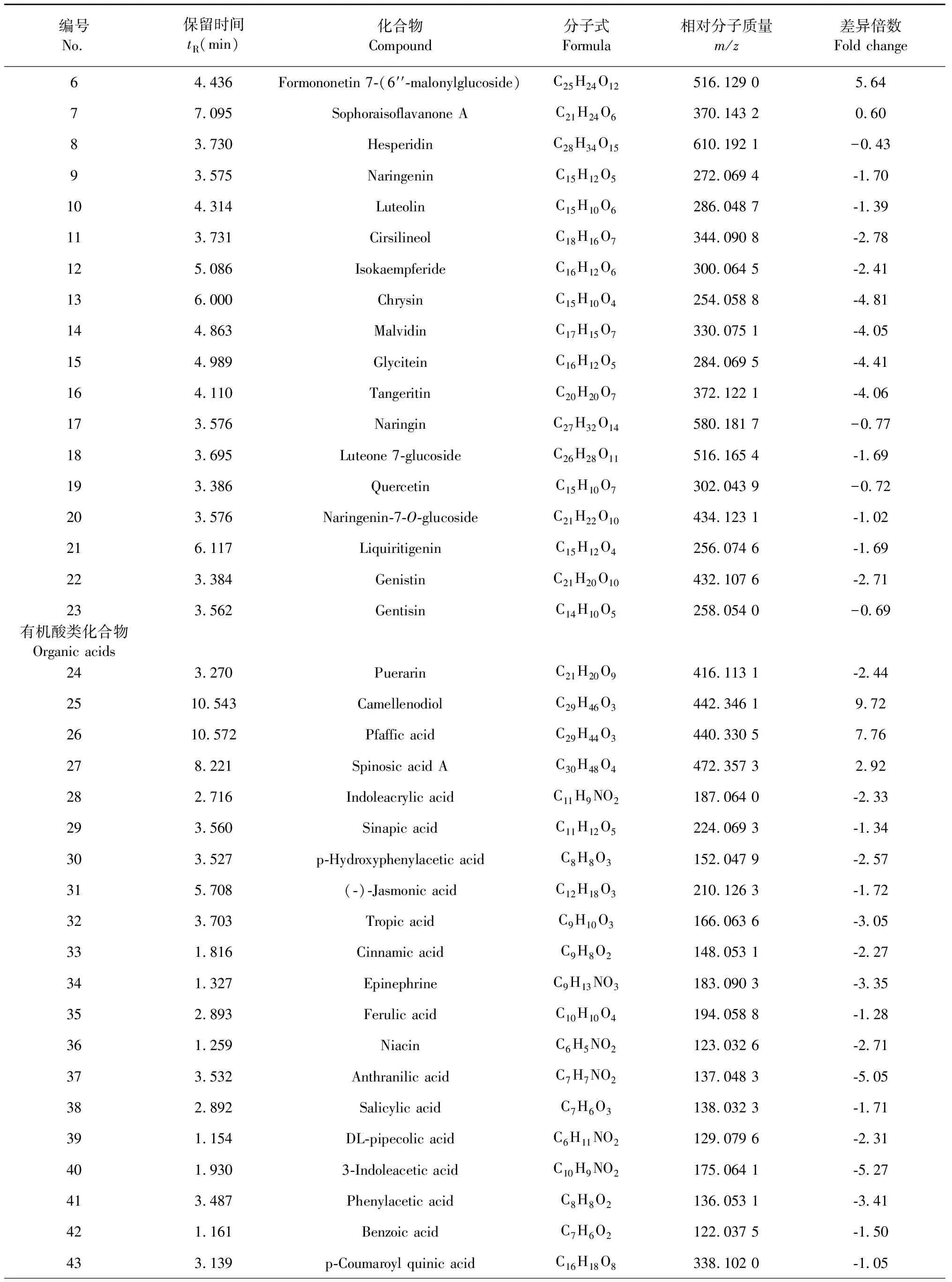
编号No.保留时间tR(min)化合物Compound分子式Formula相对分子质量m/z差异倍数Fold change64.436Formononetin 7-(6′′-malonylglucoside)C25H24O12516.129 05.64 77.095Sophoraisoflavanone AC21H24O6370.143 20.60 83.730HesperidinC28H34O15610.192 1-0.43 93.575NaringeninC15H12O5272.069 4-1.70 104.314LuteolinC15H10O6286.048 7-1.39 113.731CirsilineolC18H16O7344.090 8-2.78 125.086IsokaempferideC16H12O6300.064 5-2.41 136.000ChrysinC15H10O4254.058 8-4.81 144.863MalvidinC17H15O7330.075 1-4.05 154.989GlyciteinC16H12O5284.069 5-4.41 164.110TangeritinC20H20O7372.122 1-4.06 173.576NaringinC27H32O14580.181 7 -0.77 183.695Luteone 7-glucosideC26H28O11516.165 4-1.69 193.386QuercetinC15H10O7302.043 9-0.72 203.576Naringenin-7-O-glucosideC21H22O10434.123 1-1.02 216.117LiquiritigeninC15H12O4256.074 6-1.69 223.384GenistinC21H20O10432.107 6-2.71 233.562GentisinC14H10O5258.054 0-0.69 有机酸类化合物Organic acids243.270PuerarinC21H20O9416.113 1-2.44 2510.543CamellenodiolC29H46O3442.346 19.72 2610.572Pfaffic acidC29H44O3440.330 57.76 278.221Spinosic acid AC30H48O4472.357 32.92 282.716Indoleacrylic acidC11H9NO2187.064 0-2.33 293.560Sinapic acidC11H12O5224.069 3-1.34 303.527p-Hydroxyphenylacetic acidC8H8O3152.047 9-2.57 315.708(-)-Jasmonic acidC12H18O3210.126 3-1.72 323.703Tropic acidC9H10O3166.063 6-3.05 331.816Cinnamic acidC9H8O2148.053 1-2.27 341.327EpinephrineC9H13NO3183.090 3-3.35 352.893Ferulic acidC10H10O4194.058 8-1.28 361.259NiacinC6H5NO2123.032 6-2.71 373.532Anthranilic acidC7H7NO2137.048 3-5.05 382.892Salicylic acidC7H6O3138.032 3-1.71 391.154DL-pipecolic acidC6H11NO2129.079 6-2.31 401.9303-Indoleacetic acidC10H9NO2175.064 1-5.27 413.487Phenylacetic acidC8H8O2136.053 1-3.41 421.161Benzoic acidC7H6O2122.037 5-1.50 433.139p-Coumaroyl quinic acidC16H18O8338.102 0-1.05
续表1(Continued Tab.1)
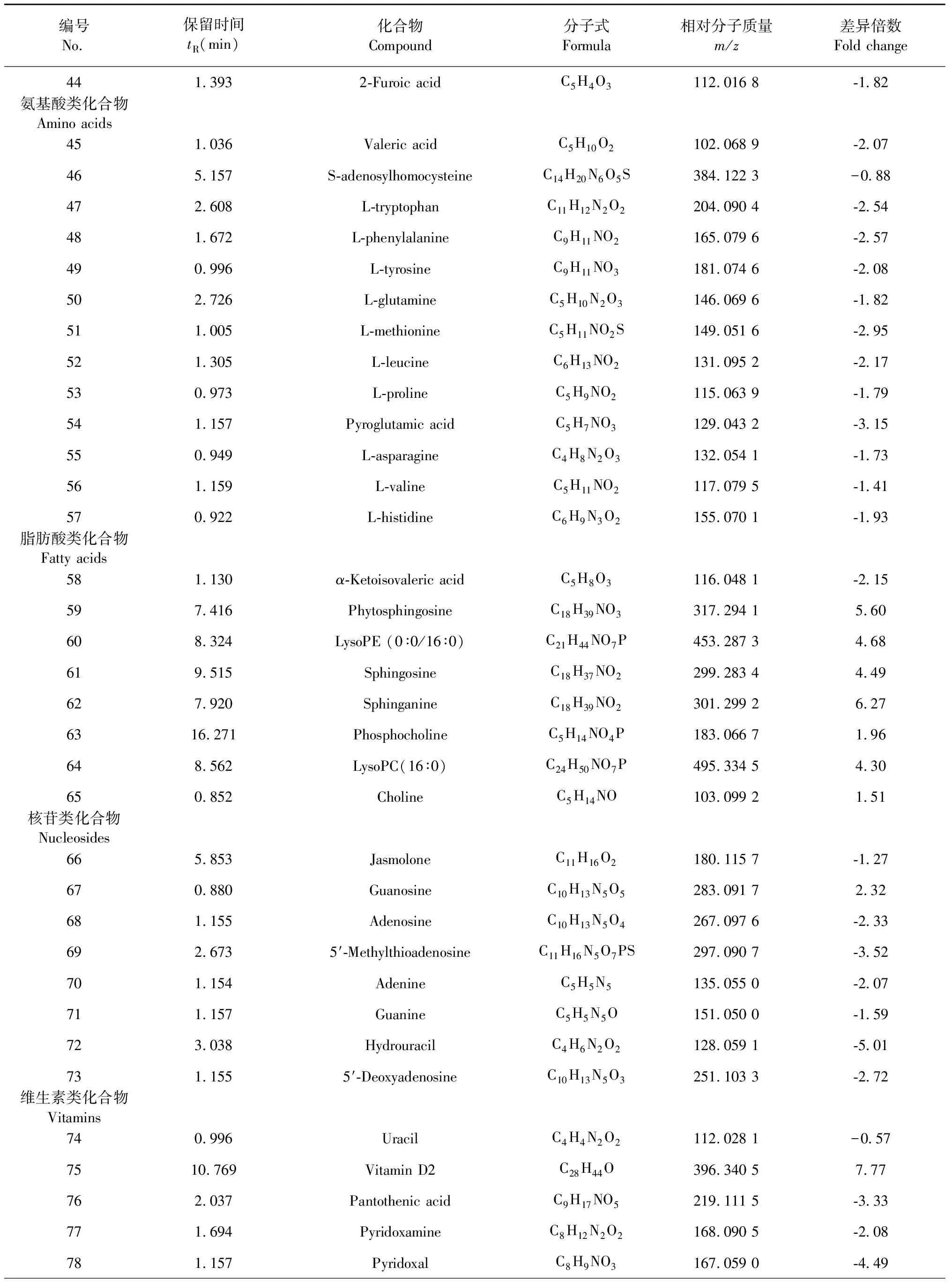
编号No.保留时间tR(min)化合物Compound分子式Formula相对分子质量m/z差异倍数Fold change441.3932-Furoic acidC5H4O3112.016 8-1.82 氨基酸类化合物Amino acids451.036Valeric acidC5H10O2102.068 9-2.07 465.157S-adenosylhomocysteineC14H20N6O5S384.122 3-0.88 472.608L-tryptophanC11H12N2O2204.090 4-2.54 481.672L-phenylalanineC9H11NO2165.079 6-2.57 490.996L-tyrosineC9H11NO3181.074 6-2.08 502.726L-glutamineC5H10N2O3146.069 6-1.82 511.005L-methionineC5H11NO2S149.051 6-2.95 521.305L-leucineC6H13NO2131.095 2-2.17 530.973L-prolineC5H9NO2115.063 9-1.79 541.157Pyroglutamic acidC5H7NO3129.043 2-3.15 550.949L-asparagineC4H8N2O3132.054 1-1.73 561.159L-valineC5H11NO2117.079 5-1.41 570.922L-histidineC6H9N3O2155.070 1-1.93 脂肪酸类化合物Fatty acids581.130α-Ketoisovaleric acidC5H8O3116.048 1-2.15 597.416PhytosphingosineC18H39NO3317.294 15.60 608.324LysoPE (0∶0/16∶0)C21H44NO7P453.287 34.68 619.515SphingosineC18H37NO2299.283 44.49 627.920SphinganineC18H39NO2301.299 26.27 6316.271PhosphocholineC5H14NO4P183.066 71.96 648.562LysoPC(16∶0)C24H50NO7P495.334 54.30 650.852CholineC5H14NO103.099 21.51 核苷类化合物Nucleosides665.853JasmoloneC11H16O2180.115 7-1.27 670.880GuanosineC10H13N5O5283.091 72.32 681.155AdenosineC10H13N5O4267.097 6-2.33 692.6735′-MethylthioadenosineC11H16N5O7PS297.090 7-3.52 701.154AdenineC5H5N5135.055 0-2.07 711.157GuanineC5H5N5O151.050 0-1.59 723.038Hydrouracil C4H6N2O2128.059 1-5.01 731.1555′-DeoxyadenosineC10H13N5O3251.103 3-2.72 维生素类化合物Vitamins740.996UracilC4H4N2O2112.028 1-0.57 7510.769Vitamin D2 C28H44O396.340 57.77 762.037Pantothenic acidC9H17NO5219.111 5-3.33 771.694PyridoxamineC8H12N2O2168.090 5-2.08 781.157PyridoxalC8H9NO3167.059 0-4.49
续表1(Continued Tab.1)
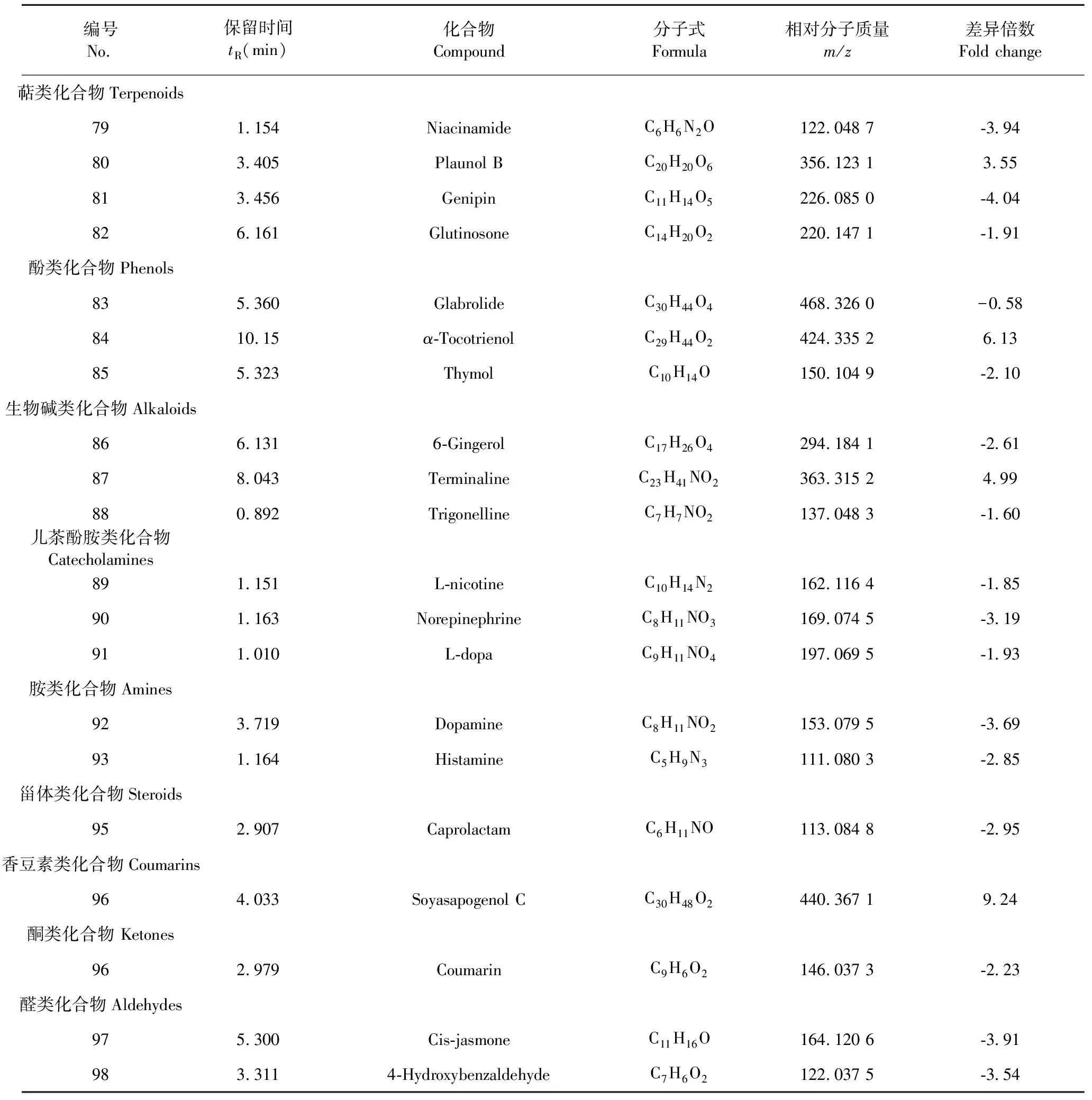
编号No.保留时间tR(min)化合物Compound分子式Formula相对分子质量m/z差异倍数Fold change萜类化合物Terpenoids791.154NiacinamideC6H6N2O122.048 7-3.94 803.405Plaunol BC20H20O6356.123 13.55 813.456GenipinC11H14O5226.085 0-4.04 826.161GlutinosoneC14H20O2220.147 1-1.91 酚类化合物Phenols835.360GlabrolideC30H44O4468.326 0-0.58 8410.15α-TocotrienolC29H44O2424.335 26.13 855.323ThymolC10H14O150.104 9-2.10 生物碱类化合物Alkaloids866.1316-GingerolC17H26O4294.184 1-2.61 878.043TerminalineC23H41NO2363.315 24.99 880.892TrigonellineC7H7NO2137.048 3-1.60 儿茶酚胺类化合物Catecholamines891.151L-nicotineC10H14N2162.116 4-1.85 901.163Norepinephrine C8H11NO3169.074 5-3.19 911.010L-dopaC9H11NO4197.069 5-1.93 胺类化合物Amines923.719DopamineC8H11NO2153.079 5-3.69 931.164HistamineC5H9N3111.080 3-2.85 甾体类化合物Steroids952.907CaprolactamC6H11NO113.084 8-2.95 香豆素类化合物Coumarins964.033Soyasapogenol CC30H48O2440.367 19.24 酮类化合物 Ketones962.979CoumarinC9H6O2146.037 3-2.23 醛类化合物Aldehydes975.300Cis-jasmoneC11H16O164.120 6-3.91 983.3114-HydroxybenzaldehydeC7H6O2122.037 5-3.54

表2 负离子模式下鉴定出的不同剂型太子参差异化学成分(P<0.05)
续表2(Continued Tab.2)
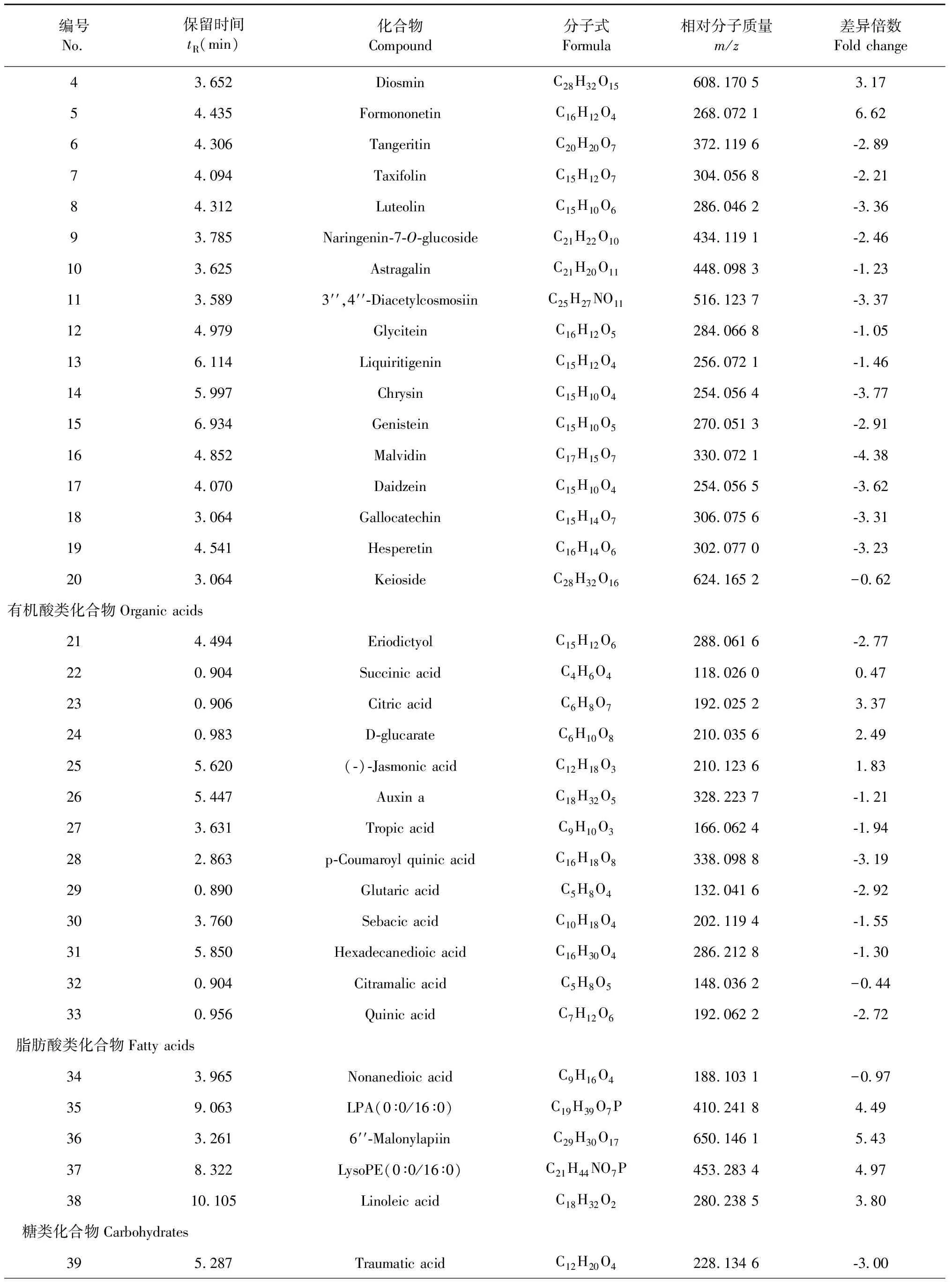
编号No.保留时间tR(min)化合物Compound分子式Formula相对分子质量m/z差异倍数Fold change43.652 Diosmin C28H32O15608.170 5 3.17 54.435 FormononetinC16H12O4268.072 1 6.62 64.306 TangeritinC20H20O7372.119 6 -2.89 74.094 TaxifolinC15H12O7304.056 8 -2.21 84.312 LuteolinC15H10O6286.046 2 -3.36 93.785 Naringenin-7-O-glucosideC21H22O10434.119 1 -2.46 103.625 AstragalinC21H20O11448.098 3 -1.23 113.589 3′′,4′′-DiacetylcosmosiinC25H27NO11516.123 7 -3.37 124.979 GlyciteinC16H12O5284.066 8 -1.05 136.114 LiquiritigeninC15H12O4256.072 1 -1.46 145.997 ChrysinC15H10O4254.056 4 -3.77 156.934 GenisteinC15H10O5270.051 3 -2.91 164.852 MalvidinC17H15O7330.072 1 -4.38 174.070 DaidzeinC15H10O4254.056 5 -3.62 183.064 GallocatechinC15H14O7306.075 6 -3.31 194.541 HesperetinC16H14O6302.077 0 -3.23 203.064 KeiosideC28H32O16624.165 2 -0.62 有机酸类化合物Organic acids214.494 EriodictyolC15H12O6288.061 6 -2.77 220.904 Succinic acidC4H6O4118.026 0 0.47 230.906 Citric acidC6H8O7192.025 2 3.37 240.983 D-glucarateC6H10O8210.035 6 2.49 255.620 (-)-Jasmonic acidC12H18O3210.123 6 1.83 265.447 Auxin aC18H32O5328.223 7 -1.21 273.631 Tropic acidC9H10O3166.062 4 -1.94 282.863 p-Coumaroyl quinic acidC16H18O8338.098 8 -3.19 290.890 Glutaric acidC5H8O4132.041 6 -2.92 303.760 Sebacic acidC10H18O4202.119 4 -1.55 315.850 Hexadecanedioic acidC16H30O4286.212 8 -1.30 320.904 Citramalic acidC5H8O5148.036 2 -0.44 330.956 Quinic acidC7H12O6192.062 2 -2.72 脂肪酸类化合物Fatty acids343.965 Nonanedioic acidC9H16O4188.103 1 -0.97 359.063 LPA(0∶0/16∶0)C19H39O7P410.241 8 4.49 363.261 6′′-MalonylapiinC29H30O17650.146 1 5.43 378.322 LysoPE(0∶0/16∶0)C21H44NO7P453.283 4 4.97 3810.105 Linoleic acidC18H32O2280.238 5 3.80 糖类化合物Carbohydrates395.287 Traumatic acidC12H20O4228.134 6 -3.00
续表2(Continued Tab.2)
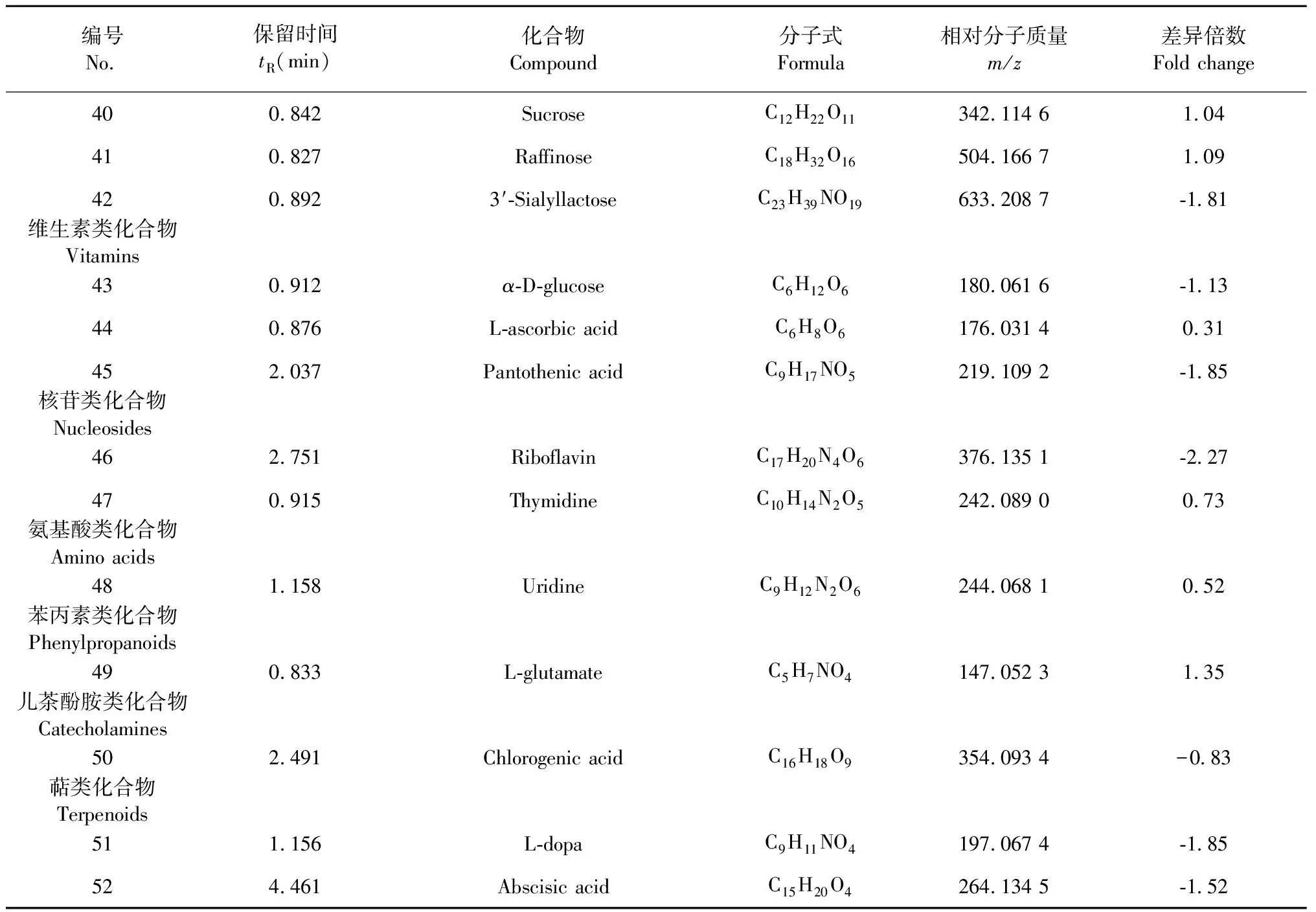
编号No.保留时间tR(min)化合物Compound分子式Formula相对分子质量m/z差异倍数Fold change400.842 SucroseC12H22O11342.114 6 1.04 410.827 RaffinoseC18H32O16504.166 7 1.09 420.892 3′-SialyllactoseC23H39NO19633.208 7 -1.81 维生素类化合物Vitamins430.912 α-D-glucoseC6H12O6180.061 6 -1.13 440.876 L-ascorbic acidC6H8O6176.031 4 0.31 452.037 Pantothenic acidC9H17NO5219.109 2 -1.85 核苷类化合物Nucleosides462.751 RiboflavinC17H20N4O6376.135 1 -2.27 470.915 ThymidineC10H14N2O5242.089 0 0.73 氨基酸类化合物Amino acids481.158 UridineC9H12N2O6244.068 1 0.52 苯丙素类化合物Phenylpropanoids490.833 L-glutamateC5H7NO4147.052 3 1.35 儿茶酚胺类化合物Catecholamines502.491 Chlorogenic acidC16H18O9354.093 4 -0.83 萜类化合物Terpenoids511.156 L-dopaC9H11NO4197.067 4 -1.85 524.461 Abscisic acidC15H20O4264.134 5 -1.52
3.4 差异化学成分的相对含量分析
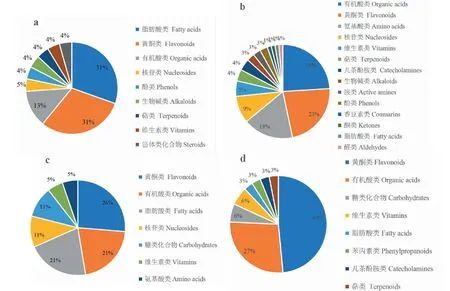
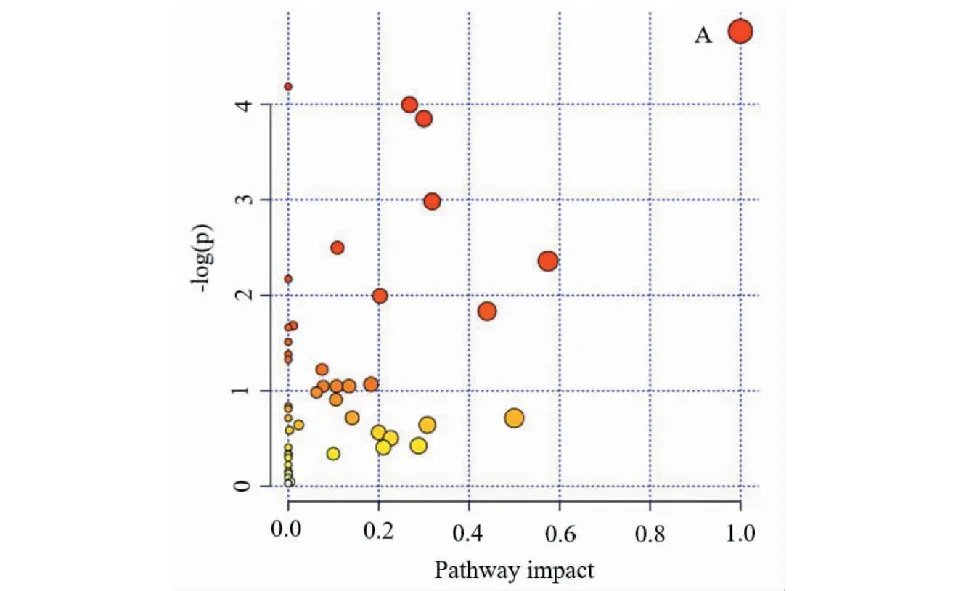
正离子模式下太子参饮片(TY)相对含量>太子参颗粒(TK)相对含量的有23个,TY 通过MetaboAnalyst网站构建代谢通路分析,将上述鉴定的化合物的KEGG导入MetaboAnalyst进行通路分析。利用拓扑Fenix,代谢通路影响的临界值(Impact值)设置为0.6,大于这个值将被选择作为潜在的关键代谢通路。如图6所示,圆点的半径大小代表代谢通路的Impact值,Impact值越大,半径越大;圆点的颜色代表代谢通路的P值,P值越小,颜色越红。综上,共富集到异喹啉生物碱生物合成(A)1条重要的代谢通路,主要涉及的差异化学成分是L-tyrosine(酪氨酸)、L-dopa(左旋多巴)、dopamine(多巴胺)。 图5 正负离子模式下不同剂型太子参差异化学成分的含量对比分析Fig.5 Comparative analysis of contents of different chemical components in Pseudostellariae Radix with different dosage forms under positive and negative ions mode注:a为正离子模式TY相对含量>TK相对含量的差异化学成分;b为正离子模式TY相对含量 图6 信号通路分析 Fig.6 Analysis of pathway impact 注:A为异喹啉生物碱生物合成。Note:A represents isoquinoline alkaloid biosynthesis. 本实验建立了基于HPLC-Q-Exactive Orbitrap/MS结合多元统计分析技术的不同剂型太子参差异化学成分的分析方法,并从样品制备、色谱图分析、数据处理、代谢通路分析等方面进行探讨,找出累计差异显著的化学成分,探索其变化规律。实验结果表明,HPLC-Q-Exactive Orbitrap/MS可以准确获得化合物的分子质量和裂解碎片质量信息,快速鉴定化合物的结构。经多元统计分析发现不同剂型太子参样品中化学成分存在明显差异,并在正、负离子模式下分别找到98个和52个差异化学成分,这些成分主要集中在黄酮、有机酸、脂肪酸、氨基酸类化合物中,主要涉及类异喹啉生物碱生物合成代谢。此外,无论是在正离子或负离子模式下,太子参颗粒中相对含量较高的差异化学成分的数量和种类均多于太子参饮片,包括具有抗肿瘤作用的黄酮类化合物、含有抗菌抗氧化作用的有机酸类化合物、具有促进免疫作用的氨基酸类化合物等。 该结果可为揭示不同剂型对太子参代谢产物合成积累的影响规律以及不同剂型太子参品质形成机制提供基础资料,为复杂体系样品分析、差异化学成分的鉴定提供一种可靠和准确的参考方法。3.5 代谢通路分析
4 结论

