氧化镁在不同体系中的水化研究
吴 丹,张文燕,路绍琰,张 辉,张 琦,黄西平
(自然资源部 天津海水淡化与综合利用研究所,天津 300192)
近年来,氧化镁水化法制备氢氧化镁的研究较多[1-4],其原料主要来源为菱镁矿煅烧的氧化镁。菱镁矿储量丰富,其煅烧生产氧化镁工艺简单,为水化法提供了大量原材料[5-6]。此外,氯化镁也是氧化镁原料的来源之一[7-8]。海水中存在大量镁资源,尤其食盐工业产生大量的氯化镁,盐湖中氯化镁的储量也相当丰富,由氯化镁煅烧得到的氧化镁水化也可制备氢氧化镁。虽然氢氧化镁可由氧化镁水化制得,然而并不是所有的氧化镁都能很容易地与水反应而生成氢氧化镁。轻烧氧化镁能跟水完全反应生成氢氧化镁,而重烧和中烧氧化镁则不能完全反应[9]。

1 实验
1.1 仪器与试剂
试剂。轻烧粉(MgO),青海西部镁业,工业级,活性(柠檬酸法)1 min 50 s;氯化铵(NH4Cl)和硫酸铵((NH4)2SO4),天津市光复精细化工研究所,分析纯;蒸馏水,分析纯。
仪器。METTLER PL403 精密电子天平;2NCLT10000ML 智能恒温电加热磁力搅拌器;DH-101 恒温干燥箱;KSY-15 型马弗炉。
1.2 实验方法
纯水体系。称取一定量MgO溶于蒸馏水中,配成悬浮液置于四口烧瓶中,按照正交实验设计条件开展实验。实验结束后抽滤得到白色固体,在烘箱中80 ℃烘干12 h,产物测定水化率。
铵盐体系。称取一定量蒸馏水置于四口烧瓶中,随后加入一定摩尔比的调浆后的MgO和NH4Cl或 (NH4)2SO4溶液,按照正交实验设计条件开展实验,实验过程中产生的NH3用硫酸溶液吸收。实验结束后抽滤得到白色固体,用无水乙醇洗涤至滤液遇硝酸银溶液不产生沉淀为止,洗去水溶性杂质,在烘箱中80 ℃烘干12 h,产物测定水化率。
1.3 氧化镁水化率的测定
将干燥后的水化产物经500 ℃煅烧2 h,使氢氧化镁完全分解,用下公式计算水化率:
式中:η——水化率;m1——水化产物干燥完全后煅烧前质量;m2——水化产物煅烧后质量。
1.4 正交实验设计
选取反应温度、反应时间、固液比、搅拌速度作为因素,将其各自3种变化作为水平,采用正交表L9(34),以MgO水化率为考核指标进行正交实验,共安排9次实验,正交实验表如表1所示。
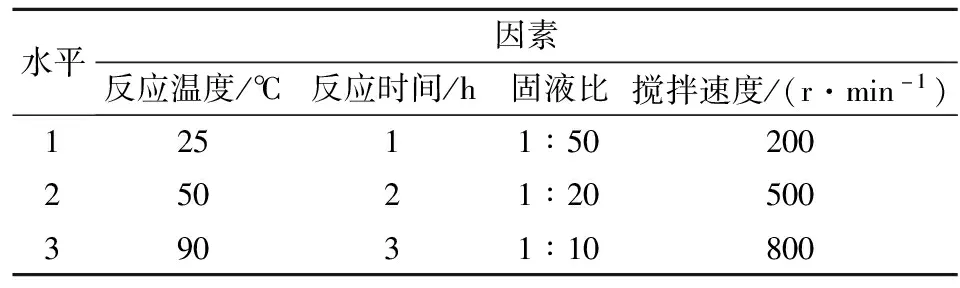
表1 正交实验因素水平表Tab.1 Factor level table of orthogonal experimental
2 结果与讨论
2.1 纯水体系氧化镁水化实验
正交实验结果中各因素对应的极差,反应了该因素水平的变化对实验结果的影响程度。极差越大,表示该因素水平的变化对实验结果的影响程度越大。
纯水体系极差分析如表2所示。

表2 纯水体系极差分析表Tab.2 Range analysis of pure water system
表2的正交实验结果表明,各因素对MgO水化率的影响主次顺序为:反应时间>固液比>反应温度>搅拌速度。较优实验条件为:反应温度90 ℃,反应时间3 h,固液比1 ∶10,搅拌速度500 r/min。
极差分析不能估计实验中以及实验结果测定中必然存在的误差大小,为了弥补这个缺点,可以采用方差分析的方法。此实验所用正交表除各因素列以外,无空白列作对照,所以误差分析只能取相对误差,将均方最小的因素对应的方差归为误差。取显著性水平A=0.05,方差分析结果如表3所示。
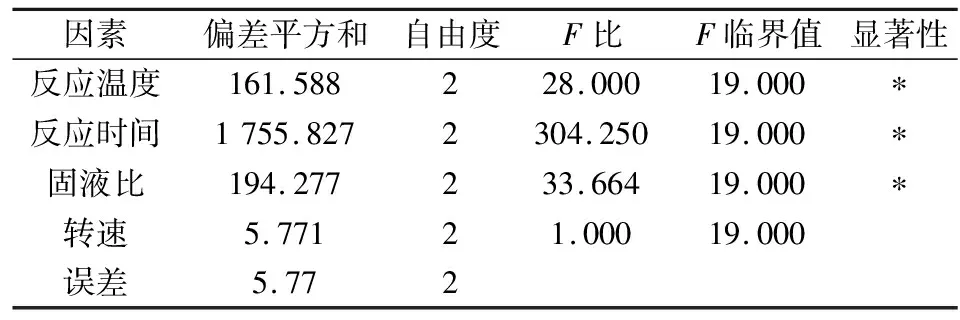
表3 纯水体系方差分析表Tab.3 Analysis of variance of pure water system
表3的方差分析结果表明,反应温度、反应时间和固液比对MgO水化率有显著的影响,而搅拌速度的影响可以忽略。
2.2 氯化铵体系氧化镁水化实验
氯化铵体系极差分析如表4所示。
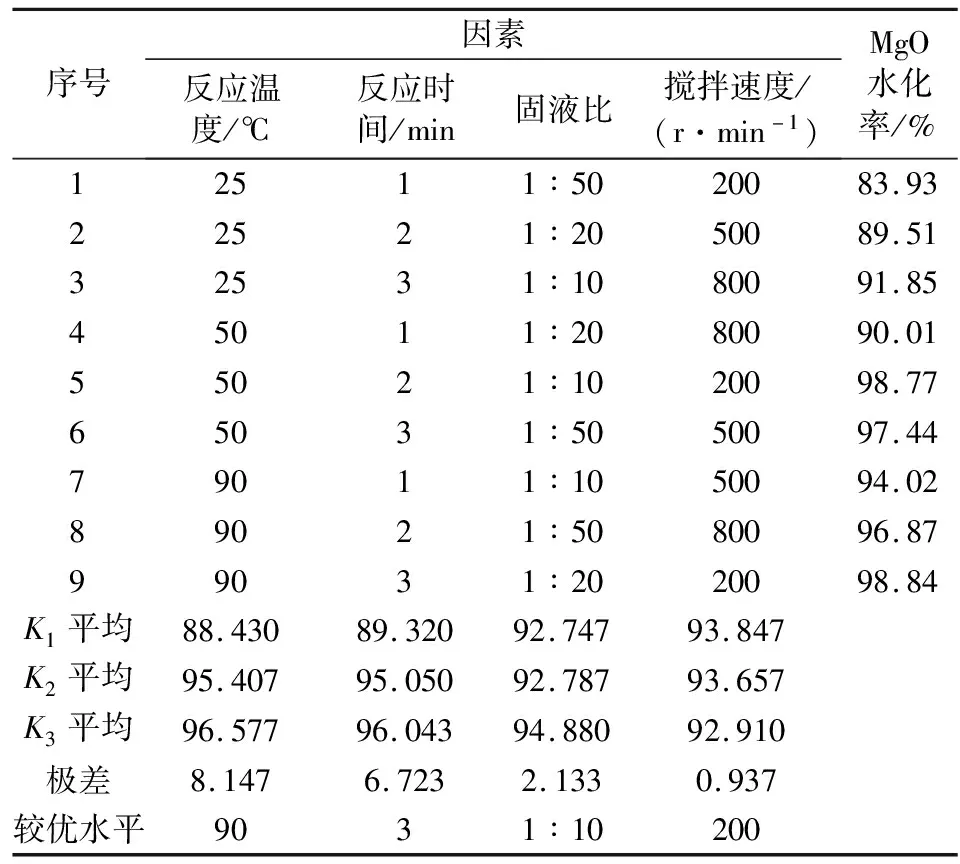
表4 氯化铵体系极差分析表Tab.4 Range analysis table of ammonium chloride system
表4的正交实验结果表明,各因素对MgO水化率的影响主次顺序为:反应温度>反应时间>固液比>搅拌速度。加入NH4Cl为水化剂,主要影响因素变为反应温度,其次是反应时间。
氯化铵体系方差分析结果如表5所示。

表5 氯化铵体系方差分析表Tab.5 Analysis of variance of ammonium chloride system
表5的方差分析结果表明,反应温度和反应时间对MgO水化率都有比较显著的影响,而固液比的影响较弱,搅拌速度的影响可以忽略。较优实验条件为:反应温度90 ℃,反应时间3 h,固液比1 ∶10,搅拌速度200 r/min。
2.3 硫酸铵体系氧化镁水化实验
硫酸铵体系极差分析如表6所示。

表6 硫酸铵体系极差分析表Tab.6 Range analysis table of ammonium sulfate system
表6的正交实验结果表明,各因素对MgO水化率的影响主次顺序为:反应温度>反应时间>搅拌速度>固液比。加入(NH4)2SO4为水化剂,主要影响因素也变为反应温度,其次是反应时间。
硫酸铵体系方差分析结果如表7所示。
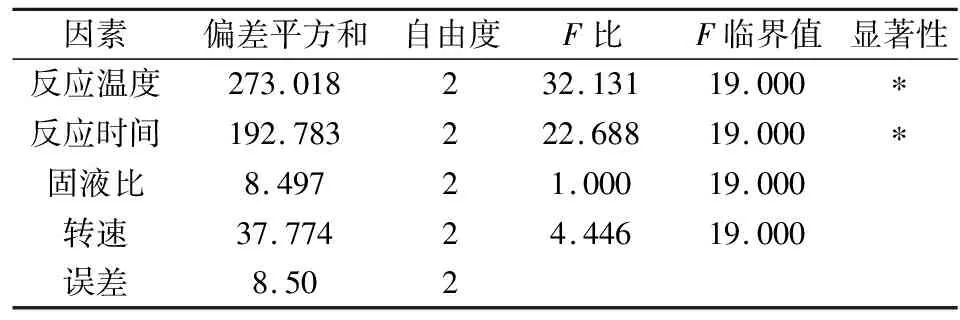
表7 硫酸铵体系方差分析表Tab.7 Analysis of variance of ammonium sulfate system
表7的方差分析结果表明,反应温度和反应时间对MgO水化率都有比较显著的影响,而搅拌速度的影响较弱,固液比的影响可以忽略。较优实验条件为:反应温度90 ℃,反应时间3 h,固液比1 ∶10,搅拌速度800 r/min。
2.4 小结
纯水体系中,反应时间影响最大,而在铵盐体系中,反应温度影响最大。反应温度90 ℃,反应时间3 h,固液比1 ∶10,纯水体系中,MgO的水化率最高可达80.75%。氯化铵体系可以加速MgO水化,水化率最高可达98.84%。而硫酸铵体系MgO的水化率最高只有68.45%,且普遍偏低。
纯水体系中,MgO水化反应的方程式可表示为[9]:
MgO(s)+H2O(l)→MgOH+(surface)+OH-(aq)
MgOH+(surface)+OH-(aq)→MgOH+·OH-(surface)
MgOH+·OH-(surface)→Mg2+(aq)+2OH-(aq)
Mg2+(aq)+2OH-(aq)→Mg(OH)2(s)
铵盐体系中,MgO水化反应的方程式可表示为[12]:
MgO(s)+H2O(l)→Mg(OH)2(s)
NH4OH(aq)→NH3(g)↑+H2O(aq)

3 结论与展望

MgO水化法技术路线新颖,工艺简单,原料廉价易得,且利用率高,生产成本较低,对环境无污染,具有较高的工业价值,是一种具有发展潜力并适合中国国情的方法。我国目前是世界上最大的轻烧粉出口国,有极大的资源优势。用轻烧粉做原料,采用水合工艺生产氢氧化镁,可以提升产品的附加值,有利于促进氢氧化镁制备工艺技术的改革与进步,有利于促进氢氧化镁产业的发展。

