牙龈卟啉单胞菌与PDCD4在食管鳞状细胞癌中的表达及相关性
李若楠,刘怡文,刘雅莉,王立东,张 灏,詹启敏,高社干
食管癌是世界上最常见的消化道恶性肿瘤之一,亦是我国最高发的恶性肿瘤之一,其发病率居我国恶性肿瘤第六位,死亡率居第四位[1]。根据病理类型可以将食管癌分为食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)和食管腺状细胞癌(esophageal adenoid cell carcinoma,EADC)两种亚型。据国际癌症研究机构估算,2012年约有45万例食管癌病例,其中ESCC病例88%,EADC病例12%[2]。我国人口众多且ESCC发病率高达95%以上,导致中国约占地球上所有ESCC病例的一半[3]。
牙龈卟啉单胞菌(Porphyromonasgingivalis,Pg)是一种革兰氏阴性厌氧菌,作为慢性牙周炎的主要病原体[4],在长期作用下可改变口腔的微环境而促进肿瘤的发生[5],数年前已有多项研究证实Pg与口腔鳞癌的发生密切相关[6-9],近几年有研究发现Pg与食管鳞癌的发生也存在相关性[10]。
PDCD4是控制细胞凋亡的重要因子,人类Pdcd4基因位于染色体10q24, 编码485个氨基酸[11],含有表示氨基端和羧基端核定位信号的基本区域,除了影响细胞程序性死亡外,还可以通过抑制蛋白翻译的起始因子从而抑制肿瘤的发生、发展。已有研究表明Pdcd4在食管鳞状细胞癌中表达明显下调或缺失[12]。
为了进一步探究Pg和PDCD4在食管鳞癌中的表达和临床意义以及两者之间的关系,本研究通过免疫组织化学染色法,检测Pg和PDCD4在食管鳞癌组织和癌旁正常组织中的表达情况,并分析其相关性及临床意义和预后价值。
1 材料与方法
1.1 材料回顾性收集2016年2月至2017年3月在河南科技大学第一附属医院手术的30例食管鳞癌患者的癌组织标本和癌旁标本及基本临床资料。其中男性20例,女性10例;年龄60岁以上22例,60岁以下8例;高分化2例,中分化10例,低分化18例;淋巴结转移阳性12例,无转移18例;浸润深度侵及外膜25例,未侵及外膜5例。
1.2 方法
1.2.1 主要试剂与仪器Pg兔抗人单克隆抗体及兔单克隆抗体PDCD4均购自Abcam公司,免疫组化SP超敏试剂盒购自中杉金桥生物技术有限公司,DAB显色试剂盒、0.01 mol·L-1柠檬酸抗原修复(pH 6.0)、PBS 磷酸盐缓冲液均购自索莱宝生物科技有限公司,苏木素染液、中性树胶、盖玻片购自迈新生物技术有限公司。修复方法选用微波炉抗原修复。
1.2.2 实验步骤与方法所有组织标本经10%的福尔马林固定,石蜡包埋、切片,制成3 μm厚的玻片,放入烤箱1 h,二甲苯脱蜡,放入梯度酒精中进行水化,再将组织切片放入加热过的柠檬酸抗原修复液中放入微波炉进行抗原修复,SP法免疫组化染色。染色步骤按照SP超敏试剂盒说明操作,DAB显色、苏木素衬染、梯度酒精脱水、中性树胶封片固定。
1.2.3 免疫组化结果判读根据组织切片胞浆及胞核着色的阳性细胞数和着色面积进行评分,在组织切片中随机挑选5个高倍镜视野观察,对组织切片的染色强度和染色面积进行半定量分析。染色强度评分标准为:①0分,未着色,阴性;②1分,着色较弱,呈浅黄色,弱阳性;③2分,中性着色,呈棕黄色,中度阳性;④3分,着色较强,呈棕褐色,强阳性。染色面积评分标准为:①阳性细胞占0%~5%,0分;②阳性细胞占6%~25%,1分;③阳性细胞占25%~75%,2分;④阳性细胞占>75%,3分。免疫组化评分计算方法:染色强度×染色面积得总分,0~12分分别代表:①0分,阴性;②1~3分,弱阳性;③4-8分,中阳性;④9~12分,强阳性。本实验将0分定义为阴性,1分及以上定为阳性。
1.3 统计学处理采用SPSS 23.0统计软件对实验数据进行分析,采用卡方检验对食管癌组织及癌旁正常组织中的PDCD4、Pg的表达率及其与临床病理特征进行分析;采用Spearman相关分析对PDCD4和Pg的表达相关性进行分析;采用Kaplan-Meier方法对总生存期(overall survival,OS)结果进行生存分析;以P<0.05为差异具有统计学意义。
2 结果
2.1 PDCD4免疫组化结果
PDCD4 蛋白在癌旁正常组织中以细胞核中呈不同染色程度的棕黄色颗粒为特点,少数位于细胞质,而在食管癌组织中细胞核着色明显下降并有向细胞质中转移的倾向(图1)。PDCD4蛋白在30例鳞癌组织中12例阳性,18例阴性,阳性率为40%;在30例癌旁正常组织中全部阳性,阳性率100%。经卡方检验,P<0.05,差异有统计学意义,表明PDCD4在食管鳞癌组织中的表达量显著低于癌旁正常组织(表1)。如图1所示,在癌旁正常组织中PDCD4呈高表达,而在食管鳞癌组织中,PDCD4的表达明显下降。

表1 PDCD4蛋白在食管鳞癌组织和相应癌旁组织中的表达阳性率(n=30) 例(%)
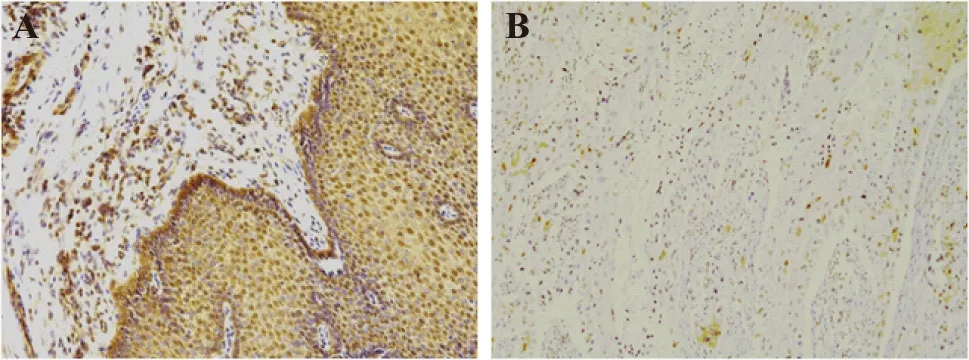
A:PDCD4在癌旁正常组织中阳性表达;B:PDCD4在食管鳞癌组织中阴性表达。图1 PDCD4在食管鳞癌组织中表达(SP,×200)
2.2 Pg免疫组化结果
Pg蛋白在30例癌旁组织中6例阳性,24例阴性,阳性率为20%;在30例鳞癌组织中16例阳性,14例阴性,阳性率为53.3%,经卡方检验,P值为0,表明Pg在食管鳞癌组织中的表达量显著高于癌旁正常组织,差异具有统计学意义(表2)。Pg蛋白呈棕黄色颗粒,主要定植于细胞胞浆中,如图2所示,Pg蛋白在癌旁正常组织中呈低表达,在食管鳞癌组织中的表达明显增强。
2.3 Pg和PDCD4表达的相关性
在Pg蛋白表达阳性的癌组织中未发现PDCD4阳性表达,而在Pg蛋白表达阴性的14例癌组织中,PDCD4阳性12例,阳性率达85.7%,经Spearman相关分析,r=-0.87,P<0.05,差异具有统计学意义,表明Pg与PDCD4在食管鳞癌组织的表达呈负相关(表3)。

表2 Pg蛋白在食管鳞癌组织和相应癌旁组织中的表达阳性率(n=30) 例(%)
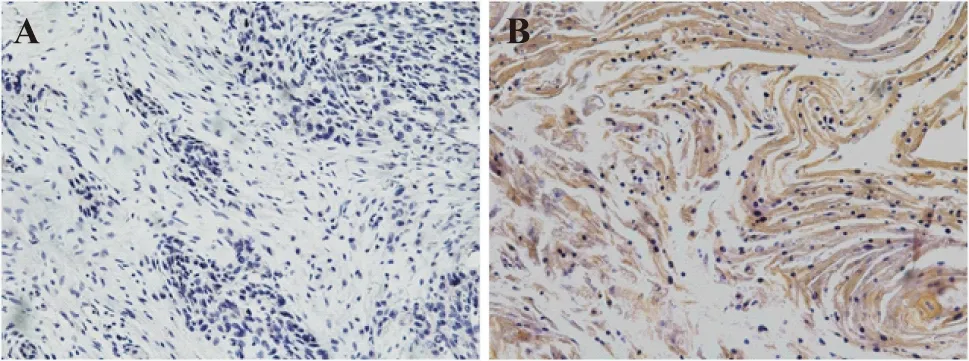
A:Pg在癌旁正常组织中阴性表达;B:Pg在食管鳞癌组织中阳性表达。图2 Pg在食管鳞癌组织中表达(SP,×200)
2.4 Pg和PDCD4的表达与食管鳞癌患者临床病理特征的关系
统计学分析显示,Pg和PDCD4的表达均与性别、年龄无统计学相关性(P>0.05),与分化程度、淋巴结转移、临床分期有统计学相关性(P<0.05)。Pg在低分化组阳性率高,PDCD4在中、高分化组阳性率高;Pg在淋巴结阳性组表达率高,PDCD4在淋巴结阴性组中表达率高;临床分期越晚,Pg的阳性率越高,而PDCD4的阳性率越低(表4)。

表3 PDCD4和Pg在ESCC组织中的表达阳性率 例(%)
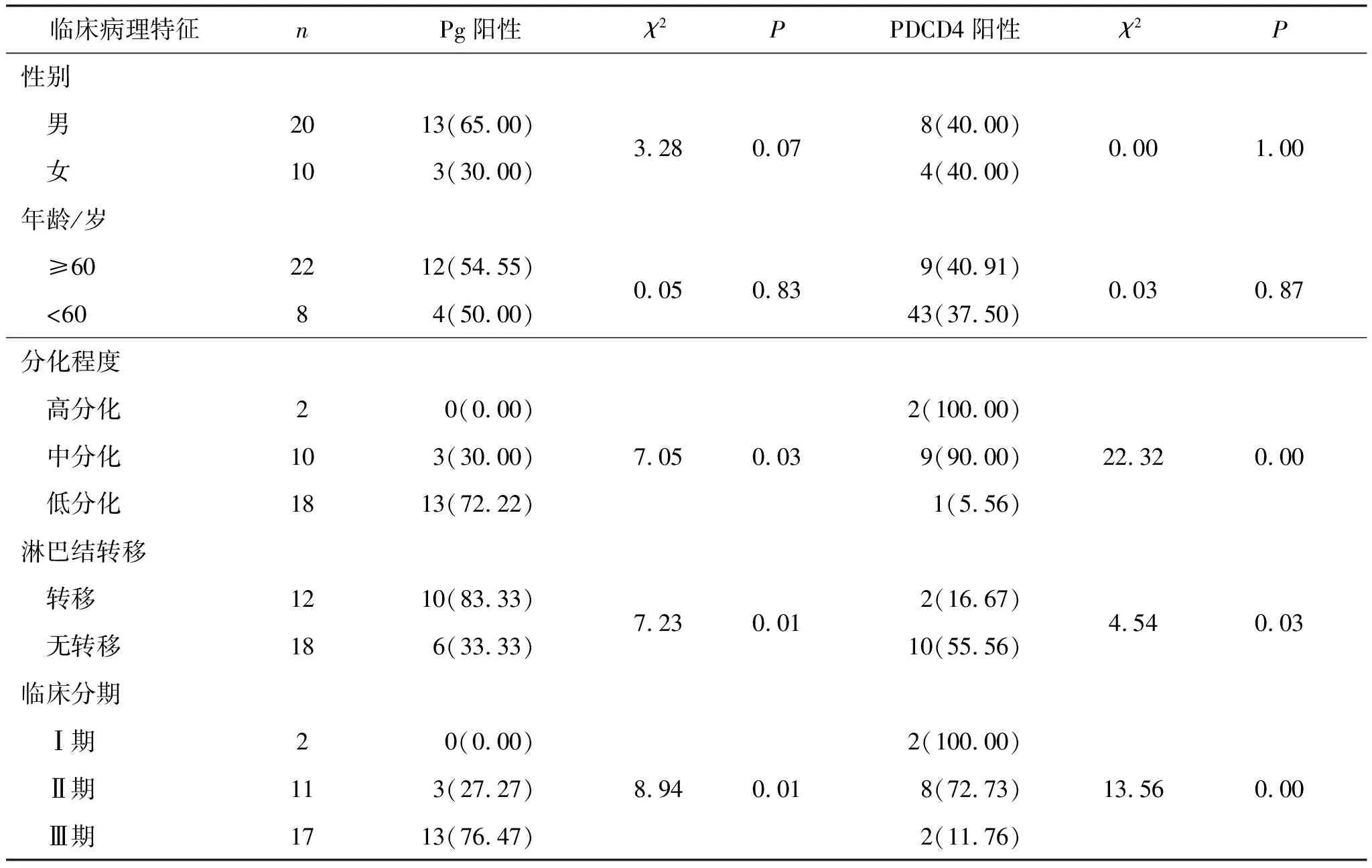
表4 Pg和PDCD4的表达与食管鳞癌患者临床病理特征的相关性 例(%)
2.5 Pg和PDCD4的表达与ESCC预后的关系
将ESCC患者生存时间定义为自手术日至死亡或最后一次随访时间,观察Pg和PDCD4的表达与ESCC患者预后的关系。30例患者中3 a内死亡8例,总生存率为73.33%。Pg阳性的患者(16例)死亡7例,Pg阴性的患者(14例)死亡1例;PDCD4阳性的患者(12例)死亡1例,PDCD4阴性的患者(18例)死亡7例。经Kaplan-Meier分析显示,Pg阳性组的总生存率(56.25%)较Pg阴性组(92.86%)低(P=0.021),且差异有统计学意义;PDCD4阳性组的总生存率(91.67%)较PDCD4阴性组(61.11%)高(P=0.060),表明PDCD4阳性与ESCC患者的生存期呈正相关的趋势。
3 讨论
众所周知,Pg的感染是牙周炎的主要致病原因之一,Pg可在口腔中定植[13],多年来已有多项研究证实了Pg感染与口腔鳞状细胞癌的密切关系:2011年美国佛罗里达州的一项研究显示,Pg在口腔鳞癌组织中的检出率显著高于正常牙龈组织(P<0.05),且在低分化癌组织中的滴度更高,提示该细菌与口腔鳞状细胞癌有潜在的联系[6];2012年纽约大学医学院环境医学系流行病学处的一项约涉及2万人的大型前瞻性研究表明,由包括Pg在内的口腔微生物引起的牙周炎与口腔消化系统恶性肿瘤的死亡率密切相关(相对危险度RR=2.28,95% CI:1.17~4.45),血清Pg表达率的增高与口腔消化系统恶性肿瘤死亡率的增加明显相关,且在无明显牙周病的健康受试者中也发现Pg与口腔消化系肿瘤的高死亡率相关(RR=2.25,95%CI=1.23~4.14),Pg是与微生物相关的口腔肿瘤死亡风险的生物标志物[7];2019年中国医科大学口腔医学院的一项研究发现,口腔鳞癌组织DNA水平与miR-21、c-Jun表达呈正相关,与PDCD4表达呈负相关;Pg可以促进miR-21表达增高,引起PDCD4表达下降,从而促进口腔鳞癌细胞的增殖[12]。
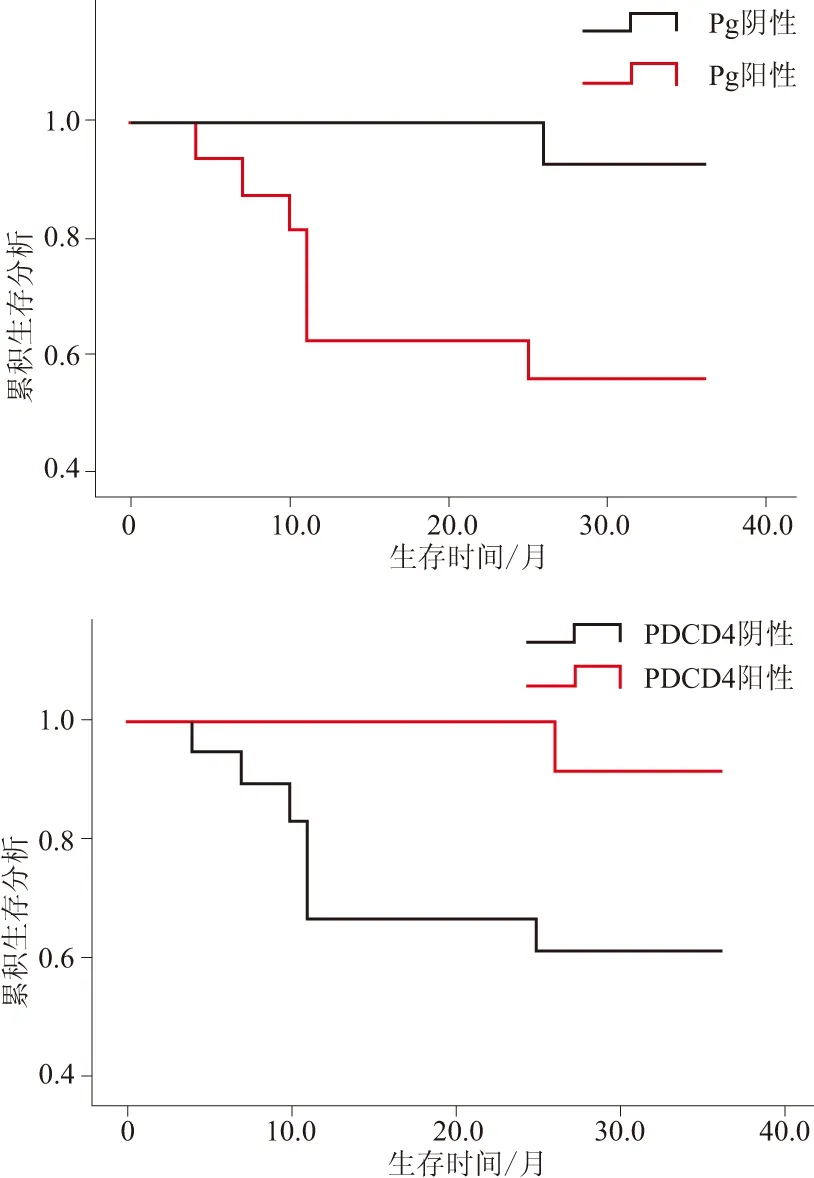
A:Pg阳性组的OS低于Pg阴性组;B:PDCD4阳性组的OS高于PDCD4阴性组。图3 Pg和PDCD4的表达与ESCC患者3 a OS的关系
综上,Pg感染导致PDCD4表达率下降促进口腔鳞癌发生,但目前尚无研究证实两者在食管鳞癌中的相关性及作用机制。本研究结果表明,在食管鳞癌组织中,Pg的表达率增高,PDCD4的表达率下降;Pg阳性与ESCC患者的生存期呈显著的负相关(P<0.05),PDCD4阳性与ESCC患者的生存期呈现正相关的趋势(P=0.060)。Pg表达率的增高、PDCD4表达率的下降,与食管鳞癌的低分化、淋巴结的转移、预后不良有显著的相关性(P<0.05)。因此,在食管鳞癌患者中,Pg的表达率增高,可能导致PDCD4的表达率下降,进而促进食管鳞癌的发生,可将Pg、PDCD4相结合作为评价ESCC恶性程度和预后的参考指标。

