直接PCR法在口腔牙龈卟啉单胞菌检测中的应用
谷变利,王娟萍,孔金玉,刘雅莉,张 灏,詹启敏,高社干
牙龈卟啉单胞菌(Porphyromonasgingivalis,P.gingivalis)是人类牙周炎重要的致病菌,已有研究表明其在口腔内的水平可预测疾病进展或活动性[1-2]。据报道,P.gingivalis与多种人类肿瘤密切相关,如口腔癌[3]、上消化道癌[4]、胰腺癌[5]等,以及心血管疾病、类风湿性关节炎、阿尔兹海默症等口腔-消化道系统及其他系统性疾病相关[6-7]。食管鳞癌(esophageal squamous cell carcinoma, ESCC)是食管癌主要的一个组织亚型。已报道P.gingivalis在食管癌组织中的阳性率显著高于癌旁组织及正常食管黏膜组织,且P.gingivalis与食管癌细胞分化状态、转移以及患者生存率呈正相关[4]。2017年的研究显示,P.gingivalis在上消化道各部位肿瘤组织中不均匀分布,从食管到贲门至胃呈上高下低的趋势[8]。这些研究表明,P.gingivalis可能是食管癌的高危因素。河南是中国食管癌高发省,为了摸清食管鳞癌高危人群、癌前病变及食管癌患者中P.gingivalis感染的流行病学特点,大样本量的流行病学调查活动势在必行。因此,一种能够简便而又准确地检测口腔P.gingivalis感染状态的方法显得十分必要。
目前,检测P.gingivalis感染的方法主要有培养法及分子生物学方法等。培养法结果具有高度特异性,然而,该法缺乏敏感性,培养成功率低,且需要5~7 d时间[9],因此不适于大规模分子流行病学筛查。PCR为代表的分子生物学方法目前已发展成熟,实时荧光定量PCR法更是广泛用于定量检测唾液、牙菌斑、舌背等新鲜来源样本中的P.gingivalisDNA检测[10-12]。一般地,大多数DNA检测技术,需要对样本进行基因组DNA抽提,或者经过裂解,释放核酸,进行PCR扩增。然而,在核酸抽提过程中,样本的管间转移步骤容易造成DNA的少量丢失,而影响PCR定量结果[13]。裂解法释放基因组DNA相对试剂盒法步骤简便,但涉及加热离心等多个步骤,在应用于大规模样本检测时就显得操作繁琐,且耗时费力。因此,本研究采用直接PCR法检测100例体检者口腔P.gingivalis,无核酸裂解抽提步骤,检测的灵敏度与特异性与常用的裂解方法及试剂盒抽提方法对比验证,探究直接PCR法快速筛查口腔中P.gingivalis的可行性。
直接PCR是一种无需基因组DNA抽提、纯化及定量步骤,直接将样本加入PCR体系的方法。该方法只需一步操作,可以避免抽提中造成的DNA丢失。直接PCR扩增在分子生物学领域的应用始于20世纪90年代。直接PCR目前常规应用于临床样本病毒和细菌等病原体的检测,以及生物多样性监测与物种鉴定[14-15]。直接PCR法的优势在血液[16-17]、头发[18]、指纹[19]、织物[20]及“触摸 DNA(touch DNA)”[14]等类型来源样本中已有报道。然而,直接PCR法用于快速检测牙龈拭子中的P.gingivalisDNA却鲜有报道。
因此,本研究采用Tris-EDTA缓冲液置换细胞保存液,不依赖任何核酸裂解液或抽提步骤,直接qPCR检测口腔拭子中P.gingivalis16S rRNA编码基因,以期为P.gingivalis及其他微生物大规模分子流行病学研究提供快速有效的筛查手段。
1 材料与方法
1.1 样本收集2019年10月来我院体检中心进行体检的100例成年健康人(男性37例,女性63例),年龄20~79 (50.8±17.1)岁。样本排除标准为:①体检当天有刷牙、饮水、进食等行为活动;②近1 a有牙周或口腔治疗史;③近3个月口服过抗生素或非甾体类抗炎药物;④怀孕;⑤牙齿总数少于20颗(至少有4颗磨牙)。样本采集信息包括:年龄、性别、吸烟及饮酒状态。本研究获得河南科技大学第一附属医院伦理委员会批准及受试体检人员的知情同意。
在体检当天,采用iCleanhcy一次性口腔植绒拭子(深圳华晨阳科技有限公司),于受试者口腔4个象限第二、三磨牙的牙龈处,用刷牙的力度,擦拭并旋转拭子各3次,拭子放入采集管的保存液中,折断手柄,密封,完成取样。样本检测前,保存于4 ℃不超过1周。每人采集双份拭子。
1.2 拭子处理及核酸裂解、基因组DNA抽提①对全部拭子统一做以下处理:盖紧管盖,漩涡震荡混匀,将保存液从收集管中转移至新的1.5 mL离心管中(AXYGEN,MCT-150-C),做好标记;常温下12 000 r·min-1离心10 min;弃上清(尽量弃除干净),同时避免损失沉淀物。②对其中100份沉淀物的处理:加入Tris-EDTA (10 mM tris,1 m EDTA,pH 8.0) 50 μL,旋涡震荡,重悬沉淀物,常温放置,直接用于qPCR。③对另一组100份中的50份沉淀物的处理:加入细胞裂解液 (#18LS11001,深圳亚能生物) 50 μL,轻弹或旋涡,以重悬沉淀物,放于金属恒温器,100 ℃加热10 min;常温下12 000 r·min-1离心10 min,取出静置,上清用于qPCR。④对剩余50份沉淀物的处理,按照MicroElute Genomic DNA Kit(#D3096-02,OMEGA)说明书进行离心柱法核酸抽提。最后用30 μL经70 ℃预热的Elution Buffer洗脱DNA,测定核酸质量与浓度,用于后续qPCR。
1.3 模拟阳性样本进行标准品制备取已知P.gingivalis阴性个体的口腔拭子,经离心后(12 000 r·min-1,10 min)去除保存液,得到沉淀物,加入1 mL已知浓度(1×109IU·mL-1)的P.gingivalisATCC 33277菌液(本实验室复苏培养)至口腔拭子沉淀物中,重悬沉淀,混匀后12 000 r·min-1,离心10 min,弃净上清;加入100 μL TE buffer,重悬混匀。按10倍比浓度梯度进行稀释,得到一系列P.gingivalis浓度:107、106、105、104、103、102、101IU·mL-1,测试qPCR体系灵敏度,独立重复实验3次。Ct值 ( cycle threshold value) 用于评估每个样本感染P.gingivalis的量。
1.4 qPCR扩增P.gingivalis特异性引物探针序列参考Kuboniwa M的文献[10],序列为:P.gingivalisforward,5’-ACCTTACCCGGGATTGAAATG-3’,P.gingivalisreverse,5’-CAACCATGCAGCACCTACATA-GAA-3’;P.gingivalisprobe,5’-FAMATGACTGATGGTGAAAA-CCGTCTTCCCTTC-TARMA-3’。引物和探针序列均由苏州金唯智生物科技有限公司合成。对标准品及受测样本进行qPCR扩增。PCR体系如下:AceQ PCR Probe Master Mix (Vazyme,Q112-03) 10 μL,10 μmoL正反向引物各0.5 μL,0.2 pmoL TaqMan 探针,2 μL溶解液/裂解的上清/50 ng DNA,补加DEPC水至总体积20 μL。以上体系加入八联管,于BioRad CFX96TM实时PCR系统,按照95 ℃,10 min,40 个PCR 循环 (95 ℃,10 s; 60 ℃,60 s)的步骤进行扩增,利用CFX MaestroTM software软件分析扩增结果。
2 结果
2.1 TE-直接qPCR体系灵敏度测试经TE-直接qPCR扩增,结果显示,在1×107~1×103IU·mL-1浓度区间,标准曲线的线性关系良好,定量方程斜率为-3.521,R2=0.997,扩增效率为92.3%。Ct值在18~32(图1)。故本研究建立的口腔拭子TaqMan 荧光定量PCR体系检出P.gingivalis的灵敏度达1 000 IU·mL-1。定性检测可判定Ct≥38为阴性,Ct<38为阳性。
2.2 TE-直接qPCR、裂解液-直接qPCR、拭子核酸抽提试剂盒-qPCR法检测P.gingivalis结果确定了直接qPCR体系后,对100例口腔拭子采用TE-直接qPCR法进行P.gingivalis检测,对另一组中的50例口腔拭子采用裂解液-直接qPCR检测P.gingivalis。对剩余50例口腔拭子采用试剂盒-qPCR法检测P.gingivalis。3种方法检出P.gingivalis阳性率结果及分析见表1-2。统计学分析表明,TE-直接qPCR法与裂解液-直接qPCR法相比,及TE-直接qPCR法与试剂盒-qPCR法相比,检出P.gingivalis无显著差异(表1-2)。
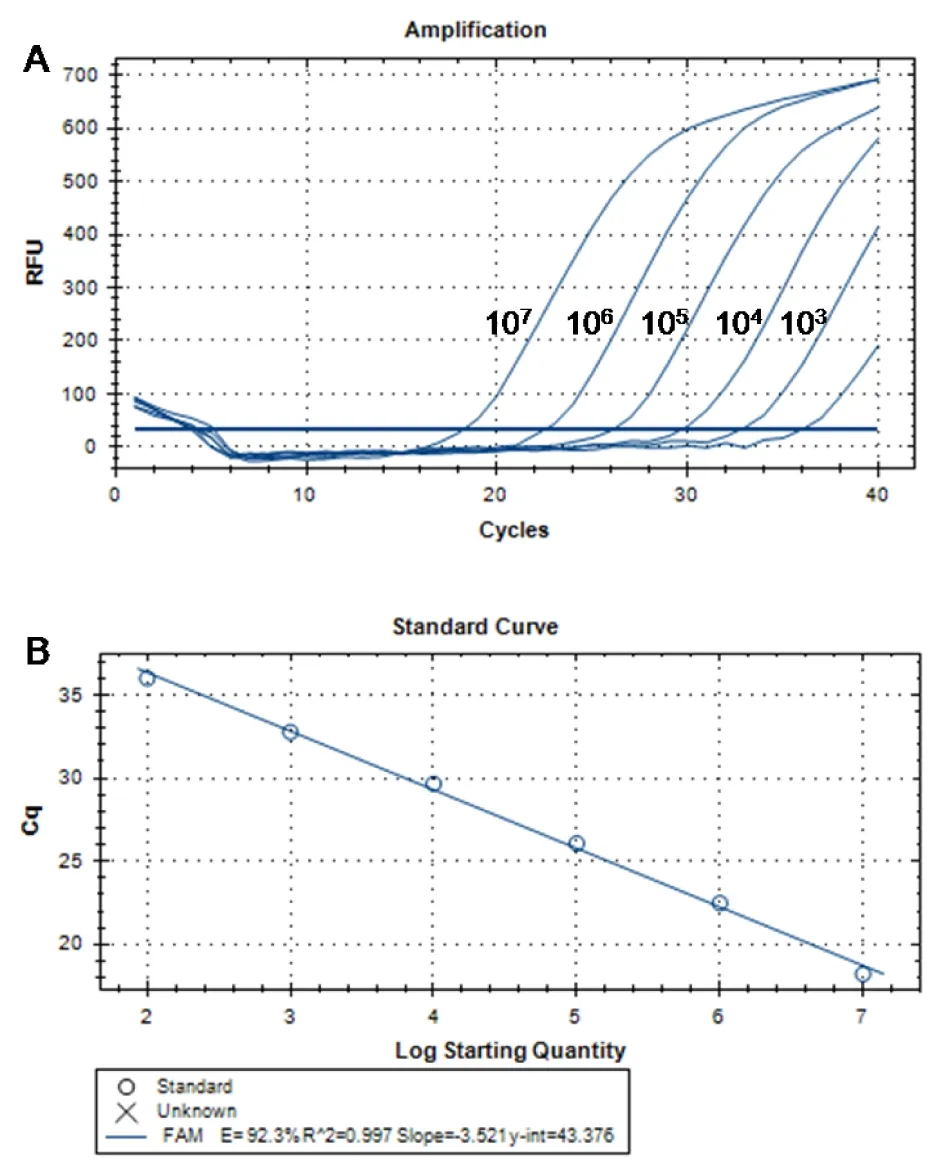
A:口腔拭子牙龈卟啉单胞菌标准品扩增曲线;B:牙龈卟啉单胞菌标准曲线。图1 直接PCR体系灵敏度

表1 TE-直接qPCR与裂解法-直接qPCR检测P. gingivalis的结果对比
注:①χ2=0.045,P=0.832;②针对PCR阳性样本;③配对样本t检验,P=0.019;④Ct值的配对样本t检验,P=0.019。

表2 TE-直接qPCR与核酸抽提试剂盒法-qPCR检测P. gingivalis的结果对比
注:①χ2>0.999,P=1;②针对PCR阳性样本;③配对样本t检验,P=0.933;④两种方法检测Ct值的配对样本t检验,P=0.907。
2.3 对比裂解液-直接qPCR检测方法,评价TE-直接qPCR法在50例样本中,裂解液-直接qPCR与TE-直接qPCR法共同检出P.gingivalis阳性16例,阴性33例,一致率达98.0%;两种方法在检测阳性样本Ct值及定量结果log10均值方面具有统计学差异,均为P=0.019。参考裂解液-直接qPCR方法,TE-直接qPCR法检测P.gingivalis的灵敏度与特异性分别为94.1%和100%,两种方法在定性检测P.gingivalis上具有较高一致性(Kappa=0.954)(表3)。
2.4 对比试剂盒-qPCR检测方法,评价TE-直接qPCR法在50例样本中,试剂盒-qPCR与TE-直接qPCR两种方法共同检出阳性23例,阴性27例,检测P.gingivalis一致率达100% ;两种方法检测阳性样本Ct均值及定量结果log10均值均无统计学差异(P=0.907,P=0.933)。参考试剂盒-qPCR,TE-直接qPCR法检测P.gingivalis的灵敏度与特异性均为100%,两种方法高度一致,Kappa=1(表4)。

表3 对比裂解法-直接qPCR,TE-直接qPCR检测P. gingivalis的性能评价
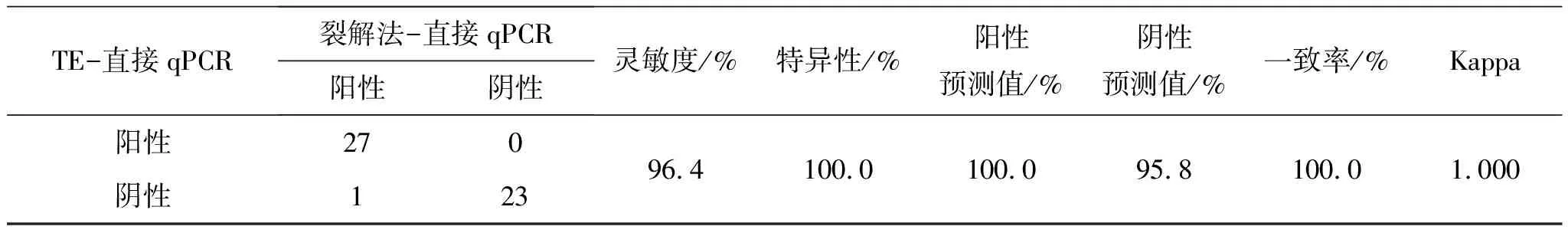
表4 对比试剂盒法-qPCR,TE-直接qPCR检测P. gingivalis的性能评价
3 讨论
本研究首次采用TE buffer结合直接qPCR法检测口腔中P.gingivalis,其优越性在于能直接扩增样本中细菌DNA,无需抽提或裂解释放核酸步骤。据报道使用商业化的核酸抽提试剂盒抽提核酸时会丢失模板DNA,影响qPCR检测结果。而采用直接qPCR法,能够最有效地扩增模板,减少出错或污染率。本研究方法为直接qPCR法,每个反应能检测低至1 000 IU·mL-1的P.gingivalisDNA,对比裂解液-直接qPCR,本方法检测P.gingivalis的灵敏度和特异性分别达到94.1%和100%。对比试剂盒-直接qPCR,本方法检测P.gingivalis的灵敏度和特异性均达到100%,其检测性能与两种参比方法高度一致。此外,从样本处理到定量PCR检测结束只需1.5 h(裂解液-直接qPCR需2 h,试剂盒-qPCR法则需3.5 h),大大缩短了实验时间。
直接qPCR体系中,最重要的因素是稳定且高效的DNA聚合酶系统,可直接用于体液、组织的扩增;同时,达到对背景复杂或者低丰度模板DNA有良好扩增效果。TE buffer有保存稳定DNA的功能,用它溶解重悬口腔脱落细胞沉淀物,既不会影响直接qPCR反应,又能在一定程度上起到稀释口腔杂质,稳定模板DNA的作用。因此,本研究采用TE buffer重悬样本,选择文献已报道且广泛应用的P.gingivalisATCC 33277特异引物探针[10],使用稳定高效的AceQ PCR Probe Master Mix建立P.gingivalis的直接qPCR体系。采用阴性口腔拭子样本,加入已知浓度的P.gingivalisATCC 33277菌液,模拟阳性样本,进行定量标准品制备,测试直接qPCR反应体系的灵敏性。结果表明,该体系在复杂背景中扩增P.gingivalisDNA性能稳定且灵敏度高,能实现模板DNA的定量。因此,使用特异引物探针,采用TE-直接qPCR法快速灵敏地检测口腔P.gingivalis应用价值巨大。
在对比实验中,只有1例样本结果不一致,即裂解法-直接qPCR检出阳性而TE-直接qPCR检测为阴性。作者采用TE-直接qPCR法,对这1例样本重复检测2次后,发现2次结果重复性较差(1次弱阳性,1次无扩增)。考虑到样本为口腔拭子,采用的是免核酸抽提及免裂解步骤的直接qPCR方法检测,对照裂解液-直接qPCR结果,推测这例样本存在较低丰度的P.gingivalis,阴性结果可能是样本中潜在的抑制物造成的。另外,TE-直接qPCR法与裂解法-直接qPCR在检测P.gingivalis方面具有较好的一致性。但分析表明,这两种方法在反映定量结果的Ct均值与log10均值方面,对比有差异,且均有统计学意义(P=0.019)。说明TE-直接qPCR法与裂解法-直接qPCR在定性检测P.gingivalis上高度一致,但用于定量检测P.gingivalis时,二者一致性较差。当然,本研究也具有一定的局限性。首先,没有深入研究TE buffer的最佳使用体积。研究中,为了保持与裂解液体积一致,采用了50 μL的用量。众所周知,不同个体,口腔脱落细胞的量并不一致,因此,在溶解脱落细胞沉淀物进行直接qPCR时,必定有最小及最大体积的使用界限。再者,本研究中涉及的样本数量比较有限,也未对口腔中其他常见细菌,比如具核梭杆菌、产黑普氏菌等一些革兰氏阳性菌等进行研究。
综上所述,本研究首次建立了免核酸抽提的TE-直接qPCR法检测口腔P.gingivalisDNA。该方法除了具有高灵敏性与特异性外,还容易操作,整个过程只需1.5 h。这一快速准确的实验技术,可用于食管癌分子流行病学研究,并在大规模流行病学筛查方面具有潜在优势。
(致谢:感谢崔天星、李智涛等人在技术方面答疑解惑,感谢兰子君、刘其伟、许海军等人在样本收集中提供的帮助!)

