纳米血小板递送miR-145靶向Myc抑制食管癌细胞增殖、迁移
李贺娟,杨婷婷,朱梦玺,史 浩,林 蜜,梁高峰
食管癌是发生在食管上皮组织的恶性肿瘤,其发病率和死亡率分别排在全球所有恶性肿瘤的第七位和第六位,我国是食管癌的高发区,占世界发病总数的一半。食管癌的治疗主要是手术切除、化疗、放疗、综合治疗等[1],但毒副作用较大且易发生转移。因此,迫切需要开发新的治疗手段来提高治疗效果,延长患者的生存期。近年来生物治疗以其生物相容性好、副作用小等优势,越来越受到人们的关注,且逐渐成为一种新的治疗方式。其中,miRNA就是极具潜力的一种。作为一类高度保守的、长18~25个核苷酸的内源性单链非编码小分子RNA,miRNA在细胞增殖、分化和凋亡中发挥重要的调控作用[2]。研究发现:多种miRNA在肿瘤中异常表达,这些异常表达的miRNAs参与肿瘤发生、发展,并在肿瘤的预后中扮演着重要角色,如kota等发现miR-26a在肝癌中异常低表达,通过腺相关病毒递送miR-26a恢复miR-26a的表达,有效地抑制了小鼠肝癌的生长[3]。作者通过PLGA纳米载体递送miR-145,在结肠癌小鼠肿瘤模型中起到明显的抑瘤效果。miR-145在包括胃癌、食管癌、结直肠癌、膀胱癌、肺癌等多种肿瘤中异常低表达,通过与多个靶基因c-Myc[4]、FSCN1[5]、SMAD5[6]等作用,抑制肿瘤细胞生长并促进细胞凋亡。因此,通过恢复肿瘤抑制性miRNA的表达有望成为一种新的、有潜力的治疗手段。
然而,安全、高效地将有治疗功能的小分子(细胞因子、基因、疫苗、抗体等)递送到肿瘤细胞一直是亟待解决的问题[7]。血小板膜表面受体可以与肿瘤细胞相互作用,对肿瘤细胞具有天然的靶向亲和力[8],因此可以利用这一特性将血小板制备成一种新型的靶向递送载体,用于对疾病进行靶向成像或药物递送[9]。同时,将血小板制成纳米级血小板,使其更加容易被靶细胞所内吞,从而达到靶向递送药物至肿瘤细胞内,进而实现杀伤肿瘤细胞的目的[8]。本研究构建加载miR-145的纳米血小板靶向载药递送系统,通过体外实验研究其对食管癌细胞增殖、迁移的影响,并进一步探讨其初步的作用机制,为食管癌的靶向治疗提供参考,现报道如下。
1 材料与方法
1.1 细胞株与主要试剂2-Iminothiolane hydrochloride (Traut’s Reagent) (产品货号:I6256), 3-Maleimidobenzoic acid N-hydroxysuccinimide ester(MBS) (产品货号:M2786),购自Sigma-Aldrich有限公司;DMSO(产品货号:D103273),购自上海阿拉丁生化科技有限公司;食管癌细胞株KYSE150来自本实验室;RPMI 1640(货号:350006CL)购自南京维森特生物技术有限公司;胎牛血清(货号:11011-8611)购自浙江天杭生物科技有限公司;青霉素/链霉素(产品货号:P113150),购自上海阿拉丁生化科技股份有限公司;MTT(产品货号:M8180),购自北京索莱宝生物科技有限公司;AnnexinV-FITC凋亡检测试剂盒(货号:E606336)、Myc抗体、IgG二抗购自上海生物工程有限公司;RNA提取试剂盒、PCR中所需试剂购自Takara公司;其余试剂为国产或进口分析纯。所有实验在相同条件下重复3次。
1.2 加载miR-145的纳米血小板的制备选用加入肝素的新鲜血液,在室温条件下用台式低速离心机进行离心,转速1 700 r·min-1离心12 min后得到血小板富集的血浆(PRP),加入20 μL低浓度阿司匹林水溶液抗血小板聚集。再以3 600 r·min-1离心12 min,吸出上清,得到血小板沉淀,用无菌PBS 洗涤并重悬,显微镜下观察获得的洗涤血小板(platelet,P)。然后用超声细胞破碎仪将血小板制成纳米级血小板(Nanoplatelet,NP),用马尔文纳米粒径仪(Malvern nanoparticle caliper,MNC)检测纳米血小板的粒径分布,在此基础上优化超声条件得到理想纳米血小板的粒径。
用新鲜配制的碳酸盐缓冲液配制miR-145的碳酸盐溶液,使其浓度为1 mg·mL-1;取已配好的1 mg·mL-1FITC/DMSO 100 μL,用移液器每次取10 μL,缓慢地加入2 mL miR-145溶液中,同时注意避光,搅拌、充分混合后,4 ℃避光反应8 h;加NH4Cl终止反应使其终浓度为50 mM,混合,然后在4 ℃冰箱孵育2 h,获得FITC标记的miR-145 (miR-145/FITC)。取500 μL miR-145/FITC溶液加入5 mL终浓度为200 μM 的MBS溶液,室温下反应30 min,得到带有马来酰胺键的miR-145/FITC。取100 μL NP悬液与2 μL浓度为250 mmol·L-1(1 000×)的Traut’s Reagent试剂室温下反应30 min,在NP细胞膜上形成巯基。然后将100 μL含巯基的NP与100 μL带有马来酰胺键的miR-145/FITC在PBS中混合,室温孵育15 min,800 g离心10 min,用PBS洗沉淀3次,在PBS中重悬得NP-miR-145。新构建的纳米血小板载体在PBS中稳定保存,在4 ℃最多保存7 d,荧光显微镜下观察纳米血小板载体。同法制备P-miR-145。
1.3 细胞培养和细胞转染将KYSE150细胞(约1×106细胞/孔)均匀接种于6孔板中,在10% FBS和0.1%双抗(100 U·mL-1青霉素和100 μg·mL-1链霉素)的RPMI 1640培养基中,实验分4组:NP-miR-145组、P-miR-145组、miR-145组和空白对照组,置于37 ℃、5% CO2的培养箱中培养。待细胞融合度达到70%左右(约铺板24 h 后) 进行细胞转染,后续进行荧光显微镜观察。
1.4 RT-PCR法检测细胞中miR-145的表达将6孔培养板中转染24 h后的KYSE150细胞用PBS清洗2次,按照Trizol试剂盒说明书提取各组细胞的总RNA,测定RNA浓度;再按照反转录试剂盒说明书,获得反转录产物,并测cDNA浓度;最后根据RT-PCR试剂盒,将20 μL的反应体系加入8联管中,进行RT-PCR,检测NP-miR-145、P-miR-145、miR-145和空白对照组中miR-145的表达。U6作为内参,每个实验均重复3次。miR-145和U6引物见表1。
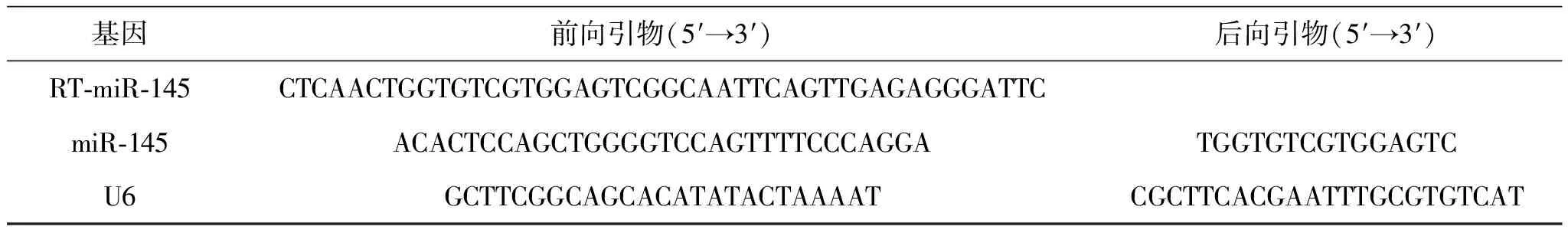
表1 RT-PCR实验引物
1.5 划痕实验检测细胞迁移能力将6孔培养板中转染6 h后的KYSE150细胞用10 μL无菌枪头在6孔板内以“一”划线;用PBS缓冲液漂洗细胞2~3遍,以去除悬浮细胞;然后加入含10%胎牛血清的RPMI 1640培养基,继续培养。以划痕时刻为起始点,分别于0、24、48 h在倒置荧光显微镜下,观察细胞生长状态及划痕愈合情况,拍摄各组细胞图片保存,并通过测量划痕间距离变化来评估其迁移运动能力。
1.7 流式细胞仪检测细胞的凋亡将生长状态稳定的KYSE150细胞(5×105细胞/孔)接种于6孔培养板中,待细胞长至约70%汇合度时,在相同的条件下,处理组分别加入200 μL的NP-miR-145、P-miR-145、miR-145,空白对照组加200 μL的细胞培养液;孵育48 h后,经胰酶消化,2 000 r·min-1离心5 min,弃去培养液,收集细胞,用4 ℃预冷无菌PBS洗涤细胞两次;取400 μL结合缓冲液悬浮细胞,使其密度约为1×106cells·mL-1;在400 μL细胞悬液中,加入5 μL Annexin V-FITC,轻轻混匀后于4 ℃避光条件下孵育5 min。再加入10 μL PI,轻轻混匀后于4 ℃避光条件下孵育10 min;用流式细胞仪进行检测分析,每个实验均重复3次。
1.8 Western blot法检测KYSE150细胞中Myc蛋白的表达水平用PBS清洗转染后的细胞,用RIPA细胞裂解液裂解各组细胞,冰浴20 min后收集裂解上清,测定蛋白浓度,进行SDS-PAGE凝胶电泳,并转至PVDF膜,TBST洗涤,室温封闭1 h,一抗(1∶1 000稀释)孵育4 ℃过夜,TBST洗涤4次,二抗孵育2 h,TBST洗涤 4 次后,ECL化学发光及显影。
2 结果
2.1 载药递送系统的表征纳米血小板递送系统见图1A。图1B1是纳米粒径仪测试结果,表明:提取的血小板粒径约为1 μm左右,分布比较均匀,与血小板相比,纳米血小板粒径明显较小,该方法可制备大量纳米血小板。通过多次优化实验条件发现:70% amplitude,15 min间隔超声条件下能够获得粒径在184 nm左右、比较均一、稳定的纳米血小板(图1B2)。荧光显微镜对纳米血小板递送系统进行观察(图1C),图中看到CY3红色荧光标记的纳米血小板和FITC绿色荧光标记的miR-145,在同一位置叠加后的图像呈现明显的黄色荧光,表明血小板和纳米血小板与miR-145成功偶联。
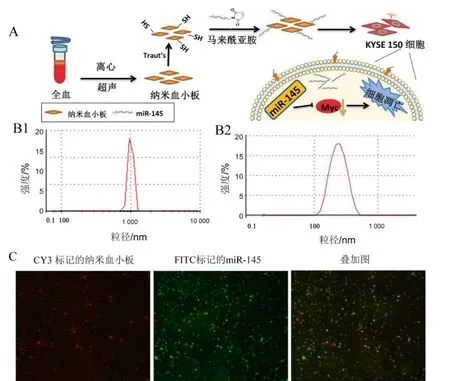
A:纳米血小板递送系统的示意图;B:纳米粒径仪测试结果:B1为血小板,B2为纳米血小板;C:荧光显微镜对纳米血小板递送系统进行观察。图1 纳米血小板载药示意图及表征
2.2 细胞转染及细胞内miR-145的表达水平 细胞转染结果发现:12 h时,通过荧光显微镜观察结果发现:未处理的空白对照组和单独的miR-145组未观察到荧光,在P-miR-145和NP-miR-145组均可检测到绿色荧光,说明血小板和纳米血小板均能携带miR-145进入细胞,但NP-miR-145处理组的荧光强度明显高于P-miR-145处理组(见图2 )。RT-PCR检测结果显示,与空白对照组相比,NP-miR-145、P-miR-145、miR-145这3组细胞中miR-145表达水平均有所提高,且以NP-miR-145组中miR-145表达水平为最高。见图3。
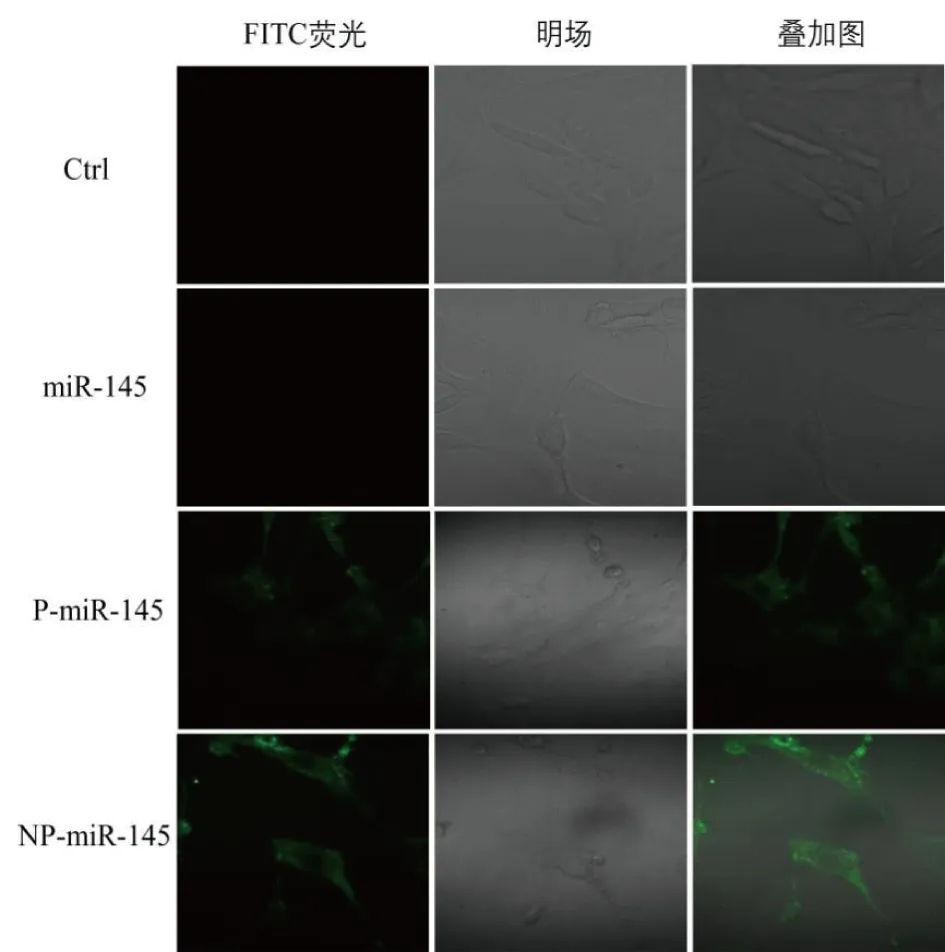
图2 细胞转染12 h的荧光图
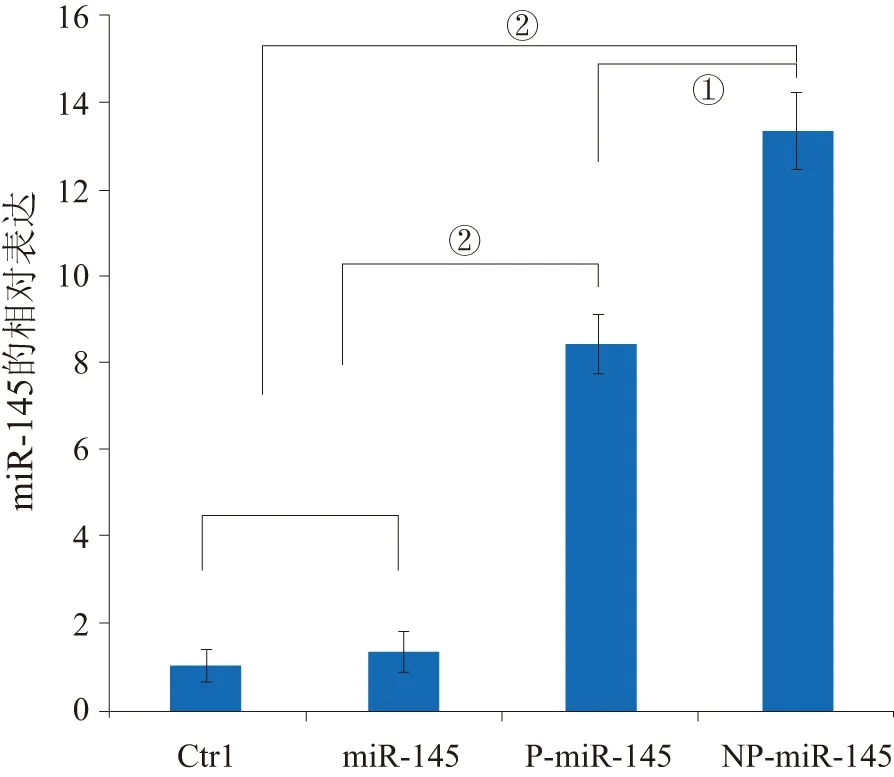
①P<0.05;②P<0.01。图3 RT-PCR检测KYSE150细胞中miR-145的表达
2.3 各组细胞迁移情况 细胞划痕实验结果表明:处理24 h后,NP-miR-145、P-miR-145、miR-145和空白对照组细胞划痕明显存在,但NP-miR-145、P-miR-145组细胞迁移变慢;48 h后,NP-miR-145、P-miR-145组处理的细胞划痕仍然明显存在,而未处理组和单独miR-145处理组的划痕间隙几乎完全愈合。与空白对照组相比,NP-miR-145、P-miR-145、miR-145这3组细胞划痕距离有明显差异(P<0.01),表明负载miR-145的纳米血小板能有效抑制KYSE150细胞的迁移。见图4。
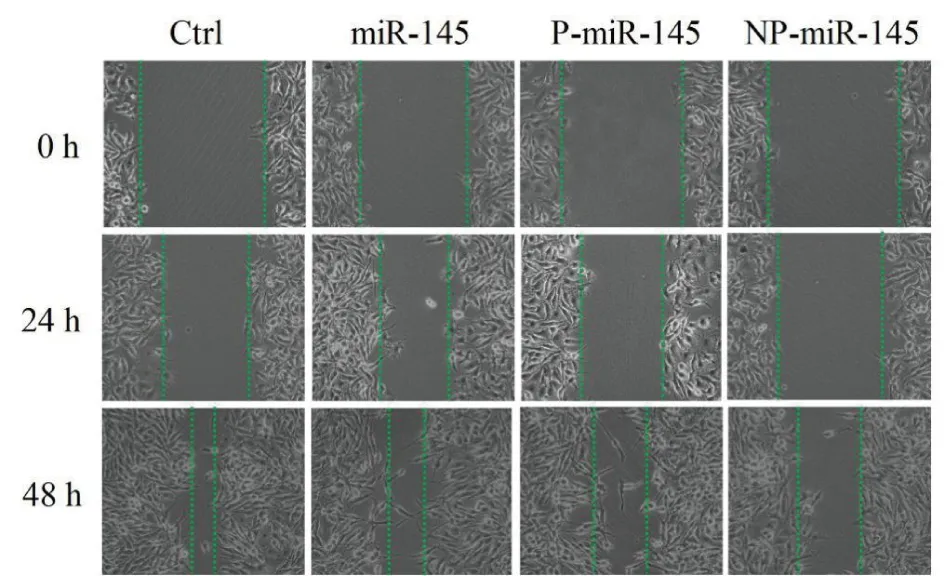
图4 KYSE150细胞迁移实验
2.4 各组细胞增殖情况 MTT法检测结果显示,细胞转染后12、24 h,NP-miR-145、P-miR-145、miR-145这3组细胞的吸光度与同时段空白对照组细胞的吸光度值无明显差别(P>0.05);转染后48、72、96 h,NP-miR-145、P-miR-145、miR-145这3组细胞的吸光度值与同时段空白对照组细胞的吸光度值差异有统计学意义(P<0.05),表明3组均可明显抑制KYSE150细胞的增殖,且以NP-miR-145处理组抑制较明显(P<0.01)。见图5。
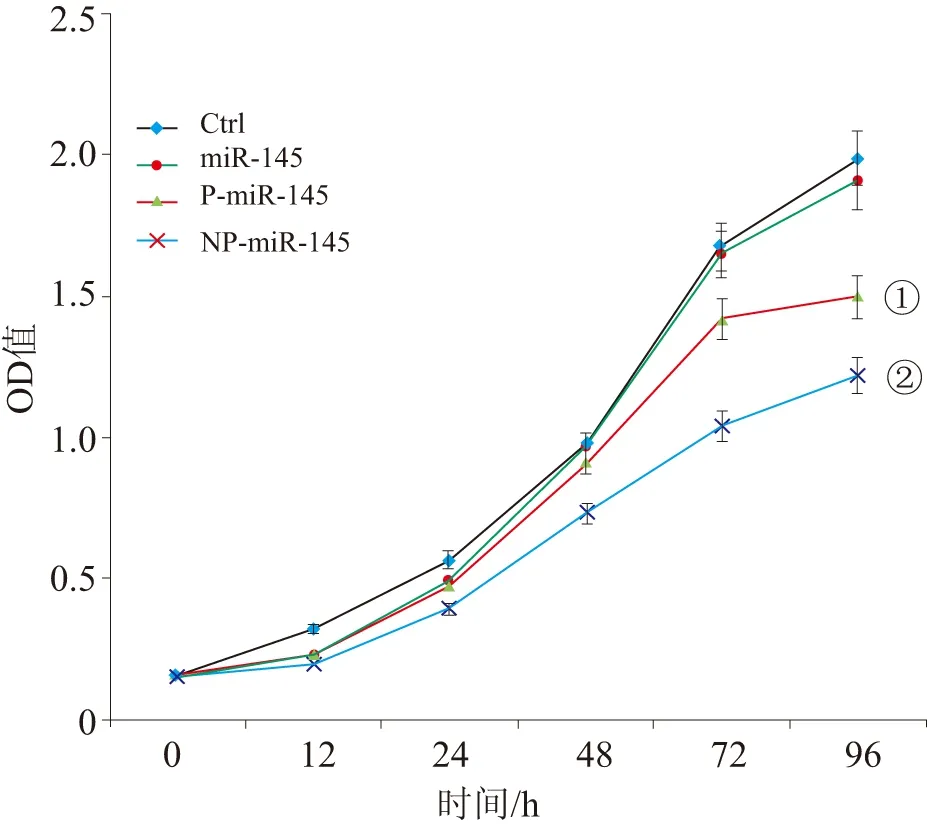
①P<0.05;②P<0.01。图5 KYSE150细胞增殖实验
2.5 各组细胞凋亡情况 用流式细胞术检测各组KYSE150细胞的凋亡情况。处理24 h后,NP-miR-145处理组细胞总凋亡率高达19.7%,直方图显示不同处理组凋亡细胞的定量数据,在相同miR-145浓度下,NP-miR-145组细胞凋亡率明显高于其他处理组。见图6。
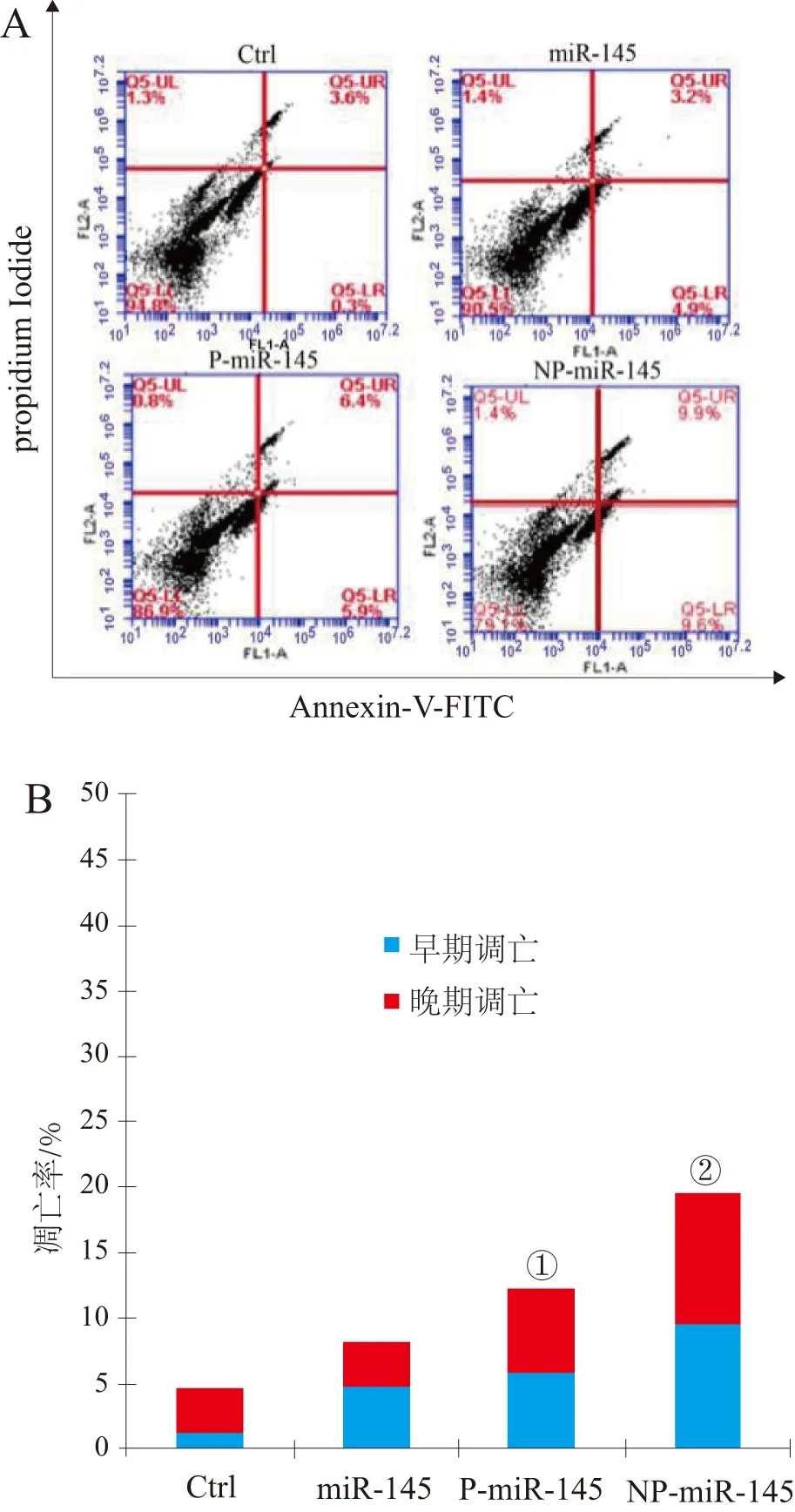
①P<0.05;②P<0.01。图6 流式细胞术检测KYSE150细胞凋亡
2.6 各组细胞中Myc蛋白的表达水平根据miR-145与靶基因的作用原理(图7A),作者通过Western blot检测了Myc在各组细胞中的表达情况,结果见图7B、7C:空白对照组与单独的miR-145组Myc的表达没有明显差异;与空白对照组相比,NP-miR-145、P-miR-145两组细胞中Myc蛋白都明显降低,且以NP-miR-145组降低最明显,以上结果表明NP-miR-145处理组miR-145抑制靶基因Myc蛋白表达能力最强。
3 讨论
食管癌居世界癌症死因顺序的第六位。全球每年约有45.6万食管癌新发病例和40万死亡病例,我国食管癌发病率和死亡率均最高[10]。食管癌由于缺乏有效的临床诊断方法,常在发病后期被诊断,手术、放疗和化疗是其典型的治疗方法,但这些治疗方法容易发生局部和(或) 远处转移,预后较差。因此,寻找食管癌中有预后价值的生物标志物,对于食管癌的治疗和预后评价具有重要意义[11]。此外,20世纪80年代,美国学者Oldham提出了生物反应调节理论,使生物治疗成为继手术、放疗、化疗之后的第四大肿瘤治疗模式。生物治疗因其安全、有效、毒副反应低等特点,被认为是本世纪肿瘤综合治疗模式中最活跃、最有前途的手段[7]。
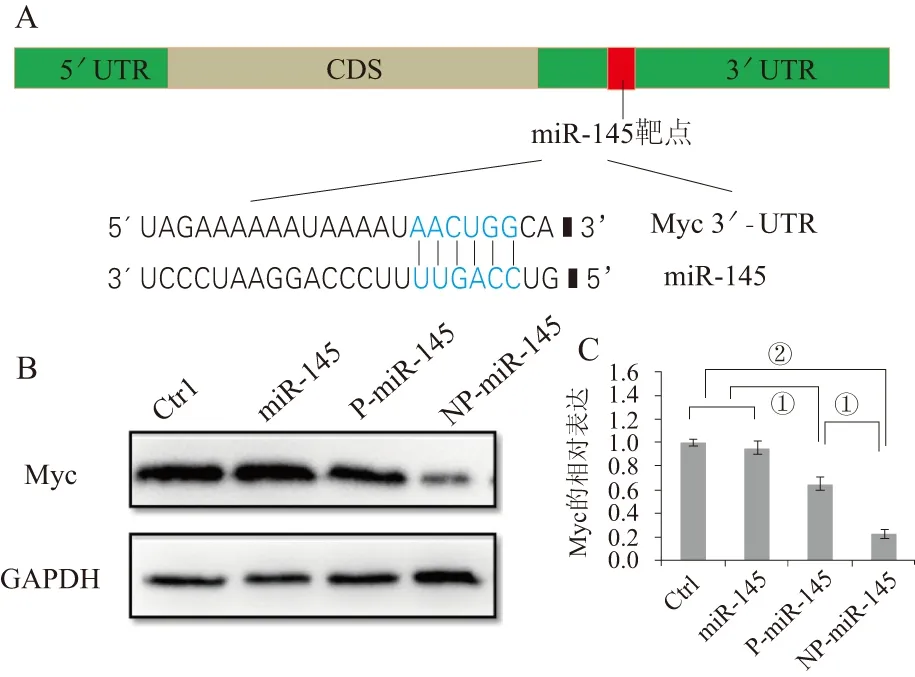
①P<0.05;②P<0.01。图7 miR-145与靶基因结合示意图及Myc蛋白的Western blot检测
研究证实多种miRNA在肿瘤中异常表达,这些miRNA通过调节细胞分化、细胞增殖和细胞凋亡等扮演着癌基因或肿瘤抑制因子的作用[12]。近年来,人们通过上调肿瘤中异常低表达的miRNA或者下调异常高表达的miRNA,取得了良好的抑瘤效果。Trang等[13]通过慢病毒颗粒向肿瘤内传递let-7b,能明显减小异种移植瘤的体积;Kota等[3]通过腺相关病毒系统递送miR-26a,抑制了癌细胞的增殖、诱导细胞凋亡,有效地阻碍了疾病的进程。研究表明:miR-145在多种肿瘤中显著下调,是一种抑癌基因。早在2003年,Michael等[14]在对结直肠癌的研究中发现,有两个miRNA即miR-143和miR-145,出现明显下调。2011年首次报道了miR-145在 ESCC 中表达下调[15]。另有研究报道miR-145能抑制ESCC中癌细胞的迁移、侵袭和上皮间质转化以及细胞增殖[16]。虽然miR-145是一个在食管癌中有潜在治疗价值的肿瘤抑制性miRNA,然而,安全、高效地将miR-145递送到食管癌细胞中是一直需要突破的问题。
目前,研究最多的药物/基因递送主要有病毒载体和非病毒载体两大类,病毒载体虽然具有较好的递送能力,但潜在的致病性和免疫原性极大地限制了其应用。非病毒载体包括各种脂质体、纳米阳离子聚合物、纳米胶束等,这些非病毒载体由于良好的递送能力及较好的生物相容性受到人们的青睐。然而这些人工合成的纳米材料在制备过程中不可避免地引入一些有机或无机材料,含金属元素或聚合物的纳米粒子的生物降解能力较差,容易滞留在肝肾组织内,引起炎症反应和毒性损伤[17]。合成脂质体或纳米粒子的化学成分的结构一般较为简单,在血液循环中的半衰期较短,并易引起免疫排斥反应[18]。因此,不能很好地实现靶向性。为了解决这些问题,人们逐渐开始将天然细胞制备成载体(如红细胞、经基因工程改造的干细胞和树突状细胞、血小板)用于药物转运的研究[19-20]。
有研究报道用FⅧ凝血因子转染的血小板治疗出血性疾病,如血友病,或者用血小板转运凝血因子到血栓形成部位释放出其内部装载的药物治疗血管创伤[21]。还有研究利用血小板对肿瘤细胞的天然靶向性装载抗肿瘤药物阿霉素进行抗肿瘤治疗[22]。与现有研究报道中的血小板载体相比[19-22],本研究将血小板经温和超声获得纳米级别的血小板,保留了血小板的载药能力和在膜表面连接外源性蛋白的能力,同时因为体积较小,能够被靶细胞内吞进入细胞内[23],并且加入阿司匹林可有效抑制纳米血小板的聚集,从而高效地靶向KYSE150细胞。
本研究结果显示,纳米血小板加载miR-145后对KYSE150细胞能够较强地抑制其增殖、迁移,促进其凋亡,并且能显著地下调Myc癌基因表达。Myc是哺乳动物种属中最为重要的一类癌基因,在多种肿瘤中都有Myc基因的扩增或过度表达,与食管癌的分化程度、TNM分期、淋巴结转移和侵犯深度呈正相关[24]。miR-145可通过直接靶向Myc抑制肿瘤细胞增殖、迁移,诱导凋亡,由此,Myc基因有望成为miR-145治疗食管癌的重要靶点之一。此外,本研究表明纳米血小板可作为优良的载体递送生物治疗药物,为食管癌基因靶向治疗提供新的策略,但进一步的体内实验和相关的分子机制有待深入研究。

