紫外-可见分光光度法测定药物胶囊中盐酸氨基葡萄糖
刘 欣,王誉清,李咏歌,刘春雨
(1.唐山师范学院 化学系,唐山063000; 2.唐山师范学院 生命科学系,唐山063000)
盐酸氨基葡萄糖的化学名为2-氨基-2-脱氧-D-葡萄糖盐酸盐[1],化学式为C6H13NO5·HCl,相对分子质量为215.63。盐酸氨基葡萄糖是一种相对稳定的化合物,是将节肢动物壳体内的甲壳素进行充分盐酸水解制得的。盐酸氨基葡萄糖对人体的骨骼发展及生长发育有重要的生理作用[2],不仅可以用于预防和治疗全身各关节(膝关节、肩关节、髋关节、手腕关节、颈及脊椎关节等)的骨节性关节炎,缓解骨性关节炎的疼痛、肿胀等症状和改善关节活动功能[3-4],还可以通过刺激软骨细胞产生正常的蛋白聚糖[5],抑制损伤软骨的酶,从而达到软骨及关节修复和维持相关功能的作用,延迟骨性关节炎的发展。此外,盐酸氨基葡萄糖不仅在肝肾解毒方面也有重要价值,还可以使婴幼儿肠道中防癌细菌双歧杆菌的数量快速增加,抑制癌细胞的生长[6]。目前,盐酸氨基葡萄糖在医药行业的应用越来越广泛,是治疗骨关节炎和合成抗生素及抗癌药物的主要原料。盐酸氨基葡萄糖在食品行业也有应用,如可用作食品添加剂[7]。
目前测定盐酸氨基葡萄糖的常用方法有紫外-可见分光光度法[8-9]、滴定分析法[10]、高效液相色谱法(高效液相色谱紫外检测法[11-13]、高效液相色谱蒸发光散射检测法[14]、高效液相色谱示差折光检测法[15]、高效液相色谱荧光光度法[16]、离子色谱法[17]),其中较常用的方法为紫外-可见分光光度法和高效液相色谱法。
本工作利用Ni2+与盐酸氨基葡萄糖在碱性介质中形成的络合物建立了紫外-可见分光光度法测定盐酸氨基葡萄糖胶囊中盐酸氨基葡萄糖含量的方法。该方法所用仪器设备简单,可为快速测定盐酸氨基葡萄糖含量提供技术参考。
1 试验部分
1.1 仪器与试剂
岛津UV-2550 型紫外-可见分光光度计;HH-6型水浴锅;FA 2204B型电子天平。
盐酸氨基葡萄糖标准溶液:1.0×10-2mol·L-1,称取1.08 g盐酸氨基葡萄糖,用水溶解并转移至500 m L容量瓶中,用水定容,摇匀,备用。
硫酸镍标准溶液:1.0×10-2mol·L-1,称取0.65 g硫酸镍,用水溶解并转移至100 m L 容量瓶中,用水定容,摇匀,备用。
标准溶液系列:取4只50 m L容量瓶往其中分别 加 入 3.00,4.00,5.00,10.00,20.00 m L 的 1.0×10-2mol·L-1盐酸氨基葡萄糖标准溶液,先加入少量0.10 mol·L-1氢氧化钠溶液摇匀,再向其中加入2.00 m L 的1.0×10-2mol·L-1硫酸镍标准溶液,最后用0.10 mol·L-1氢氧化钠溶液定容,摇匀。
盐酸氨基葡萄糖胶囊(盐酸氨基葡萄糖含量0.24 g/粒);D(+)-氨基葡萄糖盐酸盐、硫酸镍、氢氧化钠均为分析纯;试验用水为去离子水。
1.2 仪器工作条件
检测波长为219 nm,波长扫描范围为190~350 nm,参比溶液为0.10 mol·L-1氢氧化钠溶液;光谱通带宽度为0.2 nm。
1.3 试验方法
取盐酸氨基葡萄糖胶囊内颗粒物(其标示量为0.24 g),用水溶解并转移至250 m L的容量瓶中,用水定容,摇匀,得到样品溶液。将样品溶液5.00 m L、0.10 mol·L-1氢氧化钠溶液10 m L、硫酸镍标准溶液2.00 m L依次加入至50 m L容量瓶中,并用0.10 mol·L-1氢氧化钠溶液定容,摇匀。在20 ℃水浴锅中放置15 min,得到Ni2+-氨基葡萄糖溶液,按照仪器工作条件在紫外-可见分光光度计上对其吸光度进行测量。
2 结果与讨论
2.1 缓冲溶液的选择
配制p H 1.00~10.00不同酸度的缓冲溶液,分别为0.1 mol·L-1盐酸溶液、柠檬酸钠-盐酸溶液、柠檬酸钠-磷酸氢二钠溶液、邻苯二甲酸氢钾缓冲溶液、乙酸-乙酸钠溶液、磷酸二氢钾和磷酸氢二钠溶液、三(羟甲基)氨基甲烷-盐酸、四硼酸钠标准缓冲溶液、氨水-氯化铵溶液。试验考察了上述缓冲溶液和0.10 mol·L-1氢氧化钠溶液对硫酸镍和盐酸氨基葡萄糖体系吸光度的影响,见图1。
在配制的缓冲溶液中,Ni2+均不能使盐酸氨基葡萄糖溶液的最大吸收波长发生改变,只有在0.10 mol·L-1氢氧化钠溶液中,Ni2+才能和盐酸氨基葡萄糖生成Ni2+-氨基葡萄糖配合物,其最大吸收波长为219 nm(图1)。因此,试验选择的缓冲溶液为0.10 mol·L-1氢氧化钠溶液。

图1 盐酸氨基葡萄糖和Ni2+-氨基葡萄糖配合物的吸收曲线Fig.1 Absorption curves of glucosamine hydrochloride and Ni2+-glucosamine hydrochloride
2.2 试剂加入顺序的确定
当Ni2+与盐酸氨基葡萄糖配位不完全时,溶液中剩余的Ni2+将与氢氧化钠发生反应产生氢氧化镍沉淀干扰测定。正确的试剂添加顺序为:先加入盐酸氨基葡萄糖,再加入氢氧化钠使盐酸氨基葡萄糖羟基充分电离生成氧负离子,然后再加入硫酸镍与氧负离子配位,最后再加入氢氧化钠用于定容。
2.3 硫酸镍用量的选择
试验考察了硫酸镍标准溶液用量分别为0.50,1.00,1.50,2.00,2.50,3.00 m L 时对硫酸镍和盐酸氨基葡萄糖体系的吸光度的影响,结果见图2。
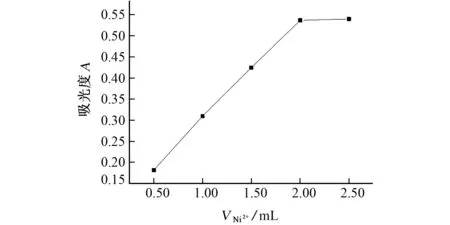
图2 硫酸镍用量对吸光度的影响Fig.2 Effect of amounts of nickel sulfate on absorbance
由图2可知:当加入硫酸镍标准溶液的用量为2.00 m L时,吸光度达到饱和。当加入硫酸镍标准溶液的用量大于3.00 m L 时,体系中开始出现轻微沉淀。试验选择硫酸镍标准溶液的用量为2.00 m L。
2.4 反应时间的选择
试验考察了反应时间分别为5,10,15,20 min时对硫酸镍和盐酸氨基葡萄糖体系吸光度的影响。结果表明:随着反应时间的延长,吸光度逐渐增大,当反应时间大于15 mim 时,吸光度变化不大。试验选择反应时间为15 min。
2.5 反应温度的选择
将硫酸镍和盐酸氨基葡萄糖体系分别置于20,40,60,80,100 ℃的恒温水浴锅中反应15 mim,考察不同反应温度对此体系吸光度的影响。结果表明:当反应温度大于20℃时,体系中会产生沉淀,干扰目标物的测定,不能得到准确的结果。试验选择反应温度为20 ℃。
2.6 表面活性剂的影响
分别在6只未定容的容量瓶中加入2.00 m L质量分数均为1%的十二烷基硫酸钠溶液、十二烷基苯磺酸钠溶液、聚乙二醇10000 溶液、聚乙二醇2000溶液、聚乙烯吡咯烷酮K30溶液、β-环状糊精溶液,另外一只不加表面活性剂进行对比。将这7只容量瓶用0.10 mol·L-1氢氧化钠溶液定容后,在仪器工作条件下进行测定。结果表明:和未加表面活性剂的对比组相比,加入表面活性剂的溶液吸光度的明显下降。试验选择不加表面活性剂。
2.7 干扰离子的影响
按试验方法进行测定,考察了几种常见离子对Ni2+-盐酸氨基葡萄糖溶液吸光度的影响,结果见表1。

表1 干扰离子的影响Tab.1 Influence of interfering ions
由表1可知:200倍的K+,100倍的CO32-均不产生干扰;在加入100倍的Ca2+、50 倍的 Mg2+和100倍的Fe2+后,溶液立即产生沉淀,严重影响试验测定,无法进行回收率计算。
2.8 标准曲线与检出限
按仪器工作条件对配制的标准溶液系列进行测定,以盐酸氨基葡萄糖的浓度为横坐标,其对应的吸光度为纵坐标绘制标准曲线,线性回归方程为y=56.91x+0.145 7,相关系数为0.999 7,盐酸氨基葡萄糖的浓度在6.00×10-4~4.00×10-3mol·L-1内与其对应的吸光度呈线性关系。
测量空白溶液0.10 mol·L-1氢氧化钠溶液的吸光度10次,以3倍标准偏差计算检出限(3s)为4.1×10-5mol·L-1。
2.9 准确度和精密度试验
在浓度为4.53×10-3mol·L-1的样品溶液中分别添加4个浓度水平的盐酸氨基葡萄糖标准溶液,按仪器工作条件进行测定,每组平行测定5次,计算回收率和测定值的相对标准偏差(RSD),结果见表2。
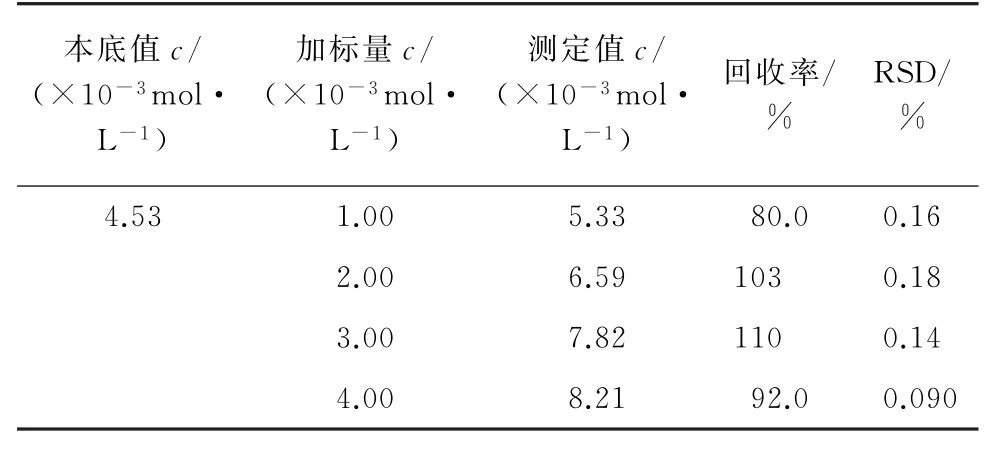
表2 回收和精密度试验结果(n=5)Tab.2 Results of tests for recovery and precision(n=5)
由表2可知:用该方法测定盐酸氨基葡萄糖含量的 回 收 率 在 80.0% ~110% 之 间,RSD 低 于0.18%,结果令人满意。
2.10 样品分析
按照试验方法对盐酸氨基葡萄糖胶囊中的盐酸氨基葡萄糖含量进行测定,得到盐酸氨基葡萄糖的浓度为7.26×10-4mol·L-1,计算得到胶囊中盐酸氨基葡萄糖的含量为0.238 6 g/粒,和胶囊标示量(0.24 g)一致。

