线粒体基因组D环区基因突变与结节性甲状腺肿瘤的相关性研究
范希景 傅媛 方莉萍 项曦 王金华 浮苗
线粒体DNA(mtDNA)特别是非编码控制区(D-loop 区)突变在宫颈癌、乳腺癌、胃癌、结直肠癌、肝细胞癌、肺癌和肾细胞癌中均有发现,是肿瘤研究领域中的热点[1-2]。线粒体除提供能量和产生活性氧(ROS)外,还参与细胞凋亡,其D-loop 区含有控制mtDNA 复制和转录的调控序列[3]。甲状腺肿瘤有逐年增高的趋势,其发病机制和治疗引起广泛关注[4]。结节性甲状腺肿瘤虽是良性病变,但有合并癌及癌变的可能性。本文探讨mtDNA D-loop 区突变在结节性甲状腺肿瘤致病机制中的作用。
1 材料与方法
1.1 标本来源 选取2018 年4 月至2019 年4 月本院无遗传关系的结节性甲状腺肿瘤患者74 例,均由>2位病理医师诊断。排除其他组织、脏器肿瘤;糖尿病、高血压;已接受放化疗和药物治疗;与线粒体突变有关疾病者。男女比例约1 ∶2,平均年龄(47.41±10.59)岁。收集同一患者的肿瘤组织和附近正常组织(距离肿瘤组织>5cm),以及外周静脉血2ml。本项目经本院伦理委员会批准,所有患者均签署知情同意书。
1.2 方法 (1)DNA 抽提:提取组织和血液细胞总DNA,使用DNA 提取试剂盒(天根有限公司,中国)。(2)PCR 扩增:设计用于扩增mtDNA D-loop 区域的引物序列,L15975F: 5'-CTCCACCATTAGCACCCAAAGC-3',H794R: 5'-AGGCTAAGCGTTTTGAGCTG-3'。使用PCR扩增试剂盒(TaKaRa,日本)进行PCR,在PCR 反应管中依次加入下列物质:2×PCR Premix 25μl,上游引物1μl,下游引物1μl,模板DNA2μl,灭菌双蒸水补足至终体积为50μl。PCR 扩增:95℃预变性5min;94℃变性30s,57℃退火30s,72℃延伸40s,35 个循环;72℃延伸4min 扩增。取2μl 反应产物,在1.5%的琼脂糖凝胶上进行电泳。对于扩增效果良好且足量的样品,进一步进行纯化和测序。(3)测序:委托杭州擎科生物公司进行测序,所有样品均进行双向测序。
1.3 统计学方法 采用SPSS 18.0 统计学软件。计量资料以(±s)表示,用t 检验;计数资料以n 表示,用卡方检验,P<0.05 为差异有统计学意义。
2 结果
2.1 PCR 扩增结果 所有结节性甲状腺肿瘤组织、瘤旁正常组织和外周血均扩增出1543bp 片段,见图1。
2.2 结节性甲状腺肿瘤患者mtDNA D-loop 区多态性变化 本研究中74 例结节性甲状腺肿瘤患者,共发现107(303-309 按一个点)个多态性变异,人均变异数为1.45 个,所有变异均有报道,如A73G,G103A,A263G 等。剑桥序列中303-309 位点共有7 个C 碱基,称之为C7,在303-309 位点会插入或缺失若干个C 碱基,插入一个C 碱基即C8,两个C 碱基为C9,以此类推;另外也会在523 缺失A 碱基,524 位点缺失C碱基。有10 例标本出现以上多态性改变,见表1。
图1 mtDNA D环扩增产物琼脂凝胶电泳图
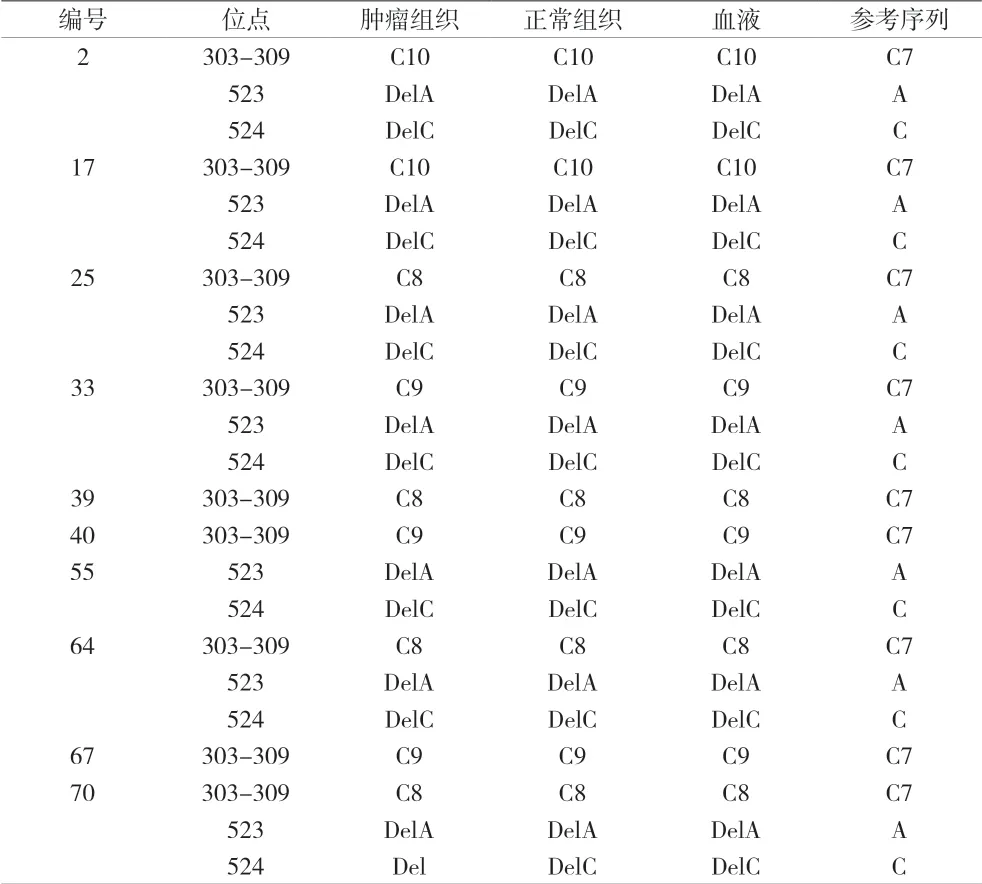
表1 结节性甲状腺肿瘤mtDNA D-loop 区部分多态性变化
2.3 结节性甲状腺肿瘤患者mtDNA D-loop 区点突变 13 例患者携带mtDNA D-loop 区点突变,突变率为17.57%(13/74),出现A-C,T-C,delAC、G-C 等基突变,异质性为38.46%(5/13)。其中10 例患者均携带HVR-I 区(16024~16324)和HVR-II 区(63~322)两个高变区突变,其中HVR-II 区占53.85%(7/13)。见表2,图2。

表2 甲状腺肿瘤患者 mtDNA D-loop 区点突变
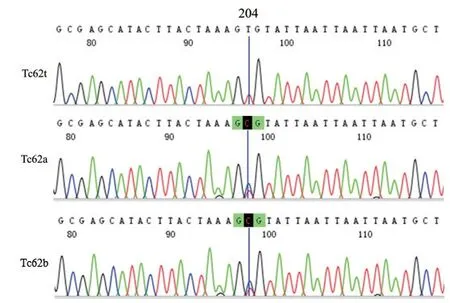
图2 测序结果碱基替换图
2.4 结节性甲状腺肿瘤患者临床资料分析 mtDNA D-loop 区突变组与非突变组比较,各临床指标差异无统计学意义(P>0.05)。见表3。
表3 结节性甲状腺肿瘤患者临床资料分析(±s)

表3 结节性甲状腺肿瘤患者临床资料分析(±s)
注:T3代表三碘甲状腺氨酸,T4代表甲状腺素,TSH代表促甲状腺素,FT3代表游离三碘甲状腺原氨酸,FT4代表三碘甲状腺氨酸
临床指标 mtDNA D-loop非突变患者(n=61)mtDNA D-loop突变患者(n=13) P值性别比(男∶女) 21∶41 2:11 >0.05年龄 45.72±11.33 50.32±12.66 >0.05有家族史例数 4 1 >0.05肿瘤大小(cm2) 5.24±5.07 6.22±4.23 >0.05 T3 1.57±0.30 1.62±0.08 >0.05 T4 113.80±26.02 108.67±13.4 >0.05 TSH 1.45±0.86 1.32±0.97 >0.05 FT3 4.38±0.41 4.29±0.63 >0.05 FT4 13.16±2.4 12.54±2.21 >0.05
3 讨论
线粒体基因组特别易发生突变,是由于细胞器中产生高水平的活性氧(ROS)和低水平的错配修复基因(MMR)[5-6],且D-loop 区是人类线粒体基因组中最可变部分[7]。研究发现,尤其是HVR-I 和HVR-II这两个高变区,碱基替换率高于mtDNA 其他区域6~8倍[8]。然而,目前对mtDNA 突变位点的研究大多在恶性肿瘤中,国内外研究人员已在直肠癌、胃癌、甲状腺乳头状癌及乳腺癌中检测到相应的mtDNA 突变,突变率最高达61%[9-11]。
本研究对74 例结节性甲状腺肿瘤患者mtDNA D-loop 区测序发现107 个多态性位点,人均变异数为1.45 个。mtDNA nt303~309 区域是D-loop 区最常发生变异的区域,插入或缺失1~3 个PloyC 结构[12]。在nt303~309 区域有9 例标本均存在1~3 个碱基C 插入的多态性改变。nt303~309 区域是负责RNA-DNA 的形成,从而开始mtDNA 的复制,这个区域的一些严重突变可能对肿瘤细胞的生长有一定的影响[13]。Maximo V 等[14]检测突变率分别达50%(15/30)和47.6%(17/36),这些高频突变反映甲状腺肿瘤mtDNA 的不稳定性。Ding 等[15]在101 例甲状腺肿瘤(含结节性甲状腺肿、腺瘤和甲状腺乳头状癌)的检测中发现在瘤前病变中突变即存在,并随肿瘤的发生而增加。本研究中检出13 例携带mtDNA D-loop 区点突变,突变率为17.57%(13/74),主要集中在两个高变区(HVR-I和HVR-II),其中HVR-II 区占53.85%(7/13),突变是A-C、T-C 等转换,通常导致其相应蛋白质的中度或高度保守氨基酸的变化。这些数据表明mtDNA突变可能在结节性甲状腺肿瘤的发生中起重要作用,鉴于mtDNA 突变存在于良性多结节增生中,其可能参与肿瘤发展的早期阶段。
本研究中发现有5 例结节性甲状腺肿瘤携带异质性突变,提示突变细胞具有选择性生长优势,在肿瘤细胞增殖过程中逐渐在数量上占优。由于mtDNA 分子在细胞内的复制优势,突变可能会被放大,mtDNA 扩增后的细胞由于其克隆生长优势可能会占据整个种群[16]。通过分析D-loop 区突变状态和临床病理特征间的相关性,发现D-loop 区突变组与非突变组在年龄、性别、是否有家族史、肿瘤大小、以及甲状腺五项功能检测差异无统计学意义。这可能是肿瘤发展过程中的一个早期事件,在肿瘤演变的全过程中持续存在。
综上所述,本研究确定了D-loop 区在结节性甲状腺肿瘤中是一个具有高度多态性和较高突变率的区域。虽然,mtDNA D-loop 区突变和临床病理参数间无相关性,但能够为mtDNA D-loop 区突变和结节性甲状腺肿瘤的发病机制提供一定的基础。mtDNA 在肿瘤发生过程中的变异,有望成为肿瘤诊断、预后和治疗新的靶生物标志物。

