基于FOXO信号通路探讨益肾喘宁汤对肾气虚哮喘的作用机制*
姜春燕 宋 红 孔丽娅 郑小伟
浙江中医药大学基础医学院 浙江 杭州 310053
支气管哮喘以炎性细胞浸润、气道高反应性以及气道重塑[1]为主要特征,由于该疾病患病率、复发率和经济影响日益增加,已成为全球关注的一个原因。全球疾病负担研究估计全球有3.39亿哮喘患者[2]。目前,哮喘的发病机理仍未全部阐明。从免疫学角度分析,哮喘是由各种介导和相互作用的免疫细胞及相应细胞因子引起[3]。相关研究表明,Th1/Th2免疫失衡、Treg/Th17免疫失衡在哮喘的发病进程中发挥重要作用[4-5]。本研究在卵清蛋白致敏法与多因素复合法结合建立肾气虚哮喘模型基础上,通过磷酸化抗体芯片技术,筛选出肾气虚哮喘发病机制FOXO信号通路的相关蛋白,探讨益肾喘宁汤可能的作用靶点,为临床提供可靠的动物实验依据。
1 材料与方法
1.1 实验动物:SPF级雄性Wistar大鼠32只,鼠龄6~8周,重量220~250g,购于上海斯莱克实验动物有限责任公司,在浙江中医药大学动物实验中心按《中华人民共和国实验动物管理条例》进行喂养。
1.2 主要试剂与药物:OVA卵清蛋白(OVA,gradeV,sigma有限公司,批号:SLBQ9036V);Al(OH)3粉末(上海凌峰化学试剂有限公司,批号:20130818);3%戊巴比妥钠(浙江中医药大学动物实验研究中心);大鼠血清睾酮(T)、甲状腺素(T4)ELISA试剂盒(南京建成生物工程研究所);大鼠血清皮质醇(COR)ELISA试剂盒(上海酶联生物科技有限公司);益肾喘宁汤由熟地黄、怀山药、山茱萸、泽泻、丹皮、茯苓、苦参、天浆壳各12g,旋覆花、黛蛤散、生黄芪各15g,北五味子5g,沉香8g组成,中药饮片均从浙江中医药大学中医门诊部购买,用自动煎药机制备成含生药量1.6g/ml的药液,存放于4℃冰箱保存,备用;普米克令舒(布地奈德悬浮液)(浙江大学附属第二医院,批号:LOT 322335)。
1.3 主要仪器:超声雾化吸入器(江苏鱼跃医疗设备股份有限公司);离心机(Pico21,Thermo Scientific,USA);酶标仪(PE Victor,PE,USA);芯片小型离心机(ChipMate PMC-082,Tomy,Japan);芯片扫描仪(GenePix 4000B,Axon Instruments,USA);软件 GenePix Pro 6.0(Axon Instruments,USA)。
1.4 方法:适应性饲养1周后,将实验大鼠随机分为正常组、肾气虚哮喘组、中药组和中西药组,8只/组。参照课题组前期实验方案[6],除正常对照组,其余各组大鼠均采用OVA致敏法进行哮喘造模,游泳力竭法、恐伤肾双因素复合法进行肾气虚证造模,连续造模14天。实验第15天开始,中药组、中西药组大鼠均予益肾喘宁汤灌胃,中西药组大鼠另予普米克令舒雾化吸入,日给药剂量参照《医学实验动物学》计算大鼠的等效剂量进行计算。实验第29天,将大鼠麻醉后腹腔采血,解剖后分离肺脏并取出,用生理盐水冲洗,切取直径为4~5mm大小的肺组织置于冻存管内,迅速投入液氮瓶中,当全部样本收集完后再转移至-80℃冰箱保存;另切取部分肺组织放入10%中性福尔马林溶液中,待测。
1.5 模型验证:观察各组大鼠实验前后一般情况的改变,包括饮食情况、活动量、呼吸状态、毛发光泽度等;显微镜下观察、分析肺组织常规HE染色、病理切片结果;ELISA检测各组大鼠肾气虚证的相关指标即血清T、T4、COR水平。
1.6 磷酸化抗体芯片技术:分述如下。
1.6.1 样品蛋白抽提:各组随机抽取一个样本,4℃预冷用1×磷酸缓冲溶液(PBS)(pH=7.4)反复清洗至上清无明显血色,加入200μl芯片专用裂解液,匀浆3次,加入Full Moon提供的细胞裂解磁珠,涡旋5次。离心后取上清移至新离心管中,重复操作至上清澄清为度。
1.6.2 裂解液/标记缓冲液置换:取出柱子离心,加入650μl标记缓冲液,涡旋,除去底部的气泡,室温平衡60min,放入样本收集管,离心。移至新的收集管中,加入100μl的蛋白质提取物,离心。
1.6.3 样品蛋白标记:使用前离心Biotin Reagent,加入二甲基甲酰胺(DMF)配制成浓度为10μg/μl,标记为Biotin/DMF。取蛋白样品50μg到离心管中,加入标记缓冲液稀释至总体积为75μl。每管加入3μl Biotin/DMF,混匀,加入35μl终止液。
1.6.4 芯片封闭:将芯片从4℃冰箱取出,室温平衡45min,放入培养皿中,用封闭溶液完全浸没芯片,将培养皿放到水平摇床上,封闭45min。用Milli-Q水重复洗涤芯片10次,甩干。
1.6.5 芯片杂交:将6ml杂交缓冲液移入15ml离心管中,加入0.18g脱脂奶粉配制成杂交液。取50μg生物素标记后的样品加到杂交液中,标记为Protein Coupling Mix。芯片放入杂交盒中,缓慢加6ml Protein Coupling Mix于芯片表面,置于水平摇床反应。稀释Wash Buffer洗液。将芯片移到装有Wash Solution的培养皿中,置于水平摇床反应,重复清洗3次。用Milli-Q水重复洗涤芯片10次,甩干。
1.6.6 芯片扫描:使用Detection Buffer稀释Cy3-Streptavidin,配制成0.1%的Cy3-Streptavidin Solution,加入到培养皿中,将芯片没入其中,置于水平摇床反应20min。将芯片移到装有30ml Wash Solution的培养皿中,置于水平摇床反应,重复清洗3次。使用Milli-Q水全面洗涤芯片重复10次。离心干燥芯片。GenePix 4000B扫描芯片。
1.7 数据处理:对获得的芯片图像,使用GenePixTMPro v6.0软件读取原始数据。对芯片背景、阳参及内参位点的信号强度情况进行统计。用SPSS 20.0统计软件将数据进行统计分析,采用t检验来比较组间差异,视P<0.05为差异具统计学意义。
2 结果
2.1 大鼠一般情况观察:整个造模过程中,正常组大鼠无明显变化,皮毛顺滑光泽,呼吸平稳,行动自如,饮食二便均正常;肾气虚哮喘组大鼠造模后呼吸频率加快、口唇发紫,在每日雾化激发及游泳后时尤为显著,体重增长幅度减缓,毛发较正常组粗糙色黯,时有躁动不安、抓耳挠腮、二便失禁等表现;中药组和中西药组上述情况较肾气虚哮喘组均有明显改善。
2.2 肺组织HE染色结果:正常组样本的肺泡、支气管结构均清晰完好;肾气虚哮喘组大鼠肺组织切片可观察到以嗜酸性粒细胞、中性粒细胞为主的炎性细胞浸润、支气管上皮脱落和平滑肌增厚的情况;中药组、中西药组大鼠的肺组织切片可见上述病理改变均见减轻。
2.3 大鼠血清ELISA检测结果:肾气虚哮喘组大鼠血清的T、T4、COR含量均低于正常组(P<0.05),中药组和中西药组指标较肾气虚哮喘组均有所上升,结合对大鼠症状、体征的观察,提示肾气虚证造模成功。详见表1。
表1 各组大鼠血清中T、T4、COR测定比较(±s,ng/ml,n=8)
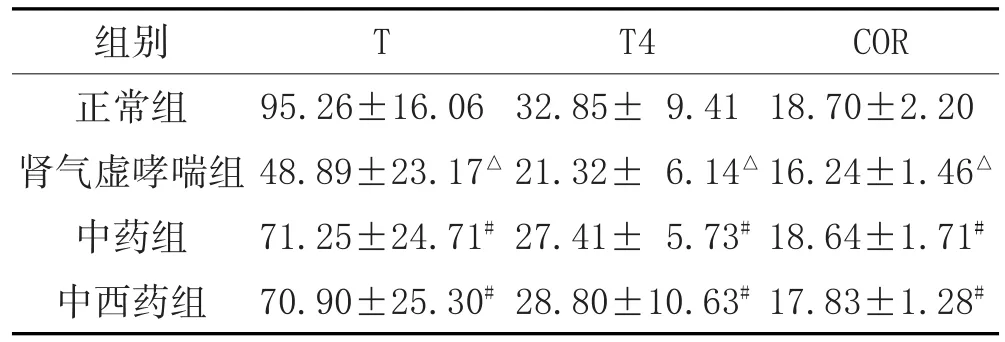
表1 各组大鼠血清中T、T4、COR测定比较(±s,ng/ml,n=8)
注:与正常组比较,△P<0.05;与肾气虚哮喘组比较,#P<0.05。
COR 18.70±2.20 16.24±1.46△18.64±1.71#17.83±1.28#组别正常组肾气虚哮喘组中药组中西药组T 95.26±16.06 48.89±23.17△71.25±24.71#70.90±25.30#T4 32.85±9.41 21.32± 6.14△27.41±5.73#28.80±10.63#
2.4 芯片检测结果:从各组大鼠中随机抽取一个肺组织样本,采用磷酸化抗体芯片技术检测大鼠肺组织FOXO通路相关蛋白磷酸化水平变化。见图1。
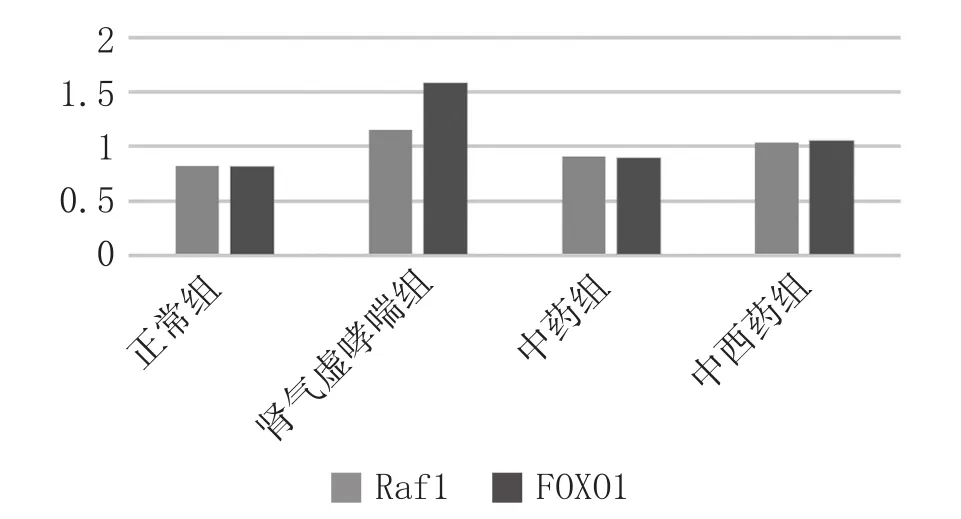
图1 各组大鼠肺组织蛋白Raf1、FOXO1磷酸化水平
3 讨论
哮喘是一种发病率较高的慢性气道炎症性疾患。近几十年来,自身免疫性(Th1相关)和过敏性(Th2相关)疾病的患病率都有所上升[7]。课题组前期研究发现Th17/Th1、Th17/Treg和Treg/Th2的免疫失衡在肾气虚哮喘发病中发挥着重要作用。
Raf1是MAPK通路上的重要蛋白,是Raf激酶家族的成员,调节许多基本的细胞过程,包括增殖、分化、凋亡、运动和代谢,并且可与许多蛋白质包括p21活化激酶(PAK3)、丝氨酸/苏氨酸激酶3(STK3)和蛋白激酶C(PKC)的活性相互作用和调节[8]。Raf激酶是T细胞信号传导中重要的细胞内介质,对炎症细胞的增殖至关重要,在Th1细胞产生IFN-γ中起着重要作用[9]。
转录因子的叉头盒蛋白O(FOXO)家族亚类由FOXO1、FOXO3、FOXO4和 FOXO6四个成员[10]。FOXO1是Raf1的下游因子,参与了T细胞的稳态和存活,通过物理抑制转录因子rorγt活性(Th17细胞的主要调节因子)来负性调节Th17细胞的分化和致病性。此外,FOXO1还参与调节性CD4+T细胞(Tregs)的发育和功能[11]。多项研究表明FOXO1在炎症信号中的促炎作用[12-13]。FOXO1在过敏性哮喘炎症小鼠模型中,集中参与过敏性哮喘肺部炎症的发生,FOXO1过度表达小鼠表现为过敏性气道炎症,并加重了Th2免疫反应,这些反应与趋化因子的产生和黏液细胞增生有关,对FOXO1进行药理学抑制能显著减轻哮喘肺部炎症的发展[14]。
益肾喘宁汤是以六味地黄丸为基础,又加黄芪益气,五味子敛气,沉香纳气,旋覆花降气,苦参、天浆壳、黛蛤散化痰清肺、止咳平喘,全方补中有泻,升中有降,肺肾同调,相得益彰。本实验利用磷酸化抗体芯片技术对肾气虚哮喘肺组织中差异表达蛋白进行筛选,获得2个主要的差异蛋白。有研究表明[15],蛋白质磷酸化在细胞信号转导、细胞分化、基因表达、DNA复制中扮演着重要的角色。因此,磷酸化抗体芯片技术是研究疾病发病机制、药物效应和生物学功能的重要手段。本实验中,与正常组相比,肾气虚哮喘组肺组织中Raf1、FOXO1磷酸化水平显著上调,提示Raf1、FOXO1可能参与了肾气虚哮喘的发病进程;与肾气虚哮喘组比较,益肾喘宁汤干预之后大鼠肺组织内Raf1、FOXO1磷酸化水平有明显的下调,提示该方可能通过下调肾气虚证哮喘大鼠肺组织FOXO信号通路的Raf1、FOXO1磷酸化水平,从而纠正T细胞分化时Th1、Th2、Th17和Treg间的免疫失衡,以缓解气道慢性炎症。关于益肾喘宁汤干预肾气虚证哮喘的作用机制仍需进一步研究。

