关于隐源性脑卒中的新发现
张于,曹磊,高莉,张玉顺
(1.西安电力中心医院心内科,陕西 西安 ;2.西安交通大学第一附属医院结构性心脏病科,陕西 西安)
1 介绍
房间隔憩室(Atrial Septal Pouch ASP)被认为是一个正常人体心脏的解剖变异。早在2006年,就有病例报道发现其起源于房间隔腔内的冠状动脉栓子[1]。2010年,Krishnan和Salazar检查了94个随机选择的解剖心脏标本,描述了一个新的结构——位于人体房间隔内的盲端小袋或憩室。他们称之为ASP,60%的标本中都有这种现象[2](如图1)。这引发了一场对房间隔形态学研究的雪崩,并开始讨论这个新发现的小结构的潜在临床意义。本就就ASP的病因、形态学、临床意义及影像学方法等方面的研究现状进行综述。
2 心房间隔憩室的形成原因
在胚胎期,房间隔是打开的,只允许心房血液从右房向左房分流(短路肺循环)。刚出生时,由于呼吸肺血流急剧增加,左心房迅速增加的压力将原发隔推到所谓的“继发隔”上,此连接自然关闭(功能关闭),这实际上是心房壁的深折叠[2]。根据人体房间隔的终生重塑理论,原发隔与继发隔之间的反复匀速运动及摩擦力导致邻近结构的微损伤,并最终导致连接的逐渐闭合[3]。在大约1/4的成年人中,这种融合不会发生,原发隔与继发隔未能自然黏连与融合所留下的裂隙样的异常通道称为卵圆孔未闭(PFO),存在心房之间的分流[4]。同时,原发隔和继发隔的不完全融合导致ASP的形成,大多数情况下,产生与左房相通的憩室[2]。局限于重叠区尾侧的融合导致左房间隔憩室(Left Atrial Septal Pouch LASP),局限于中央的融合导致双侧心房间隔憩室。仅限于顶部的融合形成右心房间(RASP)[2,3]。应该强调的是ASP与PFO是原发隔与继发隔发育、形成、重塑过程的不同转归,因此PFO不与ASP共存[5](见图1)。

图1 房间隔示意图。(A)继发隔与原发隔之间平滑融合发生在整个重叠区。(B)PFO。(C)左房间隔憩室--仅限于重叠区尾部。(D) 右房间隔憩室--局限于顶部。(E)双侧房间隔憩室--融合发生在中部。LA=左心房;RA=右心房。
3 心房间隔憩室形态
ASP的形态类似于袋鼠式口袋[3]。2010年及2016年总共294例健康成人心脏的尸体研究中40.8%的心脏标本出现LASP。RASP占5.1%,而双侧占3.7%。在所有标本中25.9%发现PFO通道(如图2)[2,3]。Holda等人发现PFO在年轻人中更普遍,相反,老年人ASP更多见。进一步支持房间隔是持续的、终身内部重塑理论[3]。LASP是房间隔结构内最常见,其患病率高则进一步证明不是病理的,而是正常人体心脏的解剖变异[5]。LASP位于左心房前壁和房间隔左侧,由游离壁、心房壁、憩室口、顶部和腔组成,其顶向下,尸检的心脏标本检查铸形显示LASP有圆锥或圆柱形[3]。LASP平均深度为8.4±5.1mm,平均体积为0.31±0.11mL。憩室的游离壁由横纹肌纤维及结缔组织两层不同的结构组成。心房壁在形态上有丰富的肌层被心内膜覆盖。肌肉组织可使ASP内腔收缩并排空血液。在憩室的顶端,有心内膜下结缔组织的堆积,支持融合PFO通道并进一步发展为ASP的理论[3]。RASP的结构不同,朝向相反,顶端朝上,口朝下腔静脉方向,RASP主要位于卵圆窝上前侧(62.5%),25.0%位于中央区,6.25%位于后上,6.25%位于卵窝前侧。右侧隔袋明显小于左侧隔袋,平均深度为6.2±3.4mm,平均体积为 0.25±0.08mL[5]。
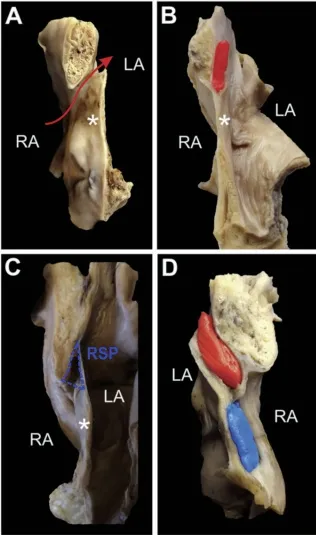
图2 展示尸体心脏标本铸形图,房间隔区的横截面。(a)卵圆孔未闭-连接左心房和右心房的通道。(b)左房间隔憩室-憩室与左心房腔相通,而心房之间没有连接。(c)右房间隔憩室-憩室与右心房相通,心房之间没有连接。(d)双侧房间隔憩室-左侧和右侧憩室共存,没有连接。LA=左心房;RA=右心房;RSP=右房间隔憩室;*=卵圆窝。
4 房间隔憩室的影像学方法
LASP可以使用多种成像技术实现可视化。经食道超声心动图(TEE)是对房间隔区成像的最佳方法(如图3),在经胸超声心动图中,由于位置靠后及与心脏和胸部的其他结构相关很难看到。TEE与盐水注射联合Valsalva方式是LASP可视化的金标准[6]。盐水对比剂注射检测PFO通道存在时可排除LASP的可能性,因此提高了诊断的阳性率及准确性。三维TEE在发现LASP方面优于二维TEE[7]。利用64排心脏多层计算机断层扫描(MSCT)也是一个有价值的工具,64排MSCT提高左心房的高分辨率实现可视化,可清晰了解其解剖结构[8]。但是,64排MSCT不应用于RASP的评估,因为右心房血液对比度明显低,可能影响评估结果。与TEE相比在识别LASP方面的灵敏度较低,它的主要缺点是不能正确检测PFO通道,在吸气时进行MSCT,这可能会轻微影响测量结构的大小,不能动态显像,某些情况下可能与LASP相混淆[9]。心脏磁共振也可见ASP成像[1],但迄今为止没有研究这种方法在评估房间隔形态中的准确性和实用性。
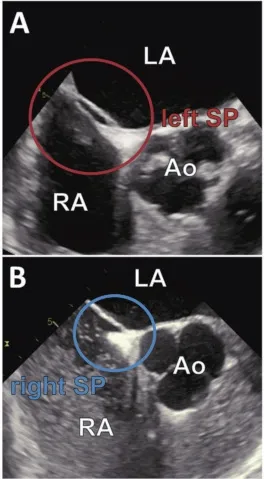
图3,经食道超声心动图检查(A)左房间隔憩室;(B)右房间隔憩室;AO-主动脉;LA-左房;RA-右房。
5 心房间隔憩室的临床意义
ASP仅仅是房间隔的解剖变异,还是具有临床意义?已经有十余例病例报道显示血栓起源于其内部,并将它的存在与隐源性卒中相联系[7,10]。基于初步流行病学回顾性研究提示LASP的存在与隐源性卒中风险的增加有关存在争议[11,12]。Meta分析在2017由Strachinaru等人进行,非卒中对照组和缺血性卒中患者(包括隐源性和已知病因)的LASP患病率没有显著差异(HR=1.20;95%CI=0.96-1.53;P=0.14)。但是,隐源性卒中在有LASP的病人中更常见(HR=1.53;95%CI=1.07-2.24;P=0.02)[12]。由Holda等人进行的126例隐源性卒中患者和137例无卒中的对照组研究结果显示,LASP的存在与隐源性卒中的风险增加有关,(OR=2.02;95%CI=1.19-3.41;P=0.01)[13]。Sun等 人 发 现 在 324例患者中LASP患者发生缺血性卒中的风险增加2倍[14],并且建议对隐源性卒中患者进行TEE检查时对这种结构应该进行常规评估[15]。Mateuz等人荟萃分析(纳入400名隐源性卒中患者和1456名非隐源性卒中患者)得出结论:隐源性卒中在LASP患者中发生的风险高于非LASP患者(OR=1.52;95%CI=1.15-2.00;P <0.001),表明隐源性卒中在LASP患者中发生率高出1.5倍[16]。类似于左心耳,憩室内局部血栓形成则被认为是主要的病理生理机制[3]。LASP的解剖结构可能是血液瘀滞及血栓形成的原因[16,17]。
关于为什么LASP没有常规发现血栓?一个假设认为是右肺静脉的活跃的血液层流,可能是一种保护机制防止血栓沿着心房间隔形成。当这种保护机制丧失时(例如:二尖瓣狭窄、高血压、心力衰竭、异常肺静脉汇合),血栓则可能发生在憩室。另外LASP周围的横纹肌纤维,这些纤维的收缩可以促憩室的排空,这可能是也是一种保护机制抑制憩室血栓形成。另一方面,憩室口部肌肉的节段性收缩并不排空,反而有利于血液瘀滞和血栓的形成。房间隔介入操作时可从LASP释放出栓塞物质,可能与不明原因的短暂性脑缺发作和在房间隔穿刺操作后发生的缺血性卒中有关[3]。
LASP存在的患者中发现,心房颤动这种心律失常发生率较高,关于为什么LASP可能引起心律失常的解释是基于其病因(PFO通道的融合),也可能与憩室结构中瘢痕组织的存在有关,这种瘢痕组织是致心律失常的。有一个关于LASP形成理论认为:PFO通道逐渐演变为ASP最后形成平滑的隔膜,持续不断的摩擦导致微损伤,因此形成的瘢痕组织可能是致心律失常的,这可能是LASP患者中发生心房颤动的危险增加的原因[8]。
据目前研究所知,右房间隔憩室没有临床意义。
6 结论
房间隔的解剖形态已经被我们所认识,我们应该更好地理解和重视这一结构,像重视左心耳一样重视LASP。这一结构的患病率高,尤其是在心房颤动和隐源性脑卒中患者中应常规进行评估,可能是被我们忽略的隐源性卒中的新发现。迄今为止,对于隐源性脑卒中患者LASP的治疗尚无一致性指南。与中风相关仍具有争议,也没有多中心研究数据提示需要抗凝治疗或外科闭合。我们需要更多的讨论及关注度以及更新的研究来揭示这一神秘结构。

