SiO2/Ag2S复合物制备及其去除亚甲基蓝性能研究
徐泽忠,曹显志,韩成良,谢劲松
(1.合肥学院分析测试中心,合肥 230601;2.东南大学材料科学与工程学院,南京 211189 3.合肥学院化学与材料工程系,合肥 230601)
0 引 言
众所周知,工业废水中含有大量有毒物质,如有机染料、重金属、持续存在的污染物等。这些污染物不仅污染水体环境,还可以通过食物链危害水体中的生物及人类身体健康[1-2]。亚甲基蓝(MB)是一种应用比较广泛的有机染料,也是印染废水中典型的有机污染物之一[3-5]。亚甲基蓝不易降解,抗氧化和抗光解能力强,在流动的水中长时间存在,会延缓光合活性,抑制水生生物的生长,同时,亚甲基蓝的致癌性、致突变性、毒性已得到证实[6-7]。因此如何能够高效去除水体中的亚甲基蓝等有机染料成为人们共同关注的焦点。目前去除印染废水中的有机染料主要是通过吸附法、化学沉淀法、膜分离法、电化学法等来实现[8-9],其中吸附法因具有回收效率高、操作简便、多功能性、成本效益较高、适应能力强等优点而被广泛应用于废水中有机染料和重金属离子的去除等方面[10-13]。吸附剂的种类能够在一定程度上决定吸附效果,SiO2微球由于特殊的结构尺寸和表面特性,较大的比表面积使其能有效吸附杂质和颗粒,常用作吸附剂和污水处理剂。而单分散的SiO2微球由于其中性结构,缺乏足够的吸附活性位点限制了其自身的吸附能力,且制备出的SiO2胶体很难从体系中分离出来。本研究中,在SiO2与Ag2S复合过程中可以得到硫脲-Ag配合物中间体,该中间体颗粒较大,SiO2可以镶嵌在中间体上面,经过滤与体系进行分离,加热分解可得到SiO2/Ag2S粉体。由于复合粉体颗粒尺寸较大,且热处理的过程不充分,晶化程度降低,出现了更多的复合中心,使得Ag2S的光催化性能受到限制,但同时又增加了大量的结合位点和吸附界面,吸附能力明显增强,故制备出SiO2/Ag2S复合物以有效提高对有机染料的吸附脱除能力。
1 实 验
1.1 合成和表征
首先,准确称取0.190 2 g CH4N2S和0.424 5 g AgNO3固体分别溶解于25 mL和50 mL的去离子水中,配制成浓度分别为0.01 mol/L和0.005 mol/L的硫脲水溶液和AgNO3溶液;接着,利用微量移液器将50 mL AgNO3溶液逐滴滴加到25 mL硫脲水溶液中,直到出现硫脲银配合物沉淀;最后,往硫脲银配合物溶液中滴加适量Stober法制备的SiO2胶体溶液,出现黑色沉淀停止搅拌,用去离子水和无水乙醇反复清洗若干次,将过滤得到的前驱体于真空干燥箱中在160 ℃下处理6 h,可获得目标产物。产物分别用X射线衍射仪(XRD),扫描电子显微镜(FE-SEM),全自动比表面和孔隙率测定仪(BET)进行表征与分析。
1.2 批量吸附实验
等温吸附动力学实验中,在25 ℃条件下,首先准确称取实验制备的三种不同比例的SiO2/Ag2S粉体各0.1 g加入到三组初始浓度和体积均为10 mg/L 50 mL的亚甲基蓝溶液中,经过超声分散均匀之后,再避光处理1 h进行吸附实验,以每20 min为一个时间间隔进行离心取样,利用紫外分光光度计(UV-6000PC)测试不同时间间隔下的亚甲基蓝的浓度。
等温吸附热力学实验中,首先,配制浓度分别为2 mg/L、4 mg/L、6 mg/L、8 mg/L(各50 mL)的四组亚甲基蓝溶液;接着,往四组不同浓度的亚甲基蓝溶液中同时加入0.1 g的A类吸附剂;最后经超声分散均匀之后避光处理6 h进行吸附热力学实验,当吸附达到饱和之后,分别取四组一定体积不同浓度的上清液在紫外分光光度计(UV-6000PC)测试吸附饱和之后的亚甲基蓝(MB)溶液的浓度Ce(mg/L)。在其他实验条件均不改变的情况下,通过改变吸附剂的种类,进行重复实验,等待吸附达到平衡之后取上清液进行离心处理并相应测试亚甲基蓝的平衡浓度。并依据式(1)进行平衡吸附量qe的计算。
(1)
式中:C0代表亚甲基蓝初始浓度(mg/L);Ce为亚甲基蓝的平衡浓度(mg/L);V是吸附液的体积(L);m是吸附剂的质量(g)。
2 结果与讨论
实验制备出的Ag2S和SiO2/Ag2S复合物的XRD谱如图1所示。从图中可看到复合产物的XRD谱比Ag2S的XRD谱在2θ=23°左右多了一个特征吸收峰,这段特征吸收峰与SiO2的标准谱恰好一致。由以上测试与分析可知SiO2/Ag2S复合物纯度较高,无其它杂质。
图2是添加不同含量SiO2胶体溶液所制备的SiO2/Ag2S复合物的SEM照片与元素定量分析图,从图中可以看出,SiO2/Ag2S复合物是以Ag2S链状颗粒为基体,SiO2微球包覆在表面或嵌入内部而形成的复合产物。在相同的实验条件下,随着SiO2胶体溶液添加量的增加,SiO2微球的数量也逐渐增多,并且大量SiO2微球嵌入链状Ag2S颗粒的内部(见图2(c)),而SiO2胶体溶液添加量较低时,SiO2微球主要是附着在链状Ag2S颗粒的表面(见图2(a)和2(b))。并且通过对配比为SiO2∶Ag2S=12∶75所制备的复合物进行元素定量分析可知SiO2/Ag2S复合物的主要元素为Si、O、S、Ag,其中含量最高的Si元素为盛放样品的衬底(见图2(d)),而出现的Zr元素则是由于Zr的结合能与Pt的结合能很接近,在自动显示标记时出现了错误,实际显示的标记应该是蒸镀于样品表面的Pt元素。由上述分析与测试可得出初步结论,SiO2与Ag2S的比例能在一定程度上影响SiO2/Ag2S复合物的形态,也会进一步影响复合物的功能特性。
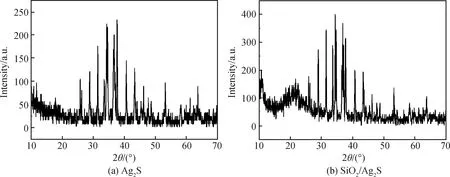
图1 Ag2S及SiO2/Ag2S复合物的XRD谱
Fig.1 XRD patterns of Ag2S and SiO2/Ag2S composites
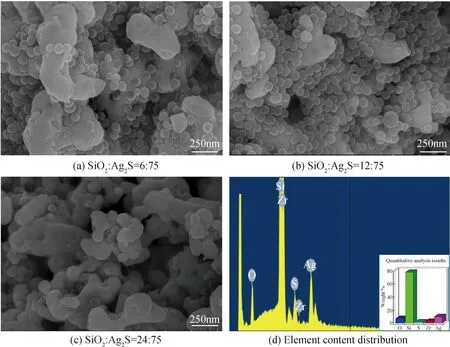
图2 不同比例SiO2与Ag2S的复合产物形态SEM照片及元素定量分析
Fig.2 SEM images and elemental quantitative analysis of composites with different proportions of SiO2and Ag2S
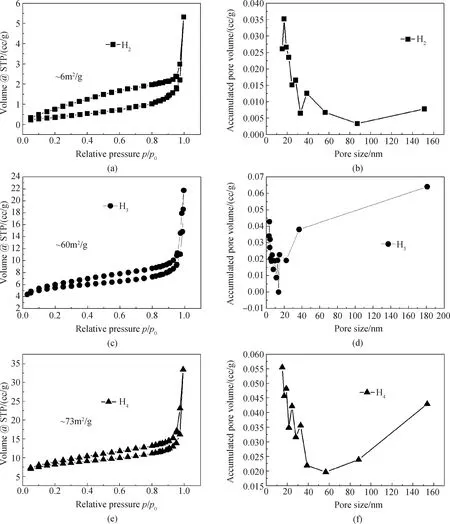
图3 SiO2/Ag2S粉体的比表面积及孔径分布
Fig.3 Specific surface area and pore size distribution of SiO2/Ag2S powder
图3是三种复合物的吸附-脱附等温曲线及孔径分布曲线。其中A、B、C类三种吸附剂分别对应SiO2与Ag2S比例为6∶75、12∶75、24∶75。从BET和孔径测试结果分析得知,H2对应的A类吸附剂的比表面积为6 m2/g(见图3(a)),孔径在20 nm处的吸附量最大,为0.035 mL/g(见图3(b))。随着SiO2胶体溶液含量的增大,H3和H4对应的B类和C类吸附剂的比表面积也急剧增大,分别为60 m2/g和73 m2/g(见图3(c)和3(e));而孔径大小也会随之发生改变,相应的孔结构也不同。在相同的孔径分布的区间内,B类和C类吸附剂的最大吸附容量分别为0.065 mL/g和0.055 mL/g(见图3(d)和3(f))。由以上分析与测试可知三种吸附剂均属于多级孔结构,其中A类吸附剂为介孔-大孔结构,B类吸附剂为微孔-介孔-大孔多级孔结构,C类吸附剂为介孔-大孔结构,SiO2微球既存在介孔也有大孔结构,而Ag2S链状颗粒主要以大孔结构存在。
为了探究时间对吸附过程的影响,分别以20 min为一个时间间隔进行吸附液的取样,测定不同时间间隔内吸附液的浓度变化。其中A、B、C三类粉体对应的SiO2含量分别为6 mL、12 mL、24 mL。结果如图4(a)所示,在吸附的起始阶段,B、C两类吸附剂吸附速率较快,表现出很强的吸附能力,在60 min左右吸附容量趋于稳定,而A类吸附剂仍然具有一定的吸附能力。通过动力学模型对数据进行拟合分析,得到三种不同比例的吸附剂对亚甲基蓝的吸附动力学曲线符合准一阶动力学方程。
等温吸附研究可以提供一些关于吸附容量和表面性质的信息以及所使用的吸附剂的亲和力等信息,从而可以更好地理解和探究吸附过程如何进行[14-15],因此,复合物对亚甲基蓝的吸附机理可以用吸附等温线进行阐释。为此,在相同条件下,对比探究了不同含量SiO2胶体溶液制备的SiO2/Ag2S复合物对亚甲基蓝的吸附情况。其中A、B、C三类粉体对应的SiO2含量分别为6 mL、12 mL、24 mL。结果如图5所示,B类吸附剂能够较大容量去除亚甲基蓝,吸附效果明显优于A、C类吸附剂。SiO2微球因具有较大的比表面积和多孔结构本就是良好的吸附剂和污染源处理剂,在一定的比例范围内增加SiO2在体系中的含量可显著提高复合物的吸附能力,故B类吸附剂的吸附能力要强于A类吸附剂,但吸附容量的变化趋势也会不同。由上述
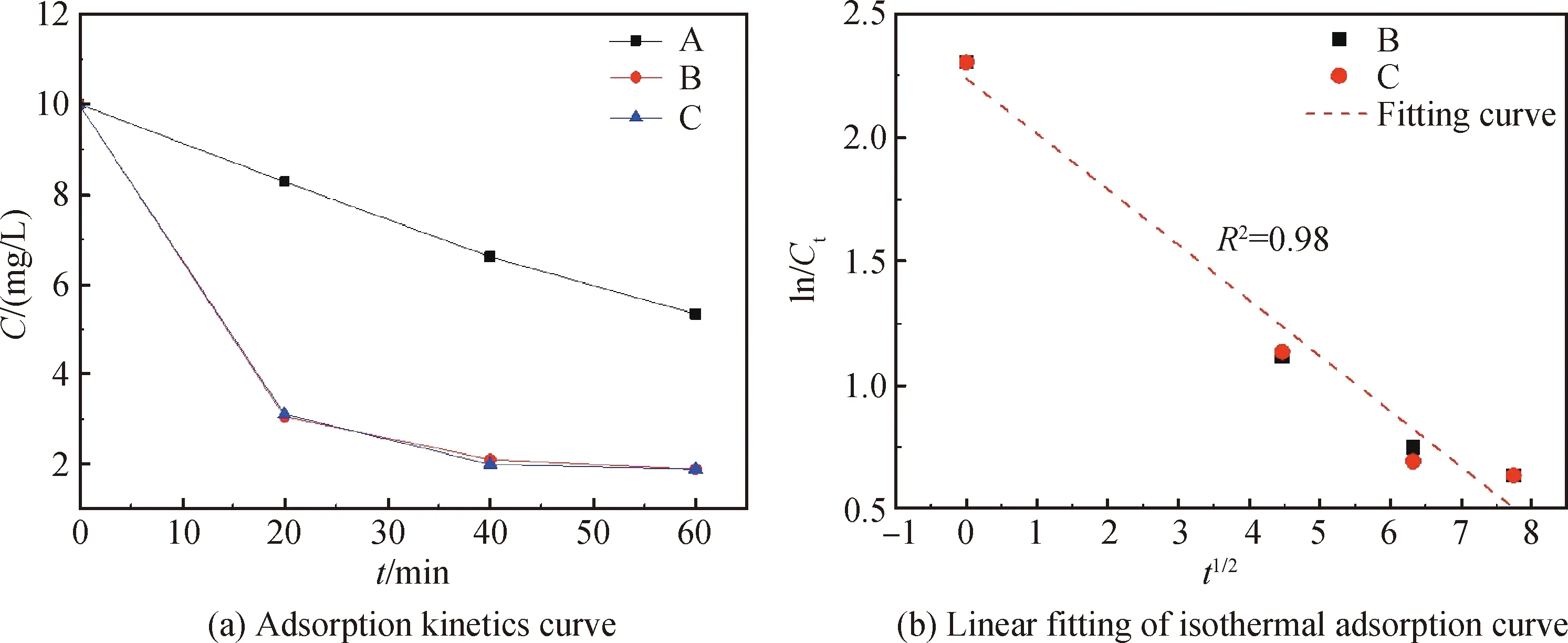
图4 吸附动力学曲线及吸附动力学曲线的线性拟合
Fig.4 Adsorption kinetics curve and linear fitting of isothermal adsorption curves
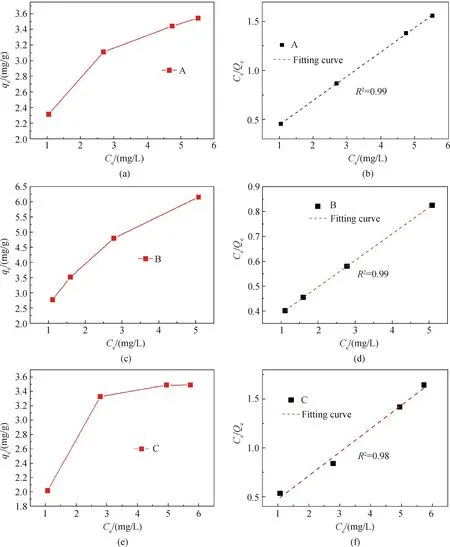
图5 三种不同比例的SiO2/Ag2S粉体吸附亚甲基蓝的吸附热力学等温曲线及吸附热力学等温曲线的线性拟合
Fig.5 Adsorption thermodynamic isotherm curves and linear fitting of adsorption thermodynamic isotherm curves of SiO2/Ag2S powder adsorption methylene blue with three different proportions
测试与分析可知,A、C两类吸附剂的吸附容量随着吸附过程的进行有逐渐达到饱和的趋势(见图5(a)和图5(e)),而B类吸附剂的吸附容量仍具有上升的趋势(见图5(c))。将Freundlich(qe=KFCe1/n)模型线性化后分别对三种吸附等温线进行拟合处理,结果分别如图5(b)、(d)和(f)所示。SiO2/Ag2S复合物吸附亚甲基蓝规律符合Freundlich模型,这说明复合材料对亚甲基蓝的吸附属于多层吸附。
3 结 论
(1)采用直接沉淀法成功制备出了SiO2/Ag2S复合物。SiO2/Ag2S复合物是以链状Ag2S纳米颗粒为基体,通过SiO2微球包覆在表面或者嵌入到颗粒内部而形成。分析与测试结果表明,随着SiO2胶体溶液添加量的增加,SiO2/Ag2S复合物的形貌和吸附性能会发生相应改变,SiO2胶体溶液添加量为12 mL时,复合物的吸附性能较优。
(2)对三种复合物进行吸附动力学与热力学实验,分析结果表明,SiO2/Ag2S复合物吸附亚甲基蓝的吸附动力学曲线符合准一阶动力学方程,并且SiO2/Ag2S复合物脱除亚甲基蓝规律满足Freundlich等温吸附模型,属于多层吸附。

