藏灵菇发酵乳生产工艺优化及其功能特性
张飞飞,牟光庆,许运鹏,姜 姗,李新玲,赵芙君竺,钱 方,*
(1.大连工业大学食品学院,辽宁 大连 116034;2.新疆天润乳业股份有限公司,新疆 乌鲁木齐 830000;3.宾夕法尼亚州立大学农业科学学院,美国 宾夕法尼亚州 19019)
藏灵菇(Tibetan kefir)属于开菲尔中的一个品系,主要由乳酸菌、酵母菌和醋酸菌等多种微生物共生聚集而成[1],其中乳酸菌包括开菲尔乳杆菌、嗜酸乳杆菌、保加利亚乳杆菌、干酪乳杆菌、发酵乳杆菌、格氏乳杆菌和肠膜明串珠菌等,约占60%~70%,酵母菌主要为啤酒酵母、假丝酵母和克鲁维酵母等。藏灵菇具有改善肠道菌群、抗感染、降血脂等诸多益生作用[2]。由藏灵菇制备的发酵乳与传统酸乳在风味、口感和质地等品质特征方面有明显差异[3]。
自由基是含有1 个或多个未配对电子的物质,人体内最重要的自由基是超氧阴离子自由基(O2-·)和羟自由基(·OH)等,主要来源于不饱和脂肪酸,且能产生许多其他自由基[4]。在通常情况下,自由基可以在激素调节、信号转导途径等生理反应中发挥重要作用。但当自由基处在较高水平时,可能会引起各种慢性疾病,包括动脉硬化、癌症、神经性疾病及糖尿病等[5-6]。胆固醇是一种能够在人体肝脏内形成或通过食物摄入的物质,对于个体的生理调节必不可少[7]。正常情况下,机体会将自身合成或由外界摄取的胆固醇转化为甾体激素或作为细胞膜组成之一,保持血液中胆固醇水平恒定,但若在血清中积累过量的胆固醇,会引发高血压、阿尔茨海默症等多种心脑血管疾病[8-10]。相关研究表明,人类可以通过食用乳酸菌及其制品摄取抗氧化物质[11-12],并且可以降低血清胆固醇含量,有利于人体健康[13-15]。而藏灵菇中含有大量乳酸菌,这为藏灵菇及其制品具有更好的功能特性提供了依据。
本研究利用单因素试验对藏灵菇发酵乳的发酵工艺进行优化,旨在获得品质较好的藏灵菇发酵乳,进一步对产品的抗氧化和降胆固醇功能特性进行研究,为藏灵菇发酵制品的开发应用提供理论基础和新思路。
1 材料与方法
1.1 材料与试剂
脱脂乳粉 大连新百丽国际工贸有限公司;全脂牛乳 大连三寰乳业有限公司;酸乳 市售。
藏灵菇(经驯化)、鼠李糖乳杆菌(Lactobacillus rhamnosus)Z2-2、鼠李糖乳杆菌Z6-1(均分离自藏灵菇)、鼠李糖乳杆菌LGG 大连市益生菌功能特性研究重点实验室;保加利亚乳杆菌(Lactobacillus bulgaricus)6047、嗜热链球菌(Streptococcus thermophiles)6038 中国工业微生物菌种保藏中心。
MRS培养基、结晶紫中性红胆盐琼脂 北京陆桥生物技术有限公司;邻苯二甲醛(o-phthalaldehyde,OPA)、硫酸亚铁、过氧化氢、三氯乙酸、氯化铁 天津市科密欧化学试剂有限公司;邻菲罗啉、Tris-HCl、邻苯三酚、二乙三胺五乙酸、铁氰化钾 国药集团化学试剂有限公司;胆固醇 美国Amresco公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)美国Sigma公司。
1.2 仪器与设备
DK-S22电热恒温水浴锅、DNP-9082电热恒温培养箱上海精宏实验设备有限公司;V-1100D可见分光光度计上海美谱达仪器有限公司;5804R冷冻离心机 德国Hermle Labortechnlk GmbH公司;AW200SG厌氧工作站 英国Electrotek公司;TA.XT Plus质构仪 英国SMS公司。
1.3 方法
1.3.1 藏灵菇发酵乳生产工艺

操作要点:1)原料乳:12 g/100 mL脱脂复原乳或全脂牛乳;2)热处理:95 ℃恒温水浴5 min;3)发酵条件:接种量2%~8%,发酵温度20~42 ℃,发酵至凝乳;4)后熟:将发酵乳放置于4 ℃冰箱后熟12 h;5)成品:脱脂发酵乳和全脂发酵乳(全脂发酵乳只用于测定胆固醇去除率)。
1.3.2 单因素试验设计
以脱脂复原乳为原料乳,根据滴定酸度和感官评价进行单因素试验,对发酵乳的接种量(2%、4%、6%、8%)、发酵温度(20、30、37、42 ℃)和发酵时间(7.0、7.5、8.0 h)进行优化。
1.3.3 理化指标测定
非脂乳固体含量、蛋白质含量和酸度测定均参考GB 19302—2010《食品安全国家标准 发酵乳》[16]中的理化指标测定方法。本研究中藏灵菇发酵乳的初步工艺优化使用的原料乳为脱脂复原乳,故不进行脂肪含量测定。
1.3.4 感官评定
参考GB 19302—2010中的评定标准。取20 mL发酵乳置于50 mL烧杯中,在自然光下观察组织状态,闻其气味,用温开水漱口,品尝滋味。

表1 藏灵菇发酵乳感官评定标准Table 1 Criteria for sensory evaluation of Tibetan kefir fermented milk
1.3.5 质构测定
使用TA.XT Plus质构仪测定发酵乳硬度和黏附性[17]。
1.3.6 微生物数量测定
乳酸菌数测定:参考GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》[18]中的平板涂布法。
大肠菌群测定:参考GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》[19]中的MPN计数法。
1.3.7 胆固醇去除率测定
采用OPA比色法,参考于平等[20]的方法,稍作修改。
标准曲线绘制:精准吸取适量1.0 mg/mL胆固醇标准溶液(无水乙醇配制),用无水乙醇定容,配制成质量浓度分别为5、10、15、20、25、30 μg/mL的标准溶液。取1 mL标准溶液与3 mL 95%乙醇和2 mL 50 g/100 mL KOH混合均匀,混合液60 ℃恒温水浴10 min,冷却至室温后加入5 mL正己烷萃取2 min;加入2 mL蒸馏水,充分混匀后静置分层;取2 mL正己烷(上层),60 ℃吹干有机相后,加入4 mL 0.5 mg/mL OPA和2 mL浓硫酸,显色反应10 min,测定其550 nm波长处的光密度(optical density,OD550nm)。以胆固醇质量浓度(μg/mL)为横坐标,OD550nm为纵坐标,绘制标准曲线。以4 mL 0.5 mg/mL OPA和2 mL浓硫酸的混合液作为空白对照。
胆固醇去除率测定:将藏灵菇(采用优化后条件)、鼠李糖乳杆菌LGG(37 ℃发酵至凝乳)、鼠李糖乳杆菌Z2-2(37 ℃发酵至凝乳)、鼠李糖乳杆菌Z6-1(37 ℃发酵至凝乳)、传统发酵剂(嗜热链球菌6038、保加利亚乳杆菌6047接种量1∶1)和市售酸乳(43 ℃发酵至凝乳)分别按照接种量6%接种到脱脂复原乳(胆固醇质量浓度100 μg/mL,理论值)或全脂牛乳中进行发酵,测定其胆固醇含量,以未发酵的原料乳作为空白对照。胆固醇去除率按式(1)计算。
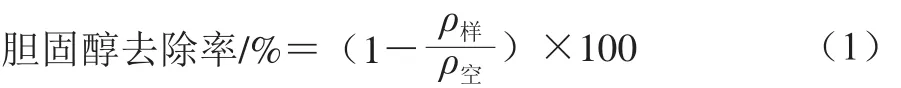
式中:ρ样为发酵乳中胆固醇质量浓度/(μg/mL);ρ空为原料乳中胆固醇质量浓度/(μg/mL)。1.3.8 抗氧化性测定
参考张书文[21]的方法,并稍作修改。发酵乳8 000 r/min离心10 min进行粗提,取发酵乳乳清分别进行DPPH自由基、·OH、O2-·清除率和总还原能力测定。
1.3.8.1 DPPH自由基清除率测定
取1 mL发酵乳乳清与等体积0.2 mmol/L DPPH甲醇溶液混匀,室温下避光反应30 min,测定其在517 nm波长处的吸光度,以0.02 mol/L磷酸盐缓冲液(phosphate buffer saline,PBS)(pH 7.4)为空白对照。DPPH自由基清除率按式(2)计算。
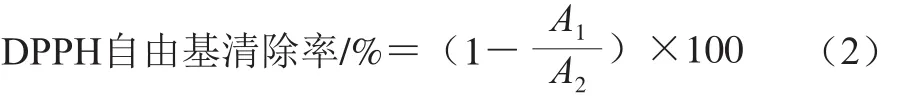
式中:A1为样品517 nm波长处的吸光度;A2为空白对照溶液517 nm波长处的吸光度。
1.3.8.2 ·OH清除率测定
向1 mL 2.5 mmol/L邻-菲罗琳溶液中依次加入1 mL 0.02 mol/L PBS(pH 7.4)和1 mL蒸馏水,混合均匀后,加入1 mL 2.5 mmol/L FeSO4溶液和1 mL 20 mmol/L H2O2溶液,充分混匀后,37 ℃恒温水浴1 h,测定混合液在536 nm波长处的吸光度。·OH清除率按式(3)计算。
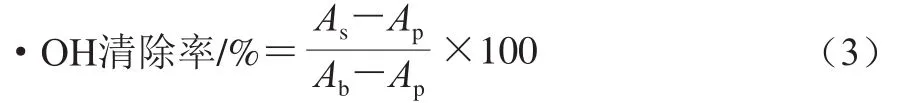
式中:Ap为混合液的吸光度;Ab为1 mL蒸馏水代替1 mL H2O2溶液时混合液的吸光度;As为1 mL发酵乳乳清代替1 mL蒸馏水时混合液的吸光度。
1.3.8.3 O2-·清除率测定
向2 mL 150 mmol/L Tris-HCl缓冲液(pH 8.2)中加入2 mL 1.2 mmol/L邻苯三酚和3 mmol/L二乙三胺五乙酸,再加入0.5 mL发酵乳乳清,25 ℃恒温水浴10 min,测定混合液在325 nm波长处的吸光度。O2-·清除率按式(4)计算。
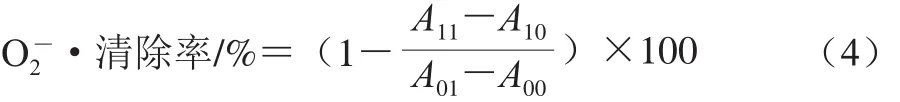
式中:A00为不含发酵乳乳清和邻苯三酚混合液的吸光度;A01为不含乳清、含邻苯三酚混合液的吸光度;A10为含发酵乳乳清、不含邻苯三酚混合液的吸光度;A11为含乳清和邻苯三酚混合液的吸光度。
1.3.8.4 总还原能力测定
向0.5 mL 0.2 mol/L PBS(pH 6.6)中加入0.5 mL 1 g/100 mL铁氰化钾和0.5 mL发酵乳乳清,充分混匀,50 ℃水浴20 min后加入0.5 mL 10 g/100 mL三氯乙酸沉淀蛋白,4 000 r/min离心10 min,取1 mL上清液与等体积0.1 g/100 mL FeCl3反应10 min,测定其在700 nm波长处的光密度。
1.4 数据处理
每组实验均设3 次平行实验及2 次重复实验。数据采用SPSS Stastistics 20.0软件进行统计分析,包括Duncan’s检验和单因素方差分析,认为P<0.05时存在显著性差异;使用Origin 2019软件绘图。
2 结果与分析
2.1 藏灵菇发酵乳工艺条件优化
以脱脂复原乳为原料乳,根据发酵乳酸度和感官评分等指标对藏灵菇接种量、发酵温度和发酵时间工艺条件进行优化。
2.1.1 藏灵菇接种量的确定
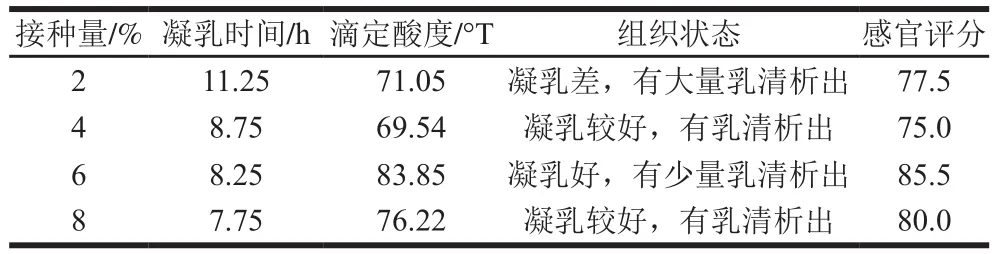
表2 42 ℃发酵条件下藏灵菇接种量对发酵乳品质的影响Table 2 Effect of inoculum amount on the quality of Tibetan kefir fermented milk
由表2可知,在相同发酵温度(42 ℃)条件下,随着藏灵菇接种量的提高,发酵乳的凝乳时间随之缩短,6%和8%接种量的发酵乳酸度不低于70 °T,符合GB 19302—2010。虽然接种量8%时发酵乳凝乳时间相对较短,但其组织状态和感官评分均不及接种量6%的发酵乳。故将6%作为最佳接种量。
2.1.2 发酵温度的确定
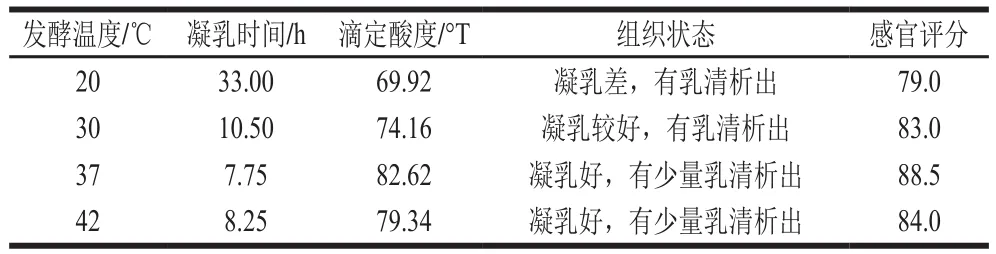
表3 接种量6%条件下发酵温度对藏灵菇发酵乳品质的影响Table 3 Effect of temperature on the quality of the Tibetan kefir fermented milk
由表3可知,藏灵菇接种量为6%时,30、37、42 ℃条件下发酵乳的滴定酸度均符合GB 19302—2010,其中37、42 ℃发酵乳的组织状态良好,但42 ℃条件下凝乳时间较长,这可能是由于藏灵菇中部分菌种嗜热或耐热性差,发酵温度较高时其活性被抑制。故将37 ℃作为最佳发酵温度。
2.1.3 发酵时间的确定
根据接种量和发酵温度单因素试验结果,初步确定藏灵菇接种量6%、37 ℃条件下发酵时,凝乳时间约为7.0~8.0 h,因此选择在此范围内对发酵乳的发酵时间进行优化。

表4 发酵温度37 ℃、接种量6%条件下发酵时间对藏灵菇发酵乳品质的影响Table 4 Effect of fermentation time on the quality of Tibetan kefir fermented milk
由表4可知,不同发酵时间发酵乳的组织状态差异不大,但发酵8.0 h的发酵乳有微量乳清析出,说明发酵时间稍长,而发酵7.0 h的发酵乳虽然凝乳状态良好,但感官评分相对较低,这可能是发酵时间相对较短,乳酸菌代谢产生的风味物质不足导致的。故将7.5 h作为最佳发酵时间。
综上,发酵温度37 ℃条件下,藏灵菇接种量6%、发酵7.5 h制备的藏灵菇发酵乳无乳清析出,质地较好,且酸度符合GB 19302—2010,因此,将上述条件作为最优发酵条件。
成品藏灵菇发酵乳中乳酸菌数为1.48×108CFU/mL,大于106CFU/mL,且未检出大肠菌群,符合发酵乳标准GB 19302—2010。杨希娟[22]、孙卓[23]等研究发现,藏灵菇及其发酵乳均对大肠杆菌等致病菌有较好的抑制作用;黄颖等[24]从藏灵菇中筛选出的具有降胆固醇能力菌株的抑菌实验也表明,其对大肠杆菌等致病菌有抑制作用。本研究结果与已有研究相一致。此外,藏灵菇发酵乳的硬度(178.43 g)大于传统发酵乳(133.18 g),说明采用藏灵菇发酵比传统发酵剂发酵制备的产品质地优;藏灵菇发酵乳黏附性为-103.52 g·s,非脂乳固体含量(>8.1%)、蛋白质含量(>2.9%)和滴定酸度(>70.0 °T)均符合发酵乳标准。
2.2 藏灵菇发酵乳的抗氧化性
机体氧化代谢产生的自由基对健康有着诸多负面作用,除自身防御及系统修复外,从食品中摄取抗氧化物质是极其必要的[25]。而乳酸菌及其制品属于天然抗氧化产品,其抗氧化功效备受关注[26-28]。
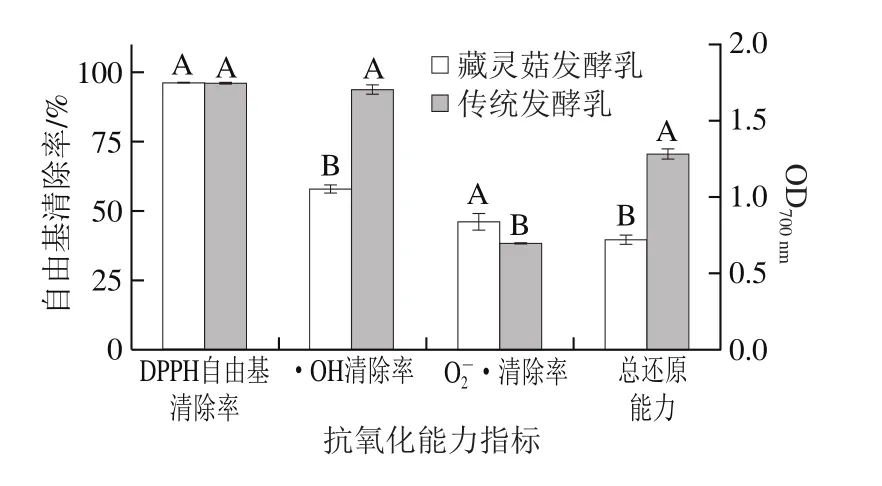
图1 藏灵菇发酵乳的抗氧化性Fig. 1 Antioxidant activity of different fermented skim milks
由图1可知,藏灵菇发酵乳和传统发酵乳(嗜热链球菌和保加利亚乳杆菌发酵)对DPPH自由基的清除率(>95%)差异不显著,藏灵菇发酵乳对O2-·的清除率略高于传统发酵乳,但藏灵菇发酵乳对·OH的清除率(约59%)显著低于传统发酵乳(约94%)(P<0.05)。此外,2 种发酵乳均具有还原能力,且OD700nm越大,抗氧化剂的还原能力越强[29],藏灵菇发酵乳的总还原能力显著低于传统发酵乳(P<0.05)。
根据上述结果可知,藏灵菇发酵乳抗氧化能力中的自由基清除率大小顺序为DPPH自由基清除率(96.38%)>·OH清除率(59.25%)>O2-·清除率(46.08%),藏灵菇发酵乳对DPPH自由基的清除效果最好。这与米兰等[30]
研究结果一致,藏灵菇发酵乳体外清除DPPH自由基能力较强,清除率高达87.99%。另外,屈长青等[31]用藏灵菇发酵乳乳清喂养昆明鼠时发现,红细胞中超氧化物歧化酶活力有所上升,进一步证实藏灵菇发酵乳乳清在动物体内的抗氧化活性。本研究还发现,与传统发酵乳相比,藏灵菇发酵乳的抗氧化性并无显著差异,这可能与藏灵菇的复杂菌相有关。
2.3 藏灵菇发酵乳的降胆固醇能力
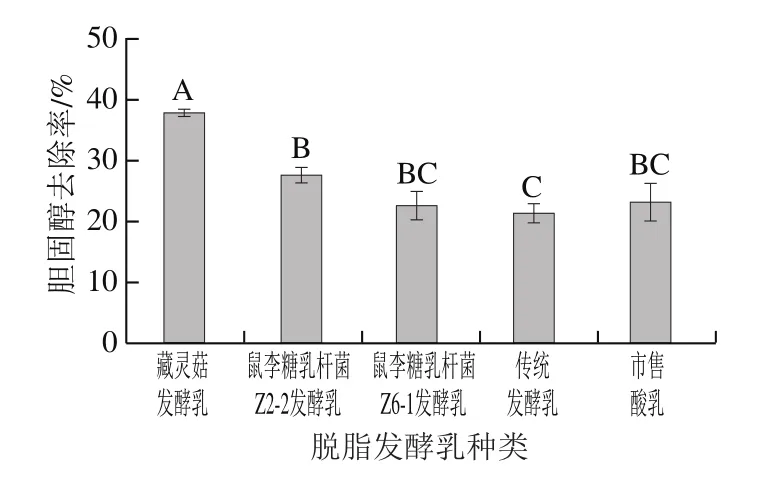
图2 不同脱脂发酵乳的胆固醇去除率Fig. 2 Cholesterol removal rates of different fermented skim milks
已有关于藏灵菇中具有高效降胆固醇能力菌株的筛选、分离等报道[24,32-33]。由图2可知,前期分离自藏灵菇的2 株鼠李糖乳杆菌(鼠李糖乳杆菌Z2-2和鼠李糖乳杆菌Z6-1)虽然具有一定的降胆固醇能力,但藏灵菇发酵乳胆固醇去除率最高(37.98%),约为传统发酵乳的2 倍,且显著高于市售酸乳(P<0.05),说明藏灵菇具有更高的降胆固醇能力,可能是由于藏灵菇中含有更多可利用胆固醇的乳酸菌等菌株。
为进一步探究藏灵菇的降胆固醇能力,用藏灵菇制成全脂发酵乳,比较其与传统发酵乳和益生性较好的鼠李糖乳杆菌LGG发酵乳的胆固醇去除率。
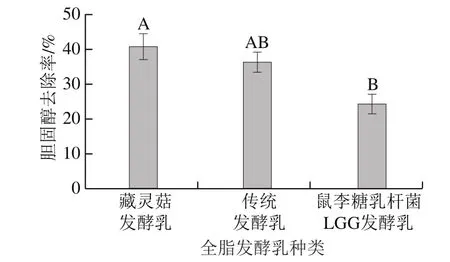
图3 不同全脂发酵乳的胆固醇去除率Fig. 3 Cholesterol removal rates of different fermented whole milks
由图3可知,藏灵菇全脂发酵乳的胆固醇去除率(40.68%)略高于传统全脂发酵乳(36.29%),显著高于鼠李糖乳杆菌LGG全脂发酵乳(24.23%)(P<0.05),进一步说明藏灵菇降胆固醇能力较强。
3 结 论
通过滴定酸度和感官评价等指标,对藏灵菇发酵乳的发酵工艺进行优化,确定其品质最优时的生产工艺为接种量6%、发酵温度37 ℃、发酵时间7.50 h。此条件下的藏灵菇发酵乳酸度适宜、口感细腻、质地均匀,具有独特风味,乳酸菌含量较高,不含大肠菌群,且各项理化指标均符合发酵乳标准。且藏灵菇发酵乳具有抗氧化活性和较高的降胆固醇能力。近些年来,藏灵菇相关研究成为热点,包括藏灵菇生理活性、菌相组成及优势菌种的分离等[2,34-35],本研究对藏灵菇发酵制品的工艺条件和功能特性进行初步研究,为开发抗氧化或降胆固醇制品提供参考依据,后续实验中应探究藏灵菇中菌株间的生物活性是否具有协同效应,且需要设计相关体内实验,将藏灵菇的益生性最大化。

