乳酸菌代谢研究进展
焦晶凯
(光明乳业股份有限公司乳业研究院,乳业生物技术国家重点实验室,上海 200436)
乳酸菌对乙醇、低pH值、高温和缺氧环境等具有耐受性,因此是生物燃料及各种生物化学产物最具潜力的产生载体之一,乳酸菌最常见的代谢终产物为乳酸,目前有更多学者关注从来自农业、工业和林业的淀粉和木质素等天然底物中生产乳酸,这种天然底物丰富、价格低廉、含糖量高且具有可再生性[1]。此外,乳酸菌代谢产生的胞外多糖(exopolysaccharides,EPS)可用于食品工业,作为乳化剂、增稠剂、增黏剂和稳定剂等,EPS还对人体有一定的益生作用,如具有抗肿瘤[2]、免疫调节[3]和金属结合能力[4]等。乳酸菌还可以代谢多种功能性低聚糖,可用作益生元[5]。乳酸菌可以代谢产生重要的芳香化合物二乙酰、乙偶姻和丁二醇等[6]。
乳酸菌的蛋白水解系统为其提供了生长所需氨基酸。例如,保加利亚乳杆菌和瑞士乳杆菌具有非常广泛的蛋白水解酶,瑞士乳杆菌可在干酪生产中作为附属发酵剂水解苦味肽。乳酸菌的蛋白水解系统可以使乳酸菌产生多种具有免疫、抗菌、类阿片、抗癌、矿物质结合和降血压等功能的肽。乳酸菌代谢与人类生活息息相关,更好地了解乳酸菌代谢有利于其代谢应用的进一步发展。
1 乳酸菌的糖代谢
糖类是乳酸菌生长的主要碳源和能量来源。乳酸菌对于碳水化合物的吸收有许多不同的转运系统,如磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP)-葡萄糖磷酸转移酶系统(glucose phosphotransferase system,PTS)、三磷酸腺苷(adenosine triphosphate,ATP)结合盒式转运系统和糖苷-戊糖苷-己糖苷转运蛋白系统。乳酸菌偏好利用葡萄糖,同时也能代谢几种常见的己糖,但代谢其他糖的能力取决于菌株本身。乳制品中的乳酸菌可以利用牛乳中的乳糖及大部分其他糖类作为碳源,而植物源的细菌可以利用多种其他碳水化合物,包括β-葡萄糖苷[7]。
细胞结合或由二糖水解释放到细胞质中的单糖会以6-磷酸葡萄糖的形式进入糖酵解或莱洛伊尔(Leloir)途径进行代谢(图1)。在乳酸乳球菌中,由PTS转运的乳糖被水解成6-磷酸半乳糖,通过塔格糖(Tag6P)途径转化,然后以磷酸丙糖形式进入糖酵解;在一些其他乳酸菌中,只有乳糖的葡萄糖部分被代谢,而半乳糖部分被排出,导致基质中半乳糖积累,从而产生劣质乳制品;半乳糖可以通过非PTS半乳糖渗透酶系统吸收,并通过Leloir途径代谢;半乳糖也可以通过PTSLac系统吸收,并通过Tag6P途径进一步代谢为磷酸丙酯[8]。最近发现了另一种半乳糖替代吸收代谢途径,半乳糖通过PTS途径进行易位,6-磷酸半乳糖去磷酸化变为乳糖,其可通过Leloir途径进一步代谢,此途径已被用于基因工程,得到半乳糖消耗率提高50%的菌株[8]。
根据乳酸菌代谢产物的变化产生3 类发酵:同型发酵、混合酸发酵和异型发酵(图1)。目前,乳酸菌中糖酵解速率的控制和调节机制尚不完全清楚。乳酸乳球菌中糖酵解速率的控制不是基于单一酶、糖转运或ATP依赖性机制,也可能是这些机制的相互作用。
近年来,随着肠道微生物生态学研究的深入以及商业用益生元寡糖需求的增加,对于糖类的研究已经从可消化的二糖转变为难以消化的高级寡糖。乳酸菌代谢单糖和二糖的途径已经被广泛研究,然而高级寡糖代谢的研究数据很少,高级寡糖在谷物、牛乳、水果和动物上肠道中非常丰富。4 种主要寡糖基团的代谢有比较详尽的报道,分别为:1)淀粉:麦芽糖糊精和异麦芽低聚糖;2)低聚果糖;3)β-半乳寡糖(β-galactooligosaccharides,β-GOS);4)棉子糖家族寡糖和α-GOS[10]。
除了代谢糖类之外,乳酸菌还能够将糖类导向胞外,合成EPS,这些长链糖类松散地附着在细胞表面,以形成胶囊状结构或分泌到胞外环境中。EPS的结构、大小和组成不尽相同,分为2 类:一类是同型多糖(homopolysaccharides,HoPS),由同一种单糖(如α-D-葡聚糖、β-D-葡聚糖、果聚糖或聚半乳糖)组成;另一类是杂多糖(heteropolysaccharide,HePS),由不同类型的单糖(如D-葡萄糖、D-半乳糖、L-鼠李糖及其衍生物)组成。HoPS通过高度特异性糖基转移酶以及葡聚糖/果聚糖蔗糖酶在细胞外合成,HoPS的合成需要蔗糖作为底物并且需要由其水解产生的能量;HePS由葡萄糖、半乳糖或其他单糖通过几种类型的糖基转移酶组合作用合成,HePS生物合成涉及4 个主要的连续步骤:1)糖转运到细胞质中;2)糖的磷酸化;3)重复单元前体的聚合;4)EPS输出到细胞外。EPS的合成应该可以通过以上4 个步骤中的任意一步进行调节,但机制并不十分清楚,EPS相关基因及基因组的测序可以提供对上述情况的进一步了解[11]。
2 乳酸菌的柠檬酸代谢
除了糖类,一些乳酸菌可以代谢柠檬酸盐。乳酸菌的柠檬酸盐代谢可以产生挥发性化合物,在发酵乳制品中这些化合物为C4化合物,如二乙酰、乙偶姻和丁二醇,它们是许多发酵乳制品的典型香气化合物。
2.1 柠檬酸转运
柠檬酸通过各种膜相关通透酶进行转运,这限制了柠檬酸的可利用程度,而细胞质中形成的挥发性化合物的分泌则不需要特定的转运蛋白。大多数乳酸菌使用2-羟基羧酸盐(2-hydroxycarboxylate,2-HCT)转运蛋白运输柠檬酸盐,该转运蛋白可以转运二羧酸和三羧酸,来自乳酸乳球菌、明串珠菌和魏斯氏菌的CitP(转运蛋白代码,下同)转运蛋白就属于2-HCT转运蛋白[12]。CitP是一种可以交换H-柠檬酸二价盐和乳酸一价盐从而产生膜电位的逆向转运蛋白(图2)。在乳酸乳球菌乳亚种丁二酮变种中,CitP基因由位于柠檬酸盐质粒上的citQRP操纵子进行编码,控制cit操纵子转录的启动子在低pH值条件下被激活,该现象被认为是微生物适应酸环境的一种应激性反应,已在乳酸乳球菌乳亚种丁二酮变种在牛乳[13]和干酪[14]中生长的转录组学分析中得到证实。
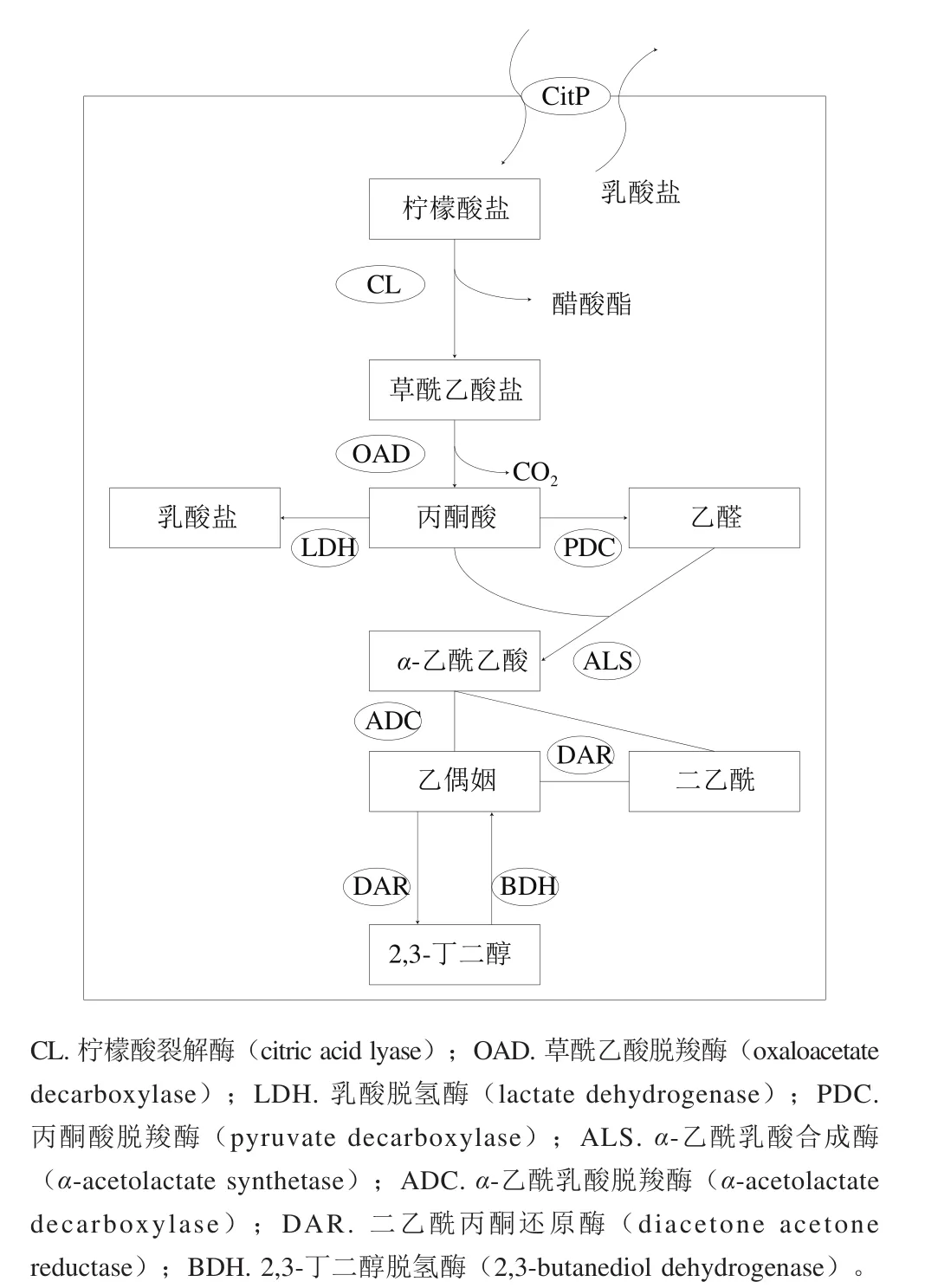
图2 乳酸乳球菌、明串珠菌和魏斯氏菌中的柠檬酸盐代谢[12]Fig. 2 Citrate metabolism in Lactococcus, Leuconostoc and Weissella species[12]
在粪肠球菌和干酪乳杆菌中,柠檬酸盐分别由CitM和CitH转运蛋白运输,二者均属于柠檬酸盐-金属同源物(CitMHS)家族,柠檬酸盐以Ca2+、Mn2+和Fe3+复合物的形式被CitMHS转运蛋白运输[15]。在植物乳杆菌、酒类酒球菌及非典型野生乳酸乳球菌乳亚种丁二酮变种中也鉴定出其他类型的柠檬酸盐转运蛋白[16]。
2.2 柠檬酸盐转化为丙酮酸并生成芳香化合物
进入细胞后,柠檬酸盐在CL复合物催化下转化为乙酸盐和草酰乙酸盐;然后,草酰乙酸被OAD脱羧,产生丙酮酸和二氧化碳,或被可溶性细胞质苹果酸酶脱羧(图2)。OAD在乳酸菌中的生理作用知之甚少,而在乳酸乳球菌乳亚种丁二酮变种、类肠膜魏斯氏菌、肠膜明串珠菌、植物乳杆菌和酒类酒球菌等菌株中,草酰乙酸均被可溶性细胞质苹果酸酶脱羧;乳酸菌的丙酮酸代谢可产生不同的终产物,包括乳酸盐、甲酸盐、乙酸盐和乙醇以及重要的芳香化合物二乙酰、乙偶姻和丁二醇[6]。
2.3 柠檬酸盐和琥珀酸盐的转化
一些乳酸菌菌种不能将柠檬酸转化为丙酮酸,而是利用CitT转运蛋白通过苹果酸和富马酸生成琥珀酸。此外,近年来有学者使用计算机模拟分析在干酪乳杆菌中鉴定了完整的三羧酸循环途径[17]。在过量和有限碳水化合物环境下,乳酸菌柠檬酸循环的优势代谢产物分别为乙酸和L-乳酸,生成痕量的D-乳酸、乙偶姻、甲酸、乙醇和二乙酰时,检测到OAD活性,但是生成琥珀酸、苹果酸和丁二醇时,没有检测到OAD活性[18]。
3 乳酸菌的蛋白水解系统
从乳制品中分离的乳酸乳球菌菌株大多数是氨基酸营养缺陷型,并且可以利用乳蛋白作为氨基酸来源,即使来自距离相隔较远的亚洲、欧洲、北美和新西兰不同地域,这些菌株也表现相同的特征。乳酸菌可以使用环境中的蛋白质作为氨基酸来源也体现了乳酸菌蛋白水解系统的重要性,乳酸菌依赖蛋白水解系统获得必需氨基酸,这些必需氨基酸用于合成多肽、蛋白质及其他生物分子。氨基酸是芳香族化合物的合成前体,对食品的最终风味非常重要。蛋白水解还能产生其他分子,如与乳酸菌益生作用相关的生物活性肽。
乳酸菌中的蛋白水解可分为几个步骤,包括蛋白质降解、肽转运、肽降解和氨基酸分解代谢(图3)。
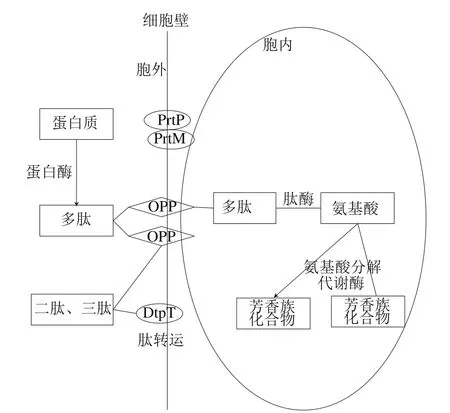
图3 乳酸菌蛋白水解系统示意图[9]Fig. 3 Schematic diagram of the proteolytic systems of lactic acid bacteria[9]
3.1 蛋白质降解
乳酸菌中蛋白质降解的最初研究集中在酪蛋白降解,使用乳酸乳球菌作为模式菌株。乳酸菌中的酪蛋白水解由细胞包膜蛋白酶(cell envelope proteinase,CEP)引发,将蛋白质降解为寡肽,基因缺失研究表明,在缺乏功能性CEP的情况下,乳酸菌不能在牛乳中生长;但是,由于CEP是胞外酶,CEP产生的肽也可以被CEP阴性突变体菌株吸收利用,使菌株在培养基中也能够存活[19]。
Lactocepins是一组由不同CEP组成的蛋白酶,属于枯草杆菌丝氨酸蛋白酶家族,CEP通过转肽酶sortase A(SrtA)锚定在细胞壁上[20]。乳酸菌的蛋白酶Lactocepins由prtP、prtB、prtS和/或prtH基因编码,这些基因由于功能结构域的数目不同而有所差别;CEP分布在菌株间差异很大,总体而言,乳酸菌中最丰富的旁系同源物为prtH3基因,超过80%的测试菌株携带该基因,其次为prtH和prtH4基因[21]。大多数乳酸菌仅含有1 种CEP。然而,在瑞士乳杆菌CNRZ32中鉴定出4 种CEP编码基因,分别为prtH、prtH2、prtH3和prtH4,瑞士乳杆菌包含的多种蛋白酶基因可以解释它的高蛋白水解活性,在所有被鉴定的瑞士乳杆菌中,prtH2基因比较常见[22]。
综上所述,CEP活性最初使用酪蛋白作为底物进行评估。但是,在非乳基质或非发酵环境中分离出的乳酸菌也表现出酪蛋白水解特性。例如,瑞士乳杆菌BGRA43分离于人类粪便,它有很强的蛋白水解活性并且能够完全水解αs1-、β-和κ-酪蛋白[23]。此外,尽管有广谱靶向切割位点,但由prtP基因编码的蛋白酶Lactocepins具有很高选择性和特异性。蛋白质降解的第2阶段是将二肽、三肽和寡肽转运到细胞中。目前在乳酸菌中已经发现3 种转运系统,分别为寡肽、二肽和三肽转运系统(分别为Opp、Dpp和DtpT),嗜酸乳杆菌、短乳杆菌、干酪乳杆菌、鼠李糖乳杆菌和乳酸乳球菌均具有这3 种肽转运系统,一些瑞士乳杆菌菌株(如瑞士乳杆菌DPC4571等)也具有这3 种肽转运系统,但瑞士乳杆菌H10等仅有2 种肽转运系统,分别为寡肽和三肽转运系统。这些结果表明,即使是相同物种的不同菌株之间蛋白水解系统也不同[24]。
3.2 肽酶
若酪蛋白衍生的肽被乳酸菌细胞摄取,它们就会在具有不同和部分重叠特异性肽酶的协同作用下被降解。肽酶是乳酸菌中蛋白水解系统的重要组成部分,参与肽水解和必需氨基酸释放。肽酶可分为内肽酶和外肽酶两大类,内肽酶水解寡肽的内部肽键,并产生可被外肽酶进一步降解的肽,外肽酶作用于寡肽的末端,以产生更小的肽或氨基酸[9]。
已经发现的乳酸菌内肽酶主要为内肽酶O(endopeptidase O,PepO)、PepF、PepG和PepE,它们均作用于N末端寡肽底物;PepO由pepO、pepO2和pepO33 个旁系同源基因编码,在瑞士乳杆菌中,这些基因是相同的,然而,由于基因功能的丧失或序列多态性,可能会观察到菌株异质性,这可能会影响单个肽酶的特异性或活性;PepF由pepF、pepF1和pepF23 个旁系同源基因编码,在乳酸乳球菌中,pepF1基因位于染色体上,而pepF2基因位于质粒上,pepF2基因的位置解释了不同乳球菌菌株之间该基因的可变性[21]。
传统上,外肽酶按其特异性分类,乳酸菌中已经鉴定出4 种外肽酶组:氨肽酶、二肽酶、三肽酶和脯氨酸特异性肽酶。氨肽酶水解来自N末端寡肽的单个氨基酸,氨肽酶可分为一般氨肽酶或特异性氨肽酶,一般氨肽酶(PepN和PepC)存在于所有基因组中,特异性氨肽酶根据它们水解的残基类型进行分类;PepS对芳香族残基具有特异性,目前仅在嗜热链球菌中发现此蛋白编码基因;PepA对Glu和Asp残基具有特异性,在链球菌以及一些乳杆菌和乳球菌中存在PepA编码基因,而片球菌和酒球菌中不存在;PepM对甲硫氨酸残基具有特异性,存在于乳杆菌、乳球菌、链球菌、片球菌和酒球菌中[9]。
二肽酶是针对二肽的特异性外肽酶。PepD二肽酶家族对多种二肽具有广泛特异性。在乳酸菌中,pepD基因表现为异质分布,旁系同源基因从0~6 个不等;PepV也由多个旁系同源基因编码,它存在于所有乳酸菌中,并且具有广泛特异性[9]。
三肽酶从三肽的N末端释放氨基酸。三肽酶具有广泛特异性,优先靶向水解疏水性肽,但不水解脯氨酸残基;目前乳酸菌中唯一鉴定出的三肽酶是PepT,pepT基因存在于所有乳酸菌基因组中,而且在嗜酸乳杆菌、约氏乳杆菌和格氏乳杆菌等乳酸菌中以2 个pepT旁系同源基因出现[9]。
脯氨酸特异性肽酶可以从肽N末端水解脯氨酸残基,脯氨酸亚氨肽酶对N末端脯氨酸肽具有氨肽酶活性,并且优选三肽进行水解;脯氨酸酶PepR对二肽具有广泛特异性,所有乳酸乳球菌中均不存在这些脯氨酸特异性肽酶[9]。
PepP是一种脯氨酸肽酶,可以切割寡肽中与脯氨酸相连的任何N末端氨基酸;PepQ也是脯氨酸肽酶,但对脯氨酸二肽具有特异性,PepQ编码基因在所有乳酸菌基因组中均等分布,每个基因组含有1 个pepQ拷贝基因,但是在德氏乳杆菌保加利亚亚种中例外;PepX是脯氨酸特异性内肽酶,存在于所有乳酸菌基因组中,通常每个基因组有1 个pepX基因,但有些乳酸菌基因组含有2 个肽酶同源基因,且通常这种乳酸菌来自于乳环境[24]。
3.3 氨基酸分解代谢
氨基酸的代谢与发酵食品的质量和安全性相关,如风味化合物和生物胺的合成。通常认为,在营养限制条件下,氨基酸分解代谢在乳酸菌获得能量的能力中具有重要作用。此外,氨基酸代谢也被认为在pH值控制机制中发挥作用。
氨基酸分解对于挥发性化合物的合成和蛋氨酸、支链和芳香族氨基酸的氨基转移非常重要。转氨作用是α-酮酸形成的主要降解途径,然后α-酮酸降解成其他芳香族化合物。氨基酸向酮类化合物和羟基酸的转化由乳酸杆菌引发,然后乳酸球菌进一步将这些产物转化为羧酸[9]。乳酸菌和非发酵乳酸菌之间的这种合作可以增强干酪风味。
亮氨酸、缬氨酸和异亮氨酸分解代谢可分为两步:第一步主要是降解途径,氨基转移酶反应将氨基酸转化为α-酮酸,其中亮氨酸转化为α-酮基异己酸盐;第二步通过3 种不同途径将所得化合物转化为醛、醇或羧酸,3 种途径分别为α-酮酸脱羧、氧化脱羧和产生α-羟基异己酸盐的替代脱氢途径;芳香族氨基酸也被AraT(酶编号代码)氨基转移酶降解,色氨酸、苯丙氨酸和酪氨酸通过转氨作用分别产生吲哚丙酮酸、丙酮酸苯酯和对羟基苯基丙酮酸,通过芳香族氨基酸转氨作用产生的α-酮酸通过酶促(脱氢、脱羧或氧化脱羧)或化学反应进一步降解为其他化合物[25]。
硫化物是有效的异嗅物质,由含硫氨基酸分解代谢产生,影响许多发酵食品的风味。蛋氨酸分解代谢产生多种挥发性硫化物,如H2S、甲硫醇、二甲基硫醚、二甲基二硫醚和二甲基三硫化物。
氨基酸分解代谢也会产生生物胺(biogenic amine,BA),BA是主要通过氨基酸脱羧作用形成的碱性含氮有机化合物,存在于包括乳制品在内的多种食品中,并且可以积累到较高浓度,食用含有大量BA的食物会对人体产生毒性。酪氨酸、组氨酸、赖氨酸、鸟氨酸和精氨酸可以分别脱羧形成酪胺、组胺、尸胺、腐胺和胍丁胺,胍丁胺可以进一步脱氨基生成腐胺。氨基酸脱羧途径包含氨基酸向细胞内的转运、脱羧及转化为BA后向细胞外的转运。氨基酸和BA的转化通过转运蛋白进行,大多数乳酸菌菌株中编码脱羧酶和转运蛋白的基因均位于染色体上。酪胺的生物合成需要酪氨酸、脱羧酶和转运蛋白TyrP。编码脱羧酶和TyrP的基因形成1 个染色体簇,并且这个染色体簇脱羧酶基因的上游始终存在第3个开放阅读框,该阅读框编码1 个与酪氨酰tRNA合成酶同源的蛋白质。在干酪中,乳杆菌属和肠球菌属是酪胺的主要产生菌种。
由于乳制品乳酸菌中不存在鸟氨酸脱羧酶途径,因此有学者提出胍丁胺途径可能是腐胺合成的主要途径;乳酸菌通过3 个步骤经胍丁胺脱亚氨酶、腐胺转氨甲酰酶和氨基甲酸酯激酶3 种酶催化胍丁胺生成腐胺,然后,反向转运蛋白将腐胺转化为胍丁胺,除腐胺外,该反应还会生成ATP和NH3;已在粪肠球菌(Enterococcus faecalis)、屎肠球菌(Enterococcus faecium)、短乳杆菌(Lactobacillus brevis)和弯曲乳杆菌(Lactobacillus curvatus)中鉴定出胍丁胺途径,在后2 种菌中,酪胺和腐胺途径均与染色体相关[26]。
精氨酸脱亚氨酶(arginine deiminase,ADI)途径和胍丁胺途径类似,ADI途径由精氨酸脱亚氨酶、鸟氨酸氨基甲酰转移酶和氨基甲酸酯激酶催化的3 个反应组成。ADI途径在乳酸菌中分布广泛,并且已经在肠球菌、乳杆菌、乳球菌、明串珠菌、酒球菌、链球菌和魏斯氏菌属中进行了鉴定。
组胺是发酵产品中经常发现的另一种生物胺,由组氨酸经组氨酸脱羧酶(histidine decarboxylase,Hdc)A催化产生,组胺的合成也需要一种可使组氨酸和组胺相互转换的抗转运蛋白,组胺基因簇具有编码HdcB的基因,该基因与HdcA编码基因共转录,是HdcA编码基因成熟所必需的,在该基因簇中还发现与组氨酸tRNA合成酶同源的蛋白质的编码基因,尽管其位置在乳酸菌属间不尽相同;Hdc基因簇已经在乳杆菌(Lactobacillus)、酒类酒球菌(Oenococcus oeni)、嗜热链球菌(Strepthermophilus thermophilus)、盐水四联球菌(Tetragenococcus muriaticus)、嗜盐四联球菌(Tetragenococcus halophilus)和希氏乳杆菌(Lactobacillus hilgardii)中进行了鉴定,除了希氏乳杆菌,其余均位于染色体上[27]。
4 基因组学、比较基因组学和宏基因组学在乳酸菌中的应用
基于下一代测序技术快速增加公开基因组数量彻底变革了微生物科学。第1个乳酸菌基因组由Bolotin等[28]在2001年公开发表,自此以后,NCBI收录了来自典型乳酸菌物种(不包括肠球菌)的近100 个完整基因组,统计数据显示,超过600 个基因组测序项目草案已经完成或正在进行。在基因组测序草案中,已经有20 种乳酸杆菌被纳入人类微生物组计划的一部分[29]。此外,随着测序技术的进步和成本的降低,有学者对乳酸乳球菌MG1363基因组进行了重测序,并与其派生菌株乳酸乳球菌NZ9000基因组进行比较,发现二者基因组中存在6 个差异,在ptcC启动子中发现2 个特定突变,它们在调节纤维二糖和葡萄糖摄取中起关键作用[30]。O’Sullivan等[31]对6 个乳酸杆菌和其他几个乳酸菌的基因组进行比较分析,鉴定出9 个壁龛特异性基因。Kant等[32]对20 个完整乳酸杆菌基因组进行比较发现,它们的细菌泛基因组大约包含14 000 个基因,其中包括383 个直系同源基因的核心基因组。
使用宏基因组学方法使得分析混合培养物中的微生物成为可能,这在工业发酵中非常重要。宏基因组学等新型分子技术可以分析乳酸菌的代谢能力,有研究从非洲珍珠粟浆液中的乳酸菌和淀粉质发酵食品宏基因组中筛选出具有益生和淀粉代谢功能的基因[33]。另有研究使用宏基因组学方法监测了韩国传统泡菜29 d发酵过程中细菌种群、代谢能力和微生物群落整体遗传特征的动态变化,将宏基因组测序结果按其功能分类,具有糖类功能分类序列的测序结果表明,其微生物组富含与单糖、双糖和寡糖发酵相关的基因;类似地,鉴定发现具有发酵功能分类序列的测序结果表明,其微生物组富含与乳酸发酵以及乙偶姻和丁二醇代谢有关的各种基因,随着泡菜发酵时间的延长,参与碳水化合物代谢和发酵代谢的基因数量通常会增加[34]。
基因组测序、基因组分析和组学技术(蛋白质组学、转录组学、代谢组学等)已被用于构建基因组规模的代谢模型,这有助于阐明多种细胞的生化途径。使用高通量技术整合基因组数据与代谢指纹图谱可以进一步理解相关的生物学信息,这种系统生物学是可以用来破译乳酸菌代谢机理的强大工具之一,系统生物学可以整合基因、蛋白质和生化反应,进一步研究微生物群落和相互作用机制。
5 结 语
乳酸菌的代谢研究受到越来越广泛的关注,了解乳酸菌的代谢不仅可以使乳酸菌在谷物和牛乳等食物中更好地生长,提高食品发酵工业发展水平,还有助于提高乳酸菌在动物胃肠道中的存活率及其益生作用,同时乳酸菌的代谢产物还可用于保健和药品行业中,因此乳酸菌代谢研究十分重要。目前,结合组学研究等现代分子学手段是乳酸菌代谢研究的最有效手段之一。

