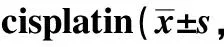沉默HOXB7抑制人宫颈癌细胞系CASKI转移与增强顺铂敏感性
孙慧霞,郭 哲,许 静
(南阳市中心医院 妇产科,河南 南阳 473000)
宫颈癌(cervical cancer,CC)是最常见的一种妇科恶性肿瘤,其发病率和病死率均在所有妇科恶性肿瘤中排第2位[1]。虽然,近10年来宫颈癌的预防和治疗策略迅速发展,但晚期和复发性宫颈癌患者的预后仍然较差,1年生存率仅为10%~20%[2]。CC的生物学和临床行为受多种转录因子的控制[3],因此,探索转录因子的作用,有助于理解宫颈癌的发病和进展机制以及推动新型治疗策略的发现。
HOX是同源盒超家族的高度保守亚群,其表达异常和恶性肿瘤有关[4]。HOXB7在包含宫颈癌在内的多种肿瘤细胞中的表达水平被上调[5-7]。然而,HOXB7在宫颈癌表达上调的具体作用仍不清楚。化疗已广泛应用于CC的临床治疗。其中,顺铂是临床上常用的治疗CC的化疗药物。大多数CC早期患者通过顺铂化疗可获得良好的治疗效果,而在CC患者的长期化疗过程中,顺铂易产生化疗获得性耐药[8]。而涉及顺铂耐药的分子机制仍不清楚。HOXB7参与调节口腔癌和乳腺癌等肿瘤细胞的顺铂耐药性[9-10]。因此,本研究首先检测化疗敏感和化疗耐药的宫颈癌组织以及宫颈癌顺铂耐药CASKI/DDP细胞中HOXB7的表达;然后通过转染的方式,构建沉默HOXB7的宫颈癌细胞,以研究沉默HOXB7对宫颈癌细胞的迁移、侵袭能力以及顺铂敏感性的影响。
1 材料与方法
1.1 材料
1.1.1 组织样本:收集接受子宫切除术、盆腔和淋巴结清扫术后的宫颈癌患者的宫颈癌组织(癌灶组织)和匹配的癌旁组织(距侵润边缘2.5 cm),并根据郑州大学附属南阳市中心医院病理科检测情况,从中筛选出20例宫颈癌化疗敏感组织和20例宫颈癌化疗耐药组织。将每例半个组织样品快速冷冻在液氮中用于后续蛋白质萃取;另一半立即用10%缓冲甲醛固定和石蜡包埋,用于后续免疫组化检测。本研究经郑州大学附属南阳市中心医院医学伦理委员会批准(文号:20170612013),患者对于研究的目的及用途均知情同意。
1.1.2 细胞:人宫颈癌细胞系CASKI和宫颈癌顺铂耐药细胞系CASKI/DDP(上海宾穗生物科技有限公司)。
1.1.3 试剂及试剂盒:免疫组化试剂盒(北京中山金桥生物技术有限公司);抗胎牛血清(fetal bovine serum,FBS)、Dulbecco’s改良培养基(Dulbecco’s modified eagle medium,DMEM)、sh-Con和sh-HOXB7(Qiagen公司);Lipofectamine 2000(Invitrogen公司);CCK-8试剂(Dojindo公司);Annexin V-FITC/PI凋亡检测试剂盒(南京凯基生物科技有限公司);HOXB7抗体(Genetex公司和Novus公司);抗β-actin抗体(Proteintech Group公司);Alexa Fluor 488标记的IgG(H + L)抗体(Jackson Immuno Research公司);RIPA裂解液、HRP标记的IgG抗体和ECL试剂盒(江苏碧云天生物研究所)。
1.2 方法
1.2.1 细胞的培养和转染:分别将CASKI细胞和CASKI/DDP细胞接种于含有10% FBS的DMEM中,在37 ℃、5% CO2下培养。根据制造商说明书,用30 nmol/L的阴性对照sh-Con或sh-HOXB7经Lipofectamine 2000转染至CASKI细胞。
1.2.2 免疫组化检测组织中HOXB7表达:用免疫组化法检测宫颈癌化疗敏感组织和化疗耐药组织中HOXB7表达。组织切片依次经过脱蜡、灭活、抗原修复、封闭、HOXB7(1∶50稀释)孵育、生物素标记二抗(1∶100稀释)孵育和辣根过氧化物酶标记的链霉素卵白素(1∶100稀释)孵育结束后,DAB显色10 min,苏木精染核5 min。封片后,在CKX53显微镜(Olympus公司)下观察组织中HOXB7表达。
1.2.3 Western blot检测组织和细胞中HOXB7表达:用RIPA裂解液萃取宫颈癌化疗耐药组织、宫颈癌化疗敏感组织、CASKI细胞、CASKI/DDP细胞,以及已转染sh-Con或sh-HOXB7的CASKI细胞的蛋白质。每样品取30 μg总蛋白质在10% SDS-PAGE上分离,并转移到聚偏二氟乙烯膜上。用HOXB7抗体(1∶1 000)在4 ℃下孵育过夜,PBST洗膜3次后,用HRP标记的IgG抗体(1∶1 000稀释)再室温下孵育1 h。用抗β-actin抗体(1∶1 000稀释)用作内部对照,用ECL化学发光法曝光于胶片后,用Image J软件统计HOXB7的相对表达水平。
1.2.4 免疫荧光检测细胞中HOXB7的表达:将已转染sh-Con或sh-HOXB7的CASKI细胞接种12孔板中并培养24 h后,用4%多聚甲醛溶液固定15 min,0.3% Triton X-100透化1 min。用抗HOXB7抗体(1∶100稀释)在4 ℃下孵育过夜,PBST洗细胞3次后,用Alexa Fluor 488标记的IgG(H+L)抗体(1∶2 000稀释)在黑暗湿润的盒子孵育50 min,用DAPI复染5 min后,用Leica DFC 450荧光显微镜(Leica Microsystems公司)捕获图像。
1.2.5 Transwell测定细胞迁移和侵袭:BD BioCoat入侵时和对照插入物用于测定转染细胞的迁移和侵袭能力。腔室包含具有8 μm孔的聚对苯二甲酸乙二醇酯膜。将已转染sh-Con或sh-HOXB7的CASKI细胞,重新接种于含1% FBS培养基的小室内,1.0×105个/室,将小室置于含有高血清(20% FBS)培养基的24孔板中,置于37 ℃、5% CO2下孵育24 h后,洗涤膜并用结晶紫染色5 min。在CKX53显微镜下观察迁移或侵入的细胞,并计数。
1.2.6 CCK-8法检测细胞活性:将已转染sh-Con或sh-HOXB7的CASKI细胞,以5×103个/孔的密度接种在96孔板中,分别加入0、15、30、45和60 μmol/L顺铂孵育24 h后,向每个孔中加入10 μL CCK-8试剂,室温反应2 h。用680酶标仪(Bio-Rad公司)在450 nm波长下读取每个孔的吸光度(A)。
1.2.7 流式检测细胞凋亡:用15 μmol/L顺铂分别处理已转染sh-Con或sh-HOXB7的CASKI细胞24 h后,用PBS洗涤细胞2次后,收集细胞。根据Annexin V-FITC/PI凋亡检测试剂盒说明书步骤,加入500 μL 1×缓冲液重悬细胞1次,再分别加入5 μL annexinV和PI染液在37 ℃下黑暗中孵育20 min。通过流式细胞仪检测细胞凋亡,并利用Win MDI 2.9软件分析细胞凋亡率。
1.3 统计学分析
2 结果
2.1 HOXB7在宫颈癌化疗敏感和化疗耐药组织中的表达
癌旁组织中HOXB7表达呈阴性,宫颈癌化疗敏感组织中HOXB7呈散在弱阳性表达,宫颈癌化疗耐药组织中HOXB7呈弥漫强阳性表达(图1A);相对于对宫颈癌化疗敏感组织,宫颈癌化疗耐药组织中HOXB7表达明显增加(P<0.001)(图1B)。
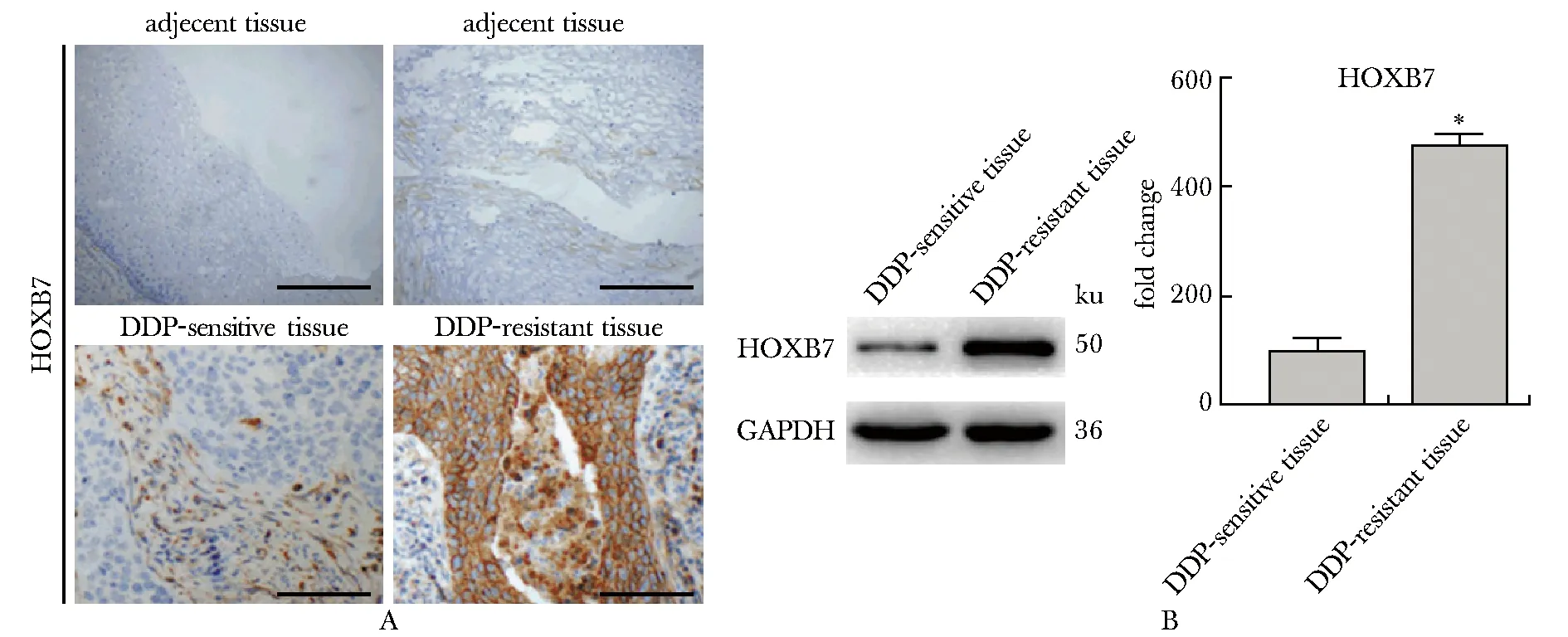
2.2 HOXB7在CASKI和CASKI/DDP细胞中的表达
HOXB7在CASKI/DDP细胞中表达明显高于CASKI细胞(P<0.001)(图2)。
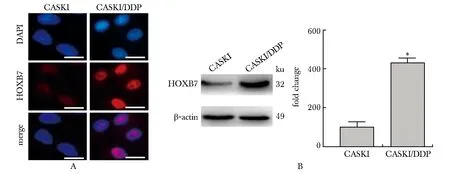
2.3 沉默HOXB7对CASKI细胞的迁移和侵袭能力的影响
相对于sh-Con组,sh-HOXB7组中HOXB7蛋白水平明显降低(P<0.001)(图3A,B),证明沉默HOXB7的CASKI细胞系构建成功。且相对于sh-Con组,sh-HOXB7组细胞的迁移能力和侵袭能力均明显降低(P<0.001)(图3C,D)。
A.immumohistochemical staining (scale bar=200 μm); B.Western blot; *P<0.001 compared with chemotherapy sensitive tissues
A.immunofluorescence assay (scale bar=10 μm); B.Western blot; *P<0.001 compared with CASKI cells图2 HOXB7在CASKI和CASKI/DDP细胞中表达情况Fig 2 Expression of HOXB7 in CASKI and CASKI/DDP n=4)
A.after transfected with sh-Con or sh-HOXB7, the expression of HOXB7 was detected by immunofluorescence (scale bar=10 μm); B.Western blot; C.representative images of invasion assay (left) (scale bar=100 μm) and statistics graph of invasion assay(right); D.representative images of migration assay (left) (scale bar=100 μm) and statistics graph of migration assay(right);*P<0.001 compared with sh⁃Con group
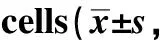
2.4 沉默HOXB7对CASKI细胞的顺铂敏感性的影响
相对于sh-Con组,sh-HOXB7转染均促进15、30、45和60 μmol/L顺铂诱导的细胞活性下降(P<0.001)(图4A),且促进15 μmol/L顺铂诱导的细胞凋亡(P<0.001)(图4B)。
3 讨论
肿瘤转移是导致肿瘤患者治疗失败的主要原因之一。因此,抑制肿瘤细胞迁移与侵袭是治疗肿瘤的可行办法。HOXB7过表达能促进胶质瘤、淋巴瘤、肝癌等肿瘤细胞的迁移和侵袭能力,抑制HOXB7表达后上述肿瘤细胞的迁移和侵袭能力降低[11-13]。HOXB7对宫颈癌细胞的作用尚不清楚。本研究将sh-HOXB7转染到CASKI细胞,发现,沉默HOXB7的CASKI细胞的迁移及侵袭能力均明显下降。以上结果提示,沉默HOXB7能抑制宫颈癌细胞的转移。
顺铂是治疗宫颈癌的有效化疗药物之一[14]。而在宫颈癌患者中发现了获得性耐药,尤其在患有转移性、复发性和晚期的患者中[8,15]。化疗耐药是宫颈癌患者化疗失败乃至死亡的直接原因。而增强宫颈癌细胞对顺铂的敏感性有助于增加宫颈癌的化疗效果。HOXB7高表达与食管鳞状细胞癌顺铂耐药及化疗疗效差有关[16]。本研究结果显示,HOXB7在化疗敏感和耐药的宫颈癌组织中均有表达,且耐药组织中HOXB7表达高于敏感组织;同样,在顺铂耐药宫颈癌CASKI/DDP细胞中HOXB7表达高于CASKI细胞。这一研究结果提示,HOXB7高表达与宫颈癌顺铂耐药性相关。在食管鳞状细胞癌 KYSE150和KYSE450 细胞中敲减HOXB7表达能通过下调Ku70、Ku80和DNA-PKcs表达,从而达到增强细胞对顺铂敏感性[16]。本研究结果显示,沉默HOXB7后,CASKI细胞对顺铂敏感性增强。
总之,沉默HOXB7抑制CASKI细胞迁移和侵袭能力,同时促进细胞对顺铂的敏感性,而其中的作用机制有待进一步探究。
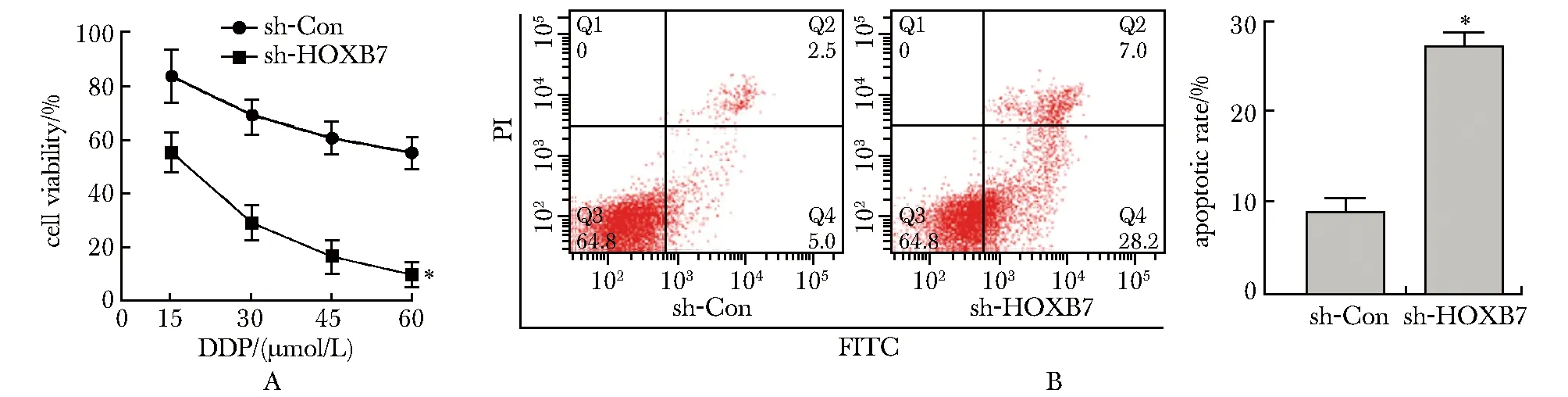
A.the cell viability of CASKI cells was measured by CCK-8 assay; B.the apoptosis was detected by Annexin V-FITC/PI staining;*P<0.001 compared with sh⁃Con group