tDCS预刺激增强脑卒中认知功能障碍患者认知康复疗效的临床研究
余果,孙倩倩,肖阳,张慧田,何晓阔,2
脑卒中后认知功能障碍(post-stroke cognitive impairment, PSCI) 是脑卒中患者的常见症状和后遗症。我国流行病学研究显示,PSCI 的平均发病率为55.9%,其中约1/3 会发展为卒中后痴呆。PSCI 使患者不能有效地进行有意识的学习及运动训练,严重影响其运动功能的恢复、自我照顾及社区活动的参与,从而导致患者生存质量低下,给社会和家庭带来巨大的负担[1-2]。
研究表明,增强可塑性的康复治疗可以改善PSCI 患者的记忆能力[3]。经颅直流电刺激(transcranial direct current stimulation,tDCS)作为一种非侵入性脑部刺激技术,能够通过微弱电流增强或抑制皮层兴奋性,调节大脑皮质可塑性[4]。有研究表明,给予tDCS 预刺激可以提高皮层兴奋性,增强可塑性,从而改善认知功能[5]。此外,目前对认知障碍的评定主要依靠各种评定量表,其评定结果主观性强缺乏客观的评定数据,从而影响并降低了认知障碍疗效评定的可信度,不利于脑卒中患者认知障碍的神经生理机制的探索。本研究拟结合P300 事件相关电位研究tDCS预刺激联合常规认知康复训练对脑卒中患者认知功能康复的疗效,为tDCS 在改善脑卒中患者认知功能方面的临床应用提供证据支持。
1 资料和方法
1.1 一般资料 选取十堰市太和医院2017年7月1日~2018年10月31日期间符合纳入标准的PSCI 患者76 例,纳入标准:符合脑卒中诊断治疗指南标准[6];年龄在40~75 岁;病情稳定,格拉斯哥昏迷量表评分为15 分;蒙特利尔认知评估量表评分<26 分,存在认知功能障碍,且认知功能障碍发生在脑卒中之后,并排除其他病因;发病时间在2 周~6 个月内;文化程度为小学及以上;患者本人签署或由其直系亲属代签知情同意书。排除标准:存在严重视力障碍、听力障碍、精神障碍等影响认知检查者;发病前有明显智力减退、痴呆病史;生命体征不稳定,合并严重的心脏疾病,肝、肾功能衰竭,恶性肿瘤,消化道出血等疾病影响认知评定的患者;存在严重的半侧空间忽略症患者;存在完全性失语、或其他失语症如感觉性失语,不能配合治疗与检测的患者;患者不愿意配合的。使用随机数字表法将76 例患者分为观察组和对照组各38例,入选患者全部为右利手,2 组患者一般资料比较差异无统计学意义,见表1。
1.2 方法 2 组患者均进行常规药物治疗及康复训练:药物治疗包括神经内科常规用药,控制血压、改善脑循环及改善认知功能(盐酸多奈哌齐口服,一次5mg~10mg,每晚睡前服用);常规康复训练包括物理因子疗法(根据患者病情需要,选用神经肌肉电刺激疗法、肌电生物反馈等)、运动疗法(关节活动训练、肌力训练、平衡训练、站立训练、步行训练等)、作业疗法(衣、食、住、行等日常生活基础动作等训练)、针灸、康复工程(包括各种矫形器的选择、使用等)。观察组先给予tDCS 治疗,再进行认知训练;对照组先进行认知训练,再给予tDCS 治疗。①tDCS 治疗:采用四川省智能电子实业有限公司研制的IS300 型双通路经颅直流电刺激仪,具体方法如下[7]:刺激电极采用5cm×7cm 等渗盐水明胶海绵电极,阳极置于左侧前额叶背外侧皮层区,阴极置于对侧眶上缘,刺激强度1mA,20 min/次,1 次/d,每周5 次,持续4 周。②认知训练:由治疗师利用日常生活用品根据患者的认知情况,从定向、视知觉、空间知觉、动作运用、视运动组织、思维动作等方面进行训练。每次治疗时间为30min,1 次/d,每周5 次,共训练4 周。
1.3 评定标准 治疗前后对2 组患者进行以下评定:①蒙特利尔认知评估量表(montreal cognitive assessment, MoCA):包括视空间执行能力、命名、记忆、注意、语言流畅、抽象思维、延迟记忆、定向力8 个方面的认知评估,限制在10 min 内完成,共计30 分,校正受教育程度的偏倚后得分26 分及以上为正常。②改良Barthel 指数(modified Barthel index, MBI)[9]:满分100分,分数越高,日常生活活动能力越好。③听觉相关电位P300 潜伏期、波幅的变化:事件相关电位P300 是神经中枢在感受信息刺激过程中产生的生物电活动,可以早期反映患者对概念性的知识,如言语抽象、概括、理解能力、语义记忆、长时记忆等方面的认知功能。一般将其作为研究某些疾病早期认知功能损害的指标之一,其敏感性和客观性较好[8]。我们使用的是听觉刺激序列(oddball paradigm, OB):通过耳机同步给高调、低调纯音,低概率音作为靶刺激,诱发P300。通常靶刺激概率为10%~30%,非靶概率70%~90%,刺激间隔多采用1.5~2s,刺激持续时间通常为40~80ms,反应方式为靶信号出现按键反应,同时可根据按键反应正确率判断患者注意力。P300潜伏期越长、波幅越低表示对外界刺激的辨认度越差,认知功能障碍程度越深。
1.4 统计学方法 应用SPSS 21.0 统计软件进行分析,计量资料以±s表示,组内均数比较采用配对样本t 检验,组间均数比较采用单因素方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 治疗前后MoCA 及MBI 评分比较 治疗前,2组MoCA 及MBI 评分比较差异无统计学意义。治疗4 周后,2 组较治疗前的MoCA 及MBI 评均明显提高(均P<0.05),且观察组2 项评分均高于对照组(均P<0.05),见表2。

表1 2 组患者一般资料比较
表2 2 组治疗前后MoCA 及MBI 评分比较 分,±s
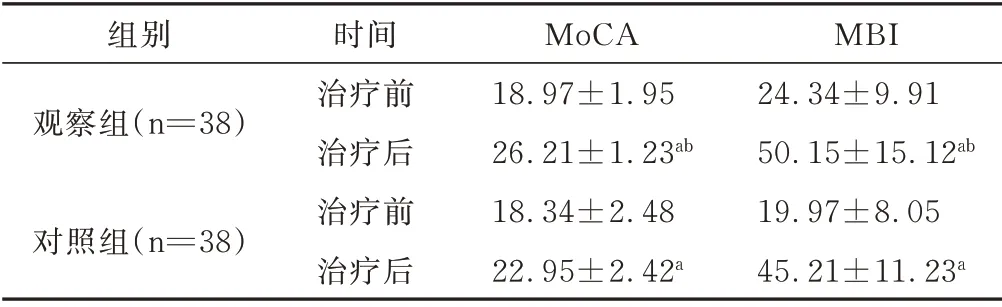
表2 2 组治疗前后MoCA 及MBI 评分比较 分,±s
与治疗前比较,aP<0.05;与对照组比较,bP<0.05
组别观察组(n=38)对照组(n=38)MBI 24.34±9.91 50.15±15.12ab 19.97±8.05 45.21±11.23a时间治疗前治疗后治疗前治疗后MoCA 18.97±1.95 26.21±1.23ab 18.34±2.48 22.95±2.42a
2.2 治疗前后P300 潜伏期、波幅的比较 治疗前,2组P300 潜伏期及波幅比较差异无统计学意义。治疗4 周后,2 组较治疗前的P300 潜伏期均明显缩短(均P<0.05),波幅均明显增加(均P<0.05),且观察组2项指标均更优于对照组(均P<0.05),见表3。
表3 2 组患者治疗前后P300 潜伏期、波幅的比较±s
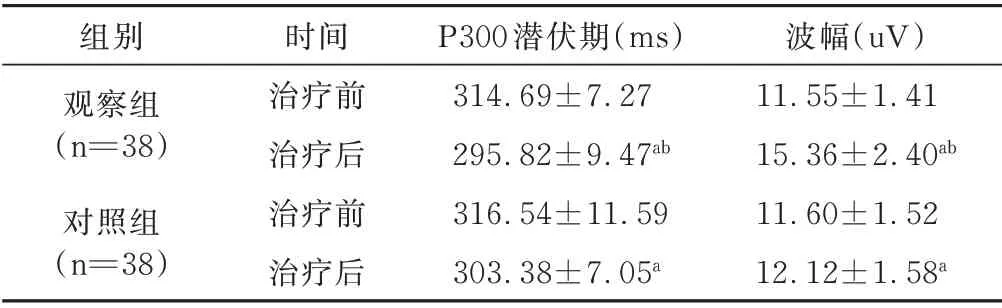
表3 2 组患者治疗前后P300 潜伏期、波幅的比较±s
与治疗前比较,aP<0.05;与对照组比较,bP<0.05
组别观察组(n=38)对照组(n=38)波幅(uV)11.55±1.41 15.36±2.40ab 11.60±1.52 12.12±1.58a时间治疗前治疗后治疗前治疗后P300 潜伏期(ms)314.69±7.27 295.82±9.47ab 316.54±11.59 303.38±7.05a
3 讨论
PSCI 患者存在注意力分散或集中范围下降,记忆力、空间结构、执行功能障碍及行为情绪和人格的变化等各种功能异常。目前针对脑卒中后认知障碍的诊断和评价方法主要是依靠临床检查结合相关神经心理学测试。近几十年来已发展了一系列标准化认知障碍评定量表:如简易精神状态评定量表[10],洛文斯顿作业疗法认知评定成套测验[11],以及Nasreddine等[12]设计的MoCA 量表在临床上较常用。目前针对认知障碍的评定常根据临床或研究目的采用上述不同的量表或量表组合,主观性太强,缺乏客观的神经电生理学及影像学检查作为评估工具,这影响并降低了认知障碍疗效评定的可信度。
事件相关电位是一种特殊的脑诱发电位,反映了认知过程中大脑的神经电生理的变化,其中研究、应用最广泛的就是P300 电位,与多层次的复杂认知活动密切相关。P300 潜伏期代表大脑应对刺激时神经传导的速度,P300 波幅反映的是大脑在进行信息加工过程中脑区的激活程度[13-14]。Dejanovic 等[15]研究发现脑梗死灶出现,P300 潜伏期增加、波幅降低,同时P300潜伏期可作为卒中后认知功能恢复的客观指标。韩晶等[16]将MMSE 评分、MoCA 量表与P300 电位联合应用发现可以较好评价卒中患者的认知功能障碍程度,P300 可先于MoCA 量表检测出患者认知功能的改变。
tDCS 作为一种康复治疗技术用于改善PSCI,仍需要大样本的临床随机对照研究来证明其有效性[17];宋为群团队研究认为tDCS 对各脑区的调节作用尚不完全一致[1],可能与皮层兴奋性、突触可塑性的改变相关,但需要在同一任务下比较不同刺激参数对结果的影响,从而确定不同障碍的治疗方法。
为更客观地观察tDCS 预刺激联合认知训练方案与先给予认知训练后进行tDCS 刺激方案对PSCI 患者认知功能的影响,并探索脑卒中患者认知障碍的神经生理机制,本研究创造性的将MoCA 评估量表与P300 事件相关电位相结合,通过神经心理学量表及客观电生理指标联合检测,结果显示治疗4 周后,tDCS预刺激组患者MoCA 评分、事件相关电位P300 潜伏期、波幅、MBI 评分均较治疗前明显改善且优于对照组,提示tDCS 预刺激后给予认知训练方案能有效降低P300 潜伏期,提高患者对靶刺激的反应速度;此外还可以在一定程度上提高患者的日常生活活动能力,且效果优于先认知训练后tDCS 刺激方案。
脑卒中后中枢神经系统具有可塑性,认知功能训练是提高神经兴奋性,促进受损区域功能重建,构建新的神经环路,对中枢神经突触进行重塑的过程[18]。依据神经网络模型突触可塑性理论,可塑性的诱导阈值并不是不变的,前一行为导致神经系统兴奋性的变化会对后一个行为的效应产生增强或抑制。随着神经网络的功能状态发生变化,这种突触可塑性的阈值发生动态变化的现象被称为再可塑性[19]。可塑性在突触上的表现主要是长时程增强(long term potentiaon,LTP)和长时程抑制(long term depression, LTD),外界干预导致突触传递LTP/LTD 样改变[20]。
再可塑性调节可以一定程度增加神经细胞的兴奋性,使神经突触处于一种更易发生改变的状态之中,从而更易获得学习能力。当中枢神经进入到这种再可塑性调节所产生的兴奋状态之后,患者在学习随后到的任务时具有优势,说明再可塑性对后续学习能力的调节作用可以持续存在[21]。有充分的证据表明,tDCS 最少能在在短时间内(<1h)在中枢神经引起类似的LTP/LTD 样可塑性的变化,一般认为tDCS 阳极刺激可以增强中枢神经细胞的兴奋性,降低可塑性的阈值,可以增强后续学习训练进行神经突触重塑的效果[22]。研究发现tDCS 通过刺激背外侧可以提高患者的工作记忆[23],Jo 等[24]也证明了tDCS 刺激左前额叶背外侧皮层与工作记忆表现增强相关。这可能与tDCS 可以通过刺激大脑皮质神经功能,激活潜在的神经通路的机制有关,兴奋或抑制局部神经元并与其他部位脑组织发生联系,有利于再学习能力的改善,从而提高认知功能[25]。
tDCS 作为安全、无创式治疗手段,更容易被患者接受,具有良好的应用前景。但还需进一步研究检查联合使用下的长期影响;此外,tDCS 对于各脑区的作用机制尚不一致,不同刺激强度、时间、频率作用仍有争议,需进一步研究以确定不同障碍的治疗方法。

