缺血再灌注模型大鼠脑白质扩散张量成像研究
张嘉泳,李乐,金婷婷,张宇豪,何肖君,林华伟,李钻芳,梁胜祥,柳维林,陶静
脑卒中是一种发病率、致残率高的急性脑血管病[1],脑卒中患者常伴随不同程度的功能障碍,严重影响人类健康和生活质量[2]。研究发现脑卒中后神经功能障碍与其脑白质病变密切有关,大脑缺血缺氧引起白质纤维束受损,脑网络结构完整性破坏[3]。有文献报道[4-5],大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)大鼠损伤后大脑白质纤维损伤,髓鞘脱失,轴突损伤,神经功能障碍。然而,缺血性脑卒中在不同时期的缺血特点和病理生理复杂多样,脑白质病变的机制还有待进一步明确。弥散张量成像(diffusiontensorimaging,DTI)是一种无创性白质纤维束成像的磁共振成像(magnetic resonance imaging,MRI)技术,通过分析组织中水分子的弥散运动,可以反映大脑白质的微结构改变[6]。当发生细胞完整性破坏、神经纤维变形等白质结构病理改变,其水分子扩散状态显示异常[7]。因此DTI 对于观察脑梗死后白质纤维形态结构的影响有重要意义。本研究利用DTI 成像技术观察缺血再灌注模型大鼠脑白质扩散张量的变化规律,为临床诊断、预后评价提供影像学基础。
1 资料与方法
1.1 一般资料 清洁级Sprague-Dawley 大鼠(雄性,体质量230±20g)24 只,购于上海斯莱克实验动物有限责任公司(SCXK(沪)2012-0002)。动物饲养在福建中医药大学实验动物中心SPF 级动物实验室,光照时间为12h 昼夜周期,给予自由饮水和饲料。当体质量达(260±20)g 时即可进行实验。按照随机数字表法,24 只雄性大鼠随机分为假手术组和模型组各12 只。所有的实验严格按照实验动物伦理规章,经福建中医药大学动物实验管理委员会批准。
1.2 方法 术前2 组大鼠均禁食24h,模型组参照改良版Koizumi 方法制备大脑中动脉缺血再灌注模型[8],使用1%戊巴比妥钠腹腔注射麻醉后,大鼠俯卧位置于手术台,从颈正中线切开,分离浅筋膜和皮下肌肉,暴露左侧颈总动脉、颈外动脉和颈内动脉。颈外动脉远端用缝合线结扎,颈总动脉和颈内动脉使用微型血管夹夹闭。在颈外动脉近端剪一小切口,并用线栓经切口从颈外动脉进入颈内动脉。2h 后,将线栓拔出至颈总动脉分叉处,实现再灌注。假手术组大鼠仅进行术前麻醉和分离血管,不结扎和导入线栓,随即缝合,清洁创口。术中大鼠直肠温度维持在36.5℃~37.5℃,术后置于保温箱中,直到从麻醉中苏醒。
1.3 评定标准 在缺血再灌注后24h、7d 和14d 分别对2 组大鼠进行测定,①采用改良神经功能缺损程度评 分 (modified Neurological Severity Scores,mNSS)[9]:由运动,感觉,平衡和反射测试这4 部分组成,总分18 分,分数越高神经功能损害越严重。②磁共振扫描:采用德国布鲁克公司7.0T 小动物磁共振仪进行磁共振成像,将动物麻醉后置于扫描架上,选用大鼠头颅线圈成像。分别进行T2 加权成像(T2-weighted image,T2WI)及DTI 检查。扫描参数如下:T2WI 具体扫描参数如下:重复时间4200ms,回波时间35ms,层厚1mm,层数21,FOV=32mm×32mm,矩阵为256×256。DTI 成像采用平面回波序列,具体扫描参数如下:b 值=1000s/mm2,重复时间12000 ms,回波时间32.248ms,层厚0.56mm,层数48,FOV=32mm×32mm,矩阵大小为128×128。DTI 图像应用FSL 和spmratIHEP 软件进行分析[10-11],具体步骤如下:a.对所有数据进行涡流矫正,消除涡流效应的影响;b.手动颅骨剥离得到全脑掩膜图像,并计算各动物的b0 图像和全脑平均弥散率(meandiffusion,MD)和各向异性分数(fractionanisotropy,FA)图像;c.将b0 像配准到大鼠标准脑模板,并保留变换函数,用于对应动物的相关脑区MD、FA 图像,实现MD、FA 图像向大鼠标准脑模板的空间标准化;d.对标准化后的MD、FA 图像做高斯平滑处理,平滑核为体素的3 倍大小;e.基于一般线性模型,采用方差分析,分别对平滑后的MD、FA 图像进行统计分析,认为P<0.05(FDR 校正),团簇>10,具有统计学意义。将DTI 数据传入DiffusionToolkit 工作站,各选取左右侧大脑的胼胝体、海马、杏仁核、纹状体、运动皮层和感觉皮层作为感兴趣区域(regionsofinterest,ROI),分别测量ROI 的MD 值和FA 值。MD 值增加表示水分子弥散增高,FA 值取值在0~1,FA 值增加表示白质纤维连接增强。
1.4 统计学方法 采用SPSS 20.0 统计软件处理,计量资料以±s表示,神经功能评分采用重复设计方差检验,相关脑区MD 值和FA 值不同时间点的比较采用单因素方差分析,当方差齐,组间两两比较采用LSD 检验,方差不齐时采用Dunnett's T3 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 缺血再灌注后不同时间点mNSS 评分比较 假手术组大鼠未出现神经功能缺失症状;模型组较假手术组大鼠缺血再灌注后24h、7d 和14d 的mNSS 评分均升高(均P<0.01),且缺血再灌注后7d 的mNSS 评分低于上一时间点(P<0.05),见表1。
2.2 不同时间点脑梗死体积 模型组缺血再灌注后,T2 加权成像相关脑组织呈高信号并显示为灰白色,其相应部位为梗死病灶区域,随时间推移高信号区域面积减少,见图1a~c。
表1 缺血再灌注后不同时间点mNSS 评分 分,±s

表1 缺血再灌注后不同时间点mNSS 评分 分,±s
注:与假手术组比较,aP<0.01;与缺血再灌注后24h 比较,bP<0.05,Mauchly 球形度检验P 值=0.511,时间效应Greenhouse-Geisser P<0.05,说明评分有随时间变化的趋势;时间×组别效应Greenhouse-Geisser P<0.05,说明时间因素随分组的不同而不同。
缺血再灌注后14d 0 7.92±2.19a组别n假手术组模型组12 12缺血再灌注后24h 0 10.75±1.86a缺血再灌注后7d 0 8.92±1.68ab
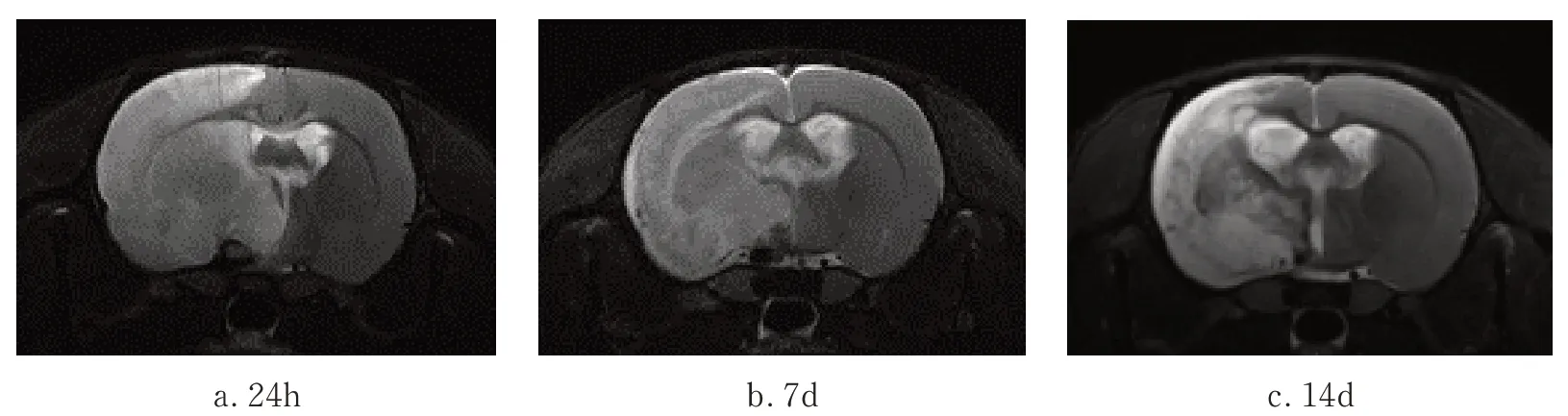
图1 a~c 缺血再灌注后不同时间点的T2WI 成像
2.3 2 组大鼠健患侧脑区MD 值和FA 值 缺血后24h,模型组较假手术组患侧所有脑区MD 值均显著下降(P<0.01,0.05),7d 后呈假正常化,与假手术组相比无统计学意义,14d 均高于假手术组(P<0.01,0.05);缺血后24h,患侧胼胝体、海马及纹状体的FA值均显著下降(均P<0.05),7d 时均持续下降(P<0.01,0.05),除了胼胝体,其他脑区在14d 达到最低水平(P<0.01,0.05)。缺血后24h,除了感觉皮层,健侧脑区MD 值均高于假手术组(P<0.01,0.05),缺血后7d,除了胼胝体和海马,其他脑区MD 值均低于假手术组(P<0.01,0.05),缺血后14d 与假手术组比较差异无统计学意义。缺血后24h,除了感觉皮层,其他脑区FA 值均高于假手术组(P<0.01,0.05),缺血后7d及14d 与假手术组比较差异无统计学意义。见图2a~c,3a~c 和表2,3,4,5。

图2 a~c 缺血再灌注后不同时间点的MD 图

图3 a~c 缺血再灌注后不同时间点的FA 图
表2 2 组大鼠患侧脑区MD 值比较 ‰,±s

表2 2 组大鼠患侧脑区MD 值比较 ‰,±s
与假手术组比较,aP<0.01,bP<0.05
模型组脑区假手术组胼胝体海马杏仁核纹状体运动皮层感觉皮层缺血再灌注后14d 1.07±0.24a 1.01±0.07a 0.91±0.23a 1.11±0.26b 1.14±0.09b 1.13±0.30a 0.80±0.06 0.84±0.08 0.53±0.03 0.77±0.04 1.03±0.08 0.86±0.14缺血再灌注后24h 0.63±0.13b 0.73±0.11b 0.45±0.10b 0.59±0.10a 0.71±0.12a 0.57±0.14a缺血再灌注后7d 0.93±0.18 0.91±0.14 0.68±0.17 0.83±0.12 0.97±0.10 0.85±0.02
表3 2 组大鼠健侧脑区MD 值比较 ‰,±s

表3 2 组大鼠健侧脑区MD 值比较 ‰,±s
与假手术组比较,aP<0.01,bP<0.05
模型组脑区假手术组胼胝体海马杏仁核纹状体运动皮层感觉皮层缺血再灌注后14d 0.83±0.05 0.98±0.06 0.56±0.04 0.77±0.04 0.99±0.10 0.77±0.04 0.80±0.06 0.91±0.06 0.53±0.05 0.78±0.05 1.06±0.09 0.83±0.11缺血再灌注后24h 0.93±0.12b 1.04±0.13b 0.62±0.08b 0.84±0.07b 0.80±0.10a 0.76±0.04缺血再灌注后7d 0.85±0.15 0.94±0.14 0.47±0.07a 0.73±0.05b 0.90±0.16b 0.71±0.05b
表4 2 组大鼠患侧脑区FA 值比较±s
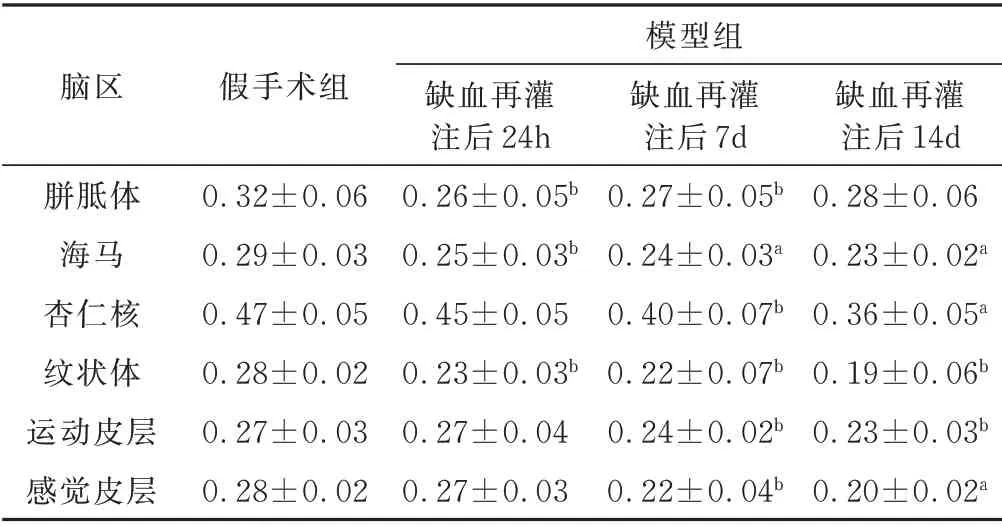
表4 2 组大鼠患侧脑区FA 值比较±s
与假手术组比较,aP<0.01,bP<0.05
模型组脑区假手术组胼胝体海马杏仁核纹状体运动皮层感觉皮层缺血再灌注后14d 0.28±0.06 0.23±0.02a 0.36±0.05a 0.19±0.06b 0.23±0.03b 0.20±0.02a 0.32±0.06 0.29±0.03 0.47±0.05 0.28±0.02 0.27±0.03 0.28±0.02缺血再灌注后24h 0.26±0.05b 0.25±0.03b 0.45±0.05 0.23±0.03b 0.27±0.04 0.27±0.03缺血再灌注后7d 0.27±0.05b 0.24±0.03a 0.40±0.07b 0.22±0.07b 0.24±0.02b 0.22±0.04b
表5 2 组大鼠健脑区FA 值比较±s

表5 2 组大鼠健脑区FA 值比较±s
与假手术组比较,aP<0.01,bP<0.05
模型组脑区假手术组胼胝体海马杏仁核纹状体运动皮层感觉皮层缺血再灌注后14d 0.35±0.03 0.28±0.02 0.47±0.05 0.30±0.02 0.25±0.04 0.24±0.02 0.35±0.05 0.29±0.04 0.48±0.07 0.30±0.01 0.26±0.05 0.25±0.02缺血再灌注后24h 0.39±0.03b 0.31±0.03b 0.53±0.03b 0.34±0.02a 0.33±0.05a 0.27±0.04缺血再灌注后7d 0.34±0.03 0.27±0.03 0.48±0.04 0.30±0.02 0.26±0.04 0.24±0.03
3 讨论
大脑缺血缺氧使脑组织内细胞水肿坏死[12]。有研究表明,在脑卒中的急性期和亚急性期,由于细胞毒性水肿和血管源性水肿[13],神经元死亡,白质结构小梁破坏,弥漫性脱髓鞘[14]。白质死亡可导致髓鞘损失,轴突损伤,纤维完整性破坏,并最终表现为脑卒中患者的神经缺损症状[15]。
DTI 成像可以直观反映缺血性脑卒中患者白质纤维束的损伤程度,这对于大脑神经功能的损伤情况及预后评估具有重要的指导意义[16]。MD 和FA 是DTI 的常用参数,MD 是测量水分子的弥散运动的限制性,能够反映细胞膜的完整性。FA 值能够反映白质纤维是否完整,FA 值的降低提示白质同质性的紊乱[17]。
本研究发现,大脑缺血后损伤侧MD 值最初是明显下降,然后升高呈假正常化,最后比正常高;而FA值在缺血后24h、7d 和14d 均下降的。这与之前研究的结果相似[18]。在急性期,由于细胞毒性水肿导致水分子扩散受限,MD 值减少[19];随着血脑屏障的破坏,血源性水肿导致水分子沿垂直于髓鞘方向的扩散限制增加[20],FA 值下降。当水肿高峰期过去,水肿被吸收并渐渐消退,MD 值出现假正常化。在慢性期,液化坏死的脑组织被吞噬清除,毛细血管增多,神经纤维修复再生,水分子弥散增高,MD 值也随之升高;但因为大脑结构破坏不可逆损伤,胶质瘢痕形成,脑组织的完整性破坏[21],因此FA 值不可恢复性降低。关于急性期时FA 值的变化不同研究有不同结果[22],产生这样的差异可能与缺血的严重程度和损伤范围有关。由此可推测脑缺血后DTI 的变化规律为:①在急性期,FA 值升高,MD 值下降;②在亚急性期,FA 值下降,MD 升高;③在慢性期,FA 值持续性降低,MD 值比正常高。这提示DTI 能够表征脑缺血阶段以及分辨不同阶段脑白质损伤程度。
另外,DTI 结果还显示损伤对侧出现异常信号。健侧缺血后24h MD 值升高,缺血后7d MD 值减少,14d 后恢复正常;健侧缺血后24h FA 值升高,随后恢复正常,这提示除了缺血侧白质功能发生改变,健侧白质功能也受到了影响。关于急性脑缺血后损伤大脑对侧DTI 结果与白质功能的机制研究较少。有文献报道,脑缺血后对侧丘脑及缺血镜像区各向异性增强,并随着功能恢复下降,可能与半球间抑制作用减弱和健侧大脑功能结构重塑相关[23-24]。研究认为,两侧大脑半球存在交互性半球间抑制,正常情况下两者处在兴奋和抑制的动态平衡状态。当患侧发生缺血损伤,抑制健侧的能力就会下降,从而健侧半球的兴奋性升高。随着患侧恢复,其对健侧的抑制作用增强,健侧的兴奋作用减弱[25]。
脑缺血后,白质完整性受损,神经网络结构破坏,不仅梗死灶区域的神经功能发生障碍,与梗死灶有神经网络连接的相邻部位和远隔区域也会受到影响[26]。本研究发现,大脑损伤后大部分白质存在持续性的损害,包括缺血侧胼胝体、海马额叶、杏仁核、纹状体、运动皮层、感觉皮层。值得注意的是,本研究还发现缺血对侧海马、胼胝体、纹状体、杏仁核、运动皮层相关脑区也发生代偿性改变。海马、胼胝体和杏仁核是参与边缘系统神经环路的重要组成部分,它们在情感和记忆的形成、修饰和维持中发挥重要的作用[27]。有研究表明[28-30],脑卒中患者除了缺血灶局部白质发生损伤,其他远隔区域如海马、丘脑、杏仁核等白质结构完整性降低,这可能是因为缺血灶神经纤维发生沃勒变性,从而导致远隔区域发生白质功能损伤,使相关学习记忆和认知功能下降。感觉和运动皮层与纹状体神经环路参与感觉运动功能的调控[31]。团队前期研究发现[32],MCAO 大鼠损伤侧运动皮层区和纹状体区FA 值减少,运动皮层-纹状体神经纤维传导束减少,大鼠运动功能评分降低。胼胝体作为连接大脑两侧半球最大白质联合,对于半球间信息传递和功能协调整合有重要意义。最近的研究表明[33],脑卒中后胼胝体纤维的恢复能使半球间兴奋抑制平衡重建,促进受损大脑白质功能重组。
本研究通过DTI 成像技术纵向追踪观察缺血再灌注模型大鼠脑白质损伤的变化特点,结果提示DTI能够反映不同时期脑白质损伤的特点,患侧白质随着时间的推移演变为不可转逆的结构破坏,健侧白质代偿变化可能与交互性半球间抑制作用有关。关于利用DTI 分析脑缺血后相关神经环路纤维的损伤特点还有待进一步研究。

