在高中化学教学中培养学生的建模思维
张建华
(福建省莆田第八中学,福建莆田 351144)
引 言
构建主义者认为,学习不是学习者简单接受知识的过程,而是由学习者自己建构知识的过程[1]。“建模”就是通过“建立模型”的思想学习知识、解决问题的方法。化学学习中有很多复杂而抽象的问题,如果能够很好地建立起相应的知识模型,问题就会变得简单化、条理化、可视化,从而被人们认识。建模的一般过程是:对研究的问题进行抽象化、建立相对应的模型,利用模型解决具体的问题。本文对化学教学中培养学生的建模思维进行初步探讨。
一、在物质的量教学中建立数学模型
高一学生对“物质的量”这个词比较陌生,难以理解,常与物质的质量混为一谈,不知道其本质就是一种衡量微观粒子数量的物理量,不知与微观粒子数目建立起联系。所以,笔者在教学中先通过学生熟悉的单位换算板书提出问题:①1打鸡蛋=12只,2 打鸡蛋=只,a打鸡蛋=只?②再并列板书提出1摩尔原子=6.02×1023个,2摩尔原子=个,a摩尔原子=个。学生通过换算能很快得出:①2 打鸡蛋= 24只,a 打鸡蛋=只。②2摩尔原子= 2×6.02×1023个,a摩尔原子个,从而抽象出物质的量(n)、阿伏伽德罗常数(NA)及微粒数(N)之间的数学表达式:N=n×NA、n=N/NA、NA=N/n。教学物质的量与质量的关系时,教师应先让学生举出熟悉的路程、速度和时间的数学表达式,然后给出摩尔质量的定义:1mol 铁的质量为56g,铁的摩尔质量为56g·mol-1,2mol 铁的质量是,a mol 铁的质量是,5.6g 铁的物质的量是,再次提出物质的质量(m)、物质的量(n)和摩尔质量之间存在关系。学生最终得出m=n·M、n=m/M、M=m/n的数学表达式模型。接下来,举出实例,运用模型解答问题。
例1 下列说法正确的是( )。
A.2 molN2的质量是28 g
B.N2的摩尔质量是28 g
C.1 molH2O的质量是18g
D.3.01×1023个NH3分子的质量是8.5g
解析:根据公式建模,可得:
2 mol N2的质量是28 g·mol-1×2 mol = 56 g,A项不正确;
N2的摩尔质量是28 g·mol-1,B项不正确;
1 molH2O的质量是18 g·mol-1×1 mol =18 g,C项不正确;
3.01×1023个NH3分子是0.5mol,NH3质量是17g·mol-1× 0.5mol=8.5 g,所以D项正确。
教学心得:学生学习与物质的量有关的理论和概念时,除了要从概念本意来理解外,还要培养学生建立数学表达式模型的能力。如此学生就能熟练运用各种数学表达式在各物理量之间熟练换算,为其今后的化学计算打下坚实的基础。学生的认知正如建构主义者认为的:每个学习者以自己原有的知识经验为基础,对新信息进行重新认识和整合,建构自己的知识模型。学生正是在认识路程、速度、时间关系的基础上,通过新的问题情境,构建了物质的量、摩尔质量、质量三者的关系,并加以应用。
二、在化学概念教学中建立概念模型
建模思维不仅体现在计算中建立数学模型,在化学概念教学中也能引导学生建立概念模型。如教学氧化还原反应时,帮助学生建立概念模型,这对学生理解概念有很大的益处。氧化还原反应是高中化学中的一个重点内容,概念多,如氧化剂、氧化性、被还原、还原反应、还原产物、还原剂、还原性、被氧化、氧化反应、氧化产物等,刚开始学习时,很多学生对这些概念都会混淆。实际教学中,笔者如此设计以帮助学生建立知识模型:(1)让学生写出已学过的一氧化碳还原氧化铜反应的化学方程式,并从得氧失氧的角度来指出还原剂和氧化剂。(2)让学生写出锌与盐酸反应的化学方程式,介绍锌与盐酸反应也是氧化还原反应,找出其中的氧化剂与还原剂。(3)引导学生从元素化合价变化的角度判断出氧化剂与还原剂。学生能够从两个不同的化学方程式中找到CO 中的碳元素化合价由+2价变为+4价,碳元素化合价在升高。Zn 与HCl 反应中的化合价也由0价升高为+2价,所以Zn 为还原剂。第一个化学方程式中,氧化铜中的铜元素化合价由+2价降为0价,在盐酸与锌反应中,氢元素的化合价由+1价降低为0价,因此,盐酸为还原剂。(4)讲解通过化合价降低得到的产物为还原产物,这两个化学反应中的产物分别为Cu 和H2;通过化合价升高得到的产物为氧化产物,分别为CO2和ZnCl2。这样就会让学生建立起用化合价变化判断氧化剂和还原剂、氧化产物和还原产物的模型。(5)再提出在氧化还原反应中为什么有些元素的化合价会改变?学生通过阅读课本,观察化学方程式,相互讨论和思考得出结论。原来,氧化还原反应中,元素的化合价升降是由电子失得引起的,氧化还原反应的本质是电子的转移,特征为化合价的变化。这样就帮助学生建立起氧化还原反应相关概念的模型,如图1所示,从而开展有效的学习活动。

图1 氧化还原反应相关概念的模型
通过建立这个模型,学生能够更容易掌握氧化还原反应中各概念的关系,就抓住氧化还原反应的两条脉络关系:
氧化剂→氧化性→得电子→化合价降低→被还原→还原反应→还原产物。还原剂→还原性→失电子→化合价升高→被氧化→氧化反应→氧化产物。
这样对于学生来说就比较容易掌握、理解和记忆,之后再让学生用三个词来总结,如氧得降、降得还、还失升或升失氧等,进行快速记忆。
例2 氢化钠(NaH)是一种生氢剂,可发生以下反应:NaH+H2O= NaOH+H2↑。对这一反应的描述,正确的是( )。
A.NaH是氧化剂 B.还原产物和氧化产物的质量比是1:1
C.NaOH是还原产物 D.生成1 mol H2转移2mol电子
解析:标出反应情况(如图2):
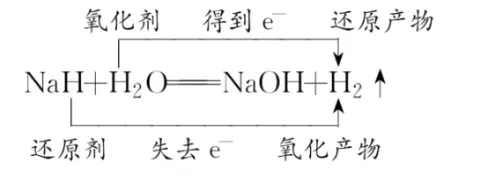
图2
由各反应物及生成物价态可知,NaH 中的氢由反应前的-1价升为反应后H2中的0价,化合价升高,被氧化,作为还原剂,相应生成物为氧化产物;H2O 中的一个氢由反应前的+1价变为反应后H2中的0价,化合价降低,被还原,作为氧化剂,相应生成物为还原产物。很明显,生成1 分子H2中有一个氢原子是失去1个电子来的,另一个氢原子是得到1个电子来的。所以,还原产物和氧化产物的质量比是1:1,生成1 molH2应转移1 mol 电子。答案是B。
三、在物质性质学习中培养学生的建模思维
在高中化学中,无机元素及化合物性质是重点内容。随着课程改革的不断深入,铝、硅等物质的学习学时被再次缩减。这就更加要求学生在学习物质性质时,要建立学习物质性质知识的模型。在单质化合物性质教学中,教师要让学生建立起一定的学习模型思维,如此对未知物质的探究,才更加有章可循。本文以金属钠的性质和应用教学为例进行分析。
[教师活动]通过前面的学习,大家知道结构决定性质。钠原子的核电荷数是11,请学生画出钠的原子结构示意图。
[建立模型]掌握物质性质学习的一般规律:结构决定性质。
[实验1]用滤纸吸干钠表面的煤油,放在玻璃片上,再用小刀切去钠块一端的表皮,观察露出的金属钠的表面色泽;暴露在空气中,观察其表面颜色的变化。
[归纳]引导学生根据现象归纳出钠的物理性质及保存方法。
(1)钠的物理性质:银白色、金属光泽、质软的固体;有延展性、易导热、导电。(2)钠的保存:密封保存在煤油中。(3)在空气中的变化:银白色光泽很快变暗。钠在常温时与空气中的氧气反应生成氧化钠:4Na + O2==2Na2O(白色固体)
[观看视频]钠与氯气、硫的反应实验。
[实验2]将一小块金属钠放在石棉网上,用酒精灯加热石棉网,观察火焰颜色以及产物的颜色、状态。
[学生回答]看到钠燃烧起来,火焰呈黄色,产物为淡黄色粉末。
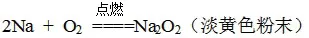
[建立模型]金属钠可与活泼非金属反应,且反应中表现强还原性,在不同条件下反应可能不同。
[实验3]将一小块金属钠投入滴有酚酞试剂的水中,观察现象,引导学生归纳:钠浮在水面上,熔成光亮的小球,到处窜动,发出嘶嘶的响声,最后消失,溶液变成红色。
[学生活动]思考并讨论,得出结论:钠的密度比水小,熔点低,反应快并放热,有气体和碱性物质生成:2Na + 2H2O === 2NaOH + H2↑。
[建立模型]活泼金属不仅能与酸发生反应,特别活泼的还可能与水发生反应置换出氢气,在反应中表现强还原性。
[实验4]向一只盛有CuSO4溶液的大烧杯中加入一小块金属钠,观察实验现象。
[学生交流讨论]与钠和水的反应现象相同,还能看到蓝色沉淀的产生,没有红色金属的生成:2Na + 2H2O === 2NaOH + H2↑; 2NaOH + CuSO4=== Cu(OH)2↓ + Na2SO4。
[教师活动]介绍工业制金属钛的方法:
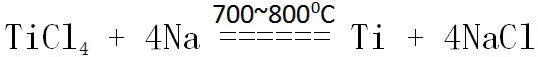
[建立模型]将钠加入带盐的水溶液,首先和水反应,生成的氢氧化钠再可能与盐反应。所以钠不能从带盐的水溶液中置换出比它不活泼的金属。如果要用钠置换出其他金属,要在熔融状态下才可以。
通过学习钠的性质,引导学生通过实验、推理、讨论、分析的方法,归纳出物质能与金属单质、非金属单质、酸、碱、盐、氧化物等类物质发生化学反应,表现出氧化性或还原性,分析它的稳定性,从而建立无机元素化合物学习模型,这对以后研究其他物质的性质有一定的启发和借鉴意义。
结 语
高中化学教学中培养学生的建模思想,建立适当的模型用来表征问题、解决问题,使学生掌握学习规律,对培养学生的化学核心素养,起到不可忽视作用。当然,在教学中要培养学生的建模思维,教师应从实际出发,根据学生的实际水平,充分利用和开发现有资源,遵循思维发展的规律,以学生发展为本,将化学学科知识和思维方法有机整合,让“教”与“学”有机地结合起来,使课堂教学更高效、更和谐。

