马尔堡病毒GP蛋白C肽的抑制活性及作用机理研究
陈文文,郑文铝,余硕,花晨,戴秋云
1.军事医学研究院 生物工程研究所,北京 100071;2.复旦大学 基础医学院,上海 200433
马尔堡病毒(Marburg virus,MARV)属丝状病毒属,为单股负链非节段RNA 病毒,在电镜下呈细丝状,为烈性传染病马尔堡出血热的病原体。自1967 年发现以来,在非洲多地曾多次暴发,累计出现460 多个感染病例,已造成380 多人死亡,病死率超过80%[1-2],最近的一次马尔堡出血热疫情发生在2017 年的乌干达,导致3 人死亡[3]。马尔堡病毒基因组约19 kb,由7 个独立的开放读框(ORF)组成,共编码7 个蛋白[4-5],分别为核衣壳蛋白(nucleocapsid protein,NP)、包膜糖蛋白(glyco⁃protein,GP)、基质蛋白(matrix protein)VP40,以及非结构蛋白VP24、VP30、VP35 和病毒聚合酶L(polymerase L),其中GP 是介导病毒进入宿主细胞的关键蛋白,也是疫苗及中和抗体的抗原或靶标[6-10]。一般认为,GP 亚单位GP1 负责细胞附着,GP2 催化 膜融 合[4]。 GP2 包 含 2 个 七肽重 复区,N端和C 端(分别为NHR 和CHR)在融合过程中采用六螺旋束结构,这种结构为病毒和细胞膜融合提供了热力学驱动力[11]。MARV 与埃博拉病毒(EBOV)同属丝状病毒,且二者的GP2 具有60%的序列同源性,总体结构相似,病毒进入机制可能类似[11-13]。目前,已发现来自 EBOV 的 CHR 的 C 肽具有较好的进入抑制活性,如GP610、1-chol、Tat-Ebo[14-17],但 MARV 的 CHR 的 C 肽抑制活性未见报道,作用机制也不清楚。我们合成了来自MARV的CHR 区域的C 肽MP 及突变体,利用pVAX1-MGP 与pNL-4.3-Luc-R-E-质粒包装假病毒体系,测定各肽对假病毒融合的抑制活性;利用圆二色谱、凝胶色谱分析C 肽及其突变体对MARV 的N肽的相互作用,发现MARV 的C 肽与N 肽相互作用较弱,导致C 肽的抗病毒活性较弱,但C 肽改造后可提高活性。
1 材料和方法
1.1 材料
BHK21-WI2、293T 细胞,pVAX1-MGP 质粒由本实验室保存;pNL-4.3-Luc-R-E-质粒由中国医学科学院病原生物学研究所种辉辉老师馈赠;Li⁃pofectAMINE 2000 购 自 Invitrogen 公 司 ;96 孔细 胞培养板、DMEM、胎牛血清购自Thermo Fisher Sci⁃entific 公司;细胞裂解液、萤光素酶报告试剂盒购自Promega 公司;Rink 树脂购自天津南开公司;1-羟基苯并三唑(HOBT)、苯并三氮唑-四甲基脲六氟磷酸盐(HBTU)、Fmoc 保护氨基酸等购自上海吉尔生化有限公司;哌啶、二甲基甲酰胺(DMF)、二氯甲烷、无水甲醇、无水乙醚等购自国药集团;三氟乙酸(TFA)、二异丙基二乙胺(DIEA)等购自北京伊诺凯有限公司。
多肽固相合成仪(德国Zinsser analytic 公司);旋转蒸发仪(日本Eyela 公司);冻干机(德国Christ 公司);安捷伦1200 型高效液相色谱仪(美国 Agilent Technologies 公司);Waters 1525 高效液相色谱仪(美国Waters 公司);多功能酶标仪(美国 PE 公司);microTOF QII 质谱仪(德国 Bruker 公司);Chirascan plus 圆二色光谱仪(英国Applied Photophysics Ltd 公司)。
1.2 多肽合成
C 肽(MP)来 源 于 MARV GP 的 CHR 区 域(611~637 残基),MP-1 为 MP 的 N 端增加一个亮氨酸的C 肽突变体,以增加疏水相互作用;MP-2~MP-5 分别为 MP-1 的 b、f、c、g 位增加电荷相互作用氨基酸,以稳定分子的α螺旋结构,同时增加C 肽与 N 肽作用的电荷相互作用;MP-6~MP-9 分别为MP 突变体N 端增加来自抗HIV 融合多肽的部分螺旋链(WEEILKK、WMEWDRE)[18]的突变体;MP-10 的 MT 也来自抗 HIV 融 合 多 肽[19-20],期望增加与N 肽的相互作用。
MGP 的N 肽(MGP-N)粗品由中科亚光公司合成,其余多肽采用本实验室的Zinsser analytic多肽合成仪合成[21-22]。合成的0.06 mol 肽-树脂用裂解液(TFA∶DTT∶H2O∶TIS=4.4 mL∶0.25 g∶0.25 mL∶0.1 mL)裂解,室温搅拌 3 h 脱去保护基,旋转蒸发除去大部分TFA,加入提前冷却的无水乙醚,4℃静置半小时,抽滤得粗肽。粗肽经HPLC 纯化,纯化柱为 Kromasil-C18 柱(100 Å,10 μm,10 mm×250 mm),0.1%三氟乙酸的水及乙腈梯度洗脱,冻干得纯肽干粉。纯化后的多肽经分析型HPLC 分析[色谱柱为Agilent Eclipse Plus C18(5 μm,4.6 mm×250 mm)。梯度:0~1 min,5% ~10% B;1~25 min,10% ~50% B。 A 为 含0.1% TFA 的水,B 为含 0.1% TFA 的乙腈,流速 1 mL/min,波长214 nm],最后用质谱仪测定多肽的相对分子质量。
1.3 假病毒的制备
参考实验室之前研究的马尔堡假病毒包装策略[23],转染前1 h 用Opti-DMEM 培养基处理细胞,pVAX1-MGP 与 pNL4-3.Luc.R-E-质粒按 1∶2 的比例共转染293T 细胞,72 h 后收获上清,添加FBS 至20%,0.2 μm 滤膜过滤,-80℃冻存备用。
1.4 抑制剂活性测定
假病毒与不同浓度的抑制剂等体积混合,各50 μL/孔加入96 孔板中,阴性对照组加入等体积的H2O,37℃孵育30 min 备用。胰酶消化BHK21-WI2 细胞,用含2% FBS 的培养基重悬细胞至2×105/mL,向孵育后的96 孔板中每孔加入50 μL 细胞稀释液,48 h 后裂解细胞,检测相对发光值RLU,计算假病毒抑制率,用GraphPad-Prism 5 软件计算各抑制剂的半数抑制浓度(IC50)值。
1.5 圆二色谱测定
用0.01 mol/L 的磷酸缓冲液(pH7.2)配制各多肽溶液及N 肽与各C 肽、突变体的混合物溶液(终浓度均为35 μmol/L)。圆二色谱在室温下测定,λ=190~260 nm,d=1 mm,空白对照为 0.01 mol/L 磷酸缓冲液,重复3 次取平均值并计算摩尔椭圆度。实验数据用Origin 软件进行绘图及处理,用下式计算各多肽的α螺旋含量[24-25]:
α螺旋含量=(-[θ]222-2340)/30300
1.6 凝胶色谱排阻法测定MGP-N与C肽及突变体的相互作用
MGP-N、C 肽及C 肽突变体分别用磷酸盐缓冲液(0.05 mol/L,pH7.2)稀释至 0.2 mmo/L,各取30 μL 上样,流速 0.8 mL/min,检测波长214 nm,色谱柱为 TSK-G2000SWxl 柱(日本 Tosoh Biosci⁃ence LLC 公司)。C 肽、突变体与 MGP-N 复合物的高压凝胶色谱条件同上,但等体积的MGP-N 与C 肽、突变体混合后,37℃水浴中孵育30 min 后上样(60 μL)。
2 结果
2.1 多肽的纯化及鉴定
各多肽(表1)纯度大于95%,部分多肽的HPLC 分析图及质谱检测结果见图1、2,相对分子质量测定结果与理论计算一致。
2.2 C肽及突变体的抑制活性
各抑制剂IC50见图3、表1。结果显示,MARV的GP 蛋白C 肽对MARV 有一定的抑制活性,但抑制活性较差(IC50=32.67 μmol/L),其突变体活性IC50=9.61~33.47 μmol/L,其中 MP-4 的活性最高。抑制剂 MP-8 浓度≥20 μmol/L 时,显著影响细胞正常生长,细胞毒性较高,未进行后续活性检测。

表1 MARV的C肽氨基酸序列及抑制活性
2.3 C肽、N肽及混合物的圆二色谱
典型多肽及混合肽圆二色谱结果见图4,α螺旋含量计算结果见表 2。除 MP-6~MP-8 外,C 肽及 N 肽本身的α 螺旋含量低(0.30%~6.85%)(表2),在N 端增加螺旋链后(MP-6~MP-8),α螺旋含量提高(33.66%~69.77%),显著高于其他C 肽。N肽与C 肽混合后形成了典型的α螺旋结构,MP、MP-1~MP-5 及 MP-9~MP-10 与 N 肽混合后α螺旋显著增加(16.23%~29.23%),但 MP-6~MP-8 与MGP-N 混合后α螺旋含量变化不大。

图1 部分多肽的HPLC 分析图
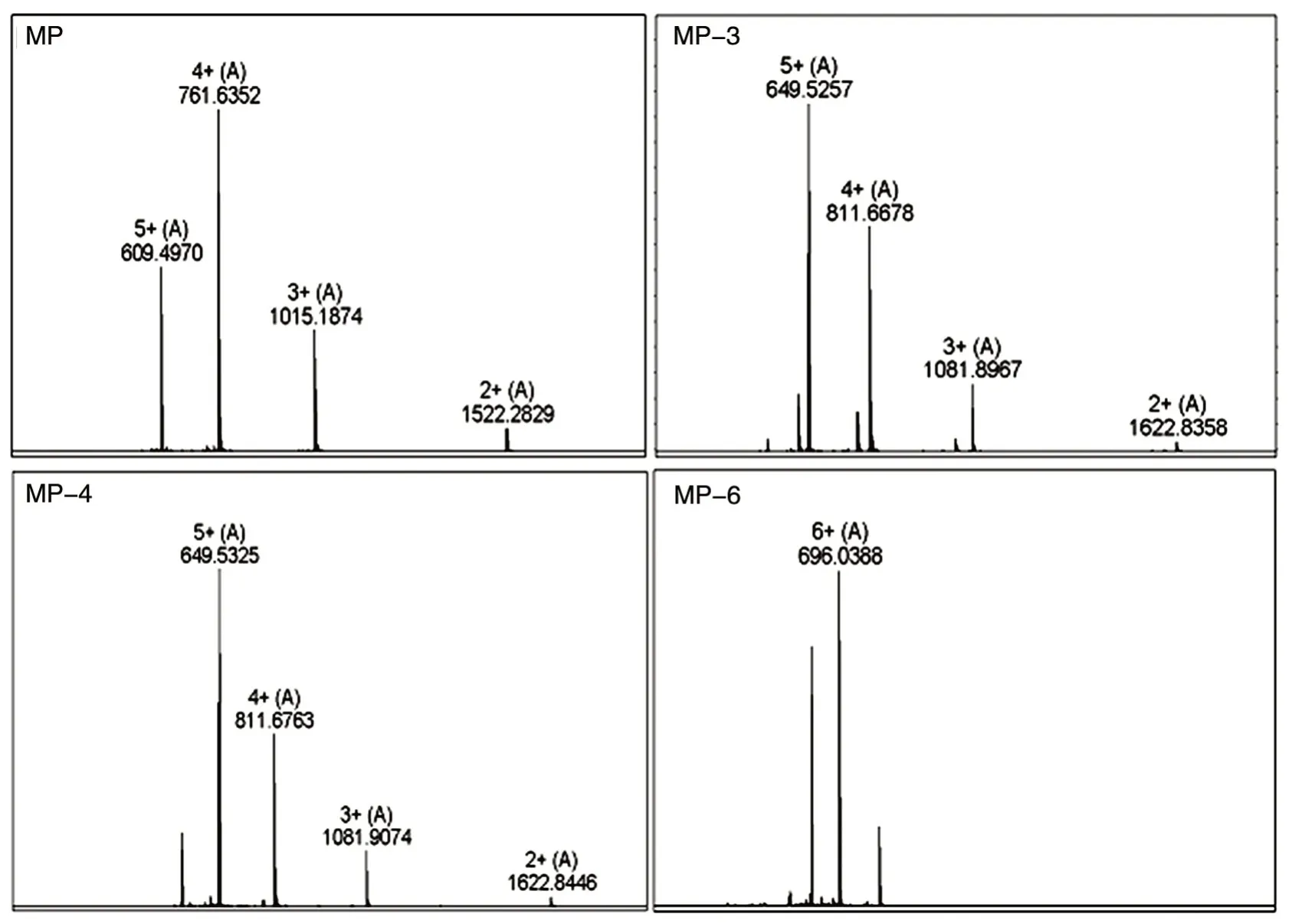
图2 部分多肽的质谱图

图3 部分多肽的IC50 结果

图4 N 肽、C 肽及其复合物的圆二色谱
2.4 N肽、C肽及混合物的凝胶排阻色谱
部分多肽及复合物的凝胶排阻色谱结果见图5。N 肽与MP-6、MP-7 的出峰时间明显早于其他肽,且N 肽峰高很低,显示上述多肽可能形成了聚合体。N 肽与 MP、MP-1~MP-4、MP-9~MP-10 复合物凝胶排阻色谱结果类似(图未列出),没有出现明显的多肽与MGP-N 复合物洗脱峰,但N肽与MP-5、MP-6 混合后出现了新的洗脱峰,说明有部分复合物的形成。
3 讨论
MP 的抑制活性较弱(IC50=32.67 μmol/L),通过增加 b、f、c、g 位的电荷相互作用可以提高 C 肽的活性,如 MP-4 的抑制活性(IC50=9.61 μmol/L)为MP、MP-1(IC50分别为32.67、33.47 μmol/L)的3倍多。然而,C 肽或复合物的α螺旋含量提高与活性的增加并无对应关系,如MP-6 的α螺旋含量较MP-4 有显著提高,但抑制活性(IC50=15.82 μmol/L)低于MP-4。

表2 多肽及混合物α螺旋含量
图5 多肽及其复合物凝胶排阻色谱
凝胶排阻色谱结果显示,MP-6 及MP-7 自身也发生了聚集,可能与其N 端引入的螺旋序列有关。MP-5、MP-6 与N 肽混合后形成的新峰并未最先出峰,说明其多聚体并不大。N 肽的自聚集作用且α螺旋率低,可能影响了其与C 肽形成六束α螺旋,导致C 肽的抗病毒活性较低。
此外,在抑制剂活性检测过程中,抑制剂浓度大于70 μmol/L 时,显著影响细胞正常生长,48 h 后检测,RLU 值远大于阳性对照组,可能是高浓度的抑制剂破坏了细胞膜的完整性,导致病毒更易进入细胞。
总之,马尔堡病毒包膜糖蛋白的C 肽抗病毒活性较弱,C 肽与N 肽相互作用较弱,C 肽改造后活性提高。本工作可为马尔堡病毒抑制剂的设计提供参考。

