SPD-TRAIL基因修饰间充质干细胞及其杀伤肺腺癌细胞的研究
米一,王立华,李欣,王皓,张晨亮,马静,苗丽,刘拥军,刘广洋
·论著·
SPD-TRAIL基因修饰间充质干细胞及其杀伤肺腺癌细胞的研究
米一,王立华,李欣,王皓,张晨亮,马静,苗丽,刘拥军,刘广洋
100176 北京贝来生物科技有限公司(米一、李欣、王皓、张晨亮、马静、苗丽、刘拥军、刘广洋);100176 北京市亦创生物技术产业研究院干细胞与再生医学研究所(米一、李欣、王皓、张晨亮、马静、苗丽、刘拥军、刘广洋);053600 石家庄,河北医科大学第二医院血液科(王立华)
通过基因工程手段构建了可高表达十二聚体 TRAIL的间充质干细胞(MSC),以期为临床应用以 MSC为载体的肿瘤靶向治疗提供新的实验方法。
通过基因工程手段改造 TRAIL 基因序列,在其 N-末端增加肺表面活性蛋白-D(SPD)结构域,使其形成稳定构象的十二聚体 TRAIL 蛋白,采用慢病毒载体基因转染间充质干细胞,得到可高表达 TRAIL 蛋白的 SPD-TRAIL-MSC 种子细胞。在此基础上对基因修饰细胞进行功能学检测。
基因修饰后 MSC 流式表型、分化能力均未有显著变化;SPD-TRAIL-MSC 及 TRAIL-MSC(对照组细胞)均可高表达 TRAIL 蛋白,而 SPD-TRAIL-MSC 表达的 TRAIL 蛋白显著高于对照组细胞(< 0.001);通过肿瘤杀伤实验发现,SPD-TRAIL-MSC 对肺癌细胞系 A549 具有更显著的增殖抑制(< 0.01)及促凋亡作用。
SPD-TRAIL 基因修饰的 MSC 可稳定高表达 TRAIL 蛋白,并对肺癌细胞系具有显著杀伤作用,为肺癌治疗提供了新的思路。
间充质干细胞; 肺腺癌; SPD-TRAIL; 基因修饰; 凋亡
恶性肿瘤作为一种严重危害人类健康的疾病,其发病率和致死率逐年升高,肺癌是全球最常见的恶性肿瘤之一,非小细胞肺癌约占肺癌的 80%[1],而肺腺癌又是最常见的组织学类型,约占全部肺癌患者的 1/2[2],其恶性程度高,大部分患者确诊时分期较晚,因此治疗原则上仍以全身化疗为主[3],大部分患者因不能耐受化疗的毒副作用而无法完成正常的化疗疗程,对于肿瘤控制及预后恢复极其不利[4]。干细胞作为向肿瘤转移的基因载体已被广泛研究。研究发现间充质干细胞(mesenchymal stem cells,MSCs)在炎性因子和趋化因子的作用下具有专门跟踪和迁移到体内肿瘤部位的特性,将间充质干细胞作为抗癌药物的靶向载体,携带外源性抑癌因子作用于肿瘤,是目前较为有效的新的治疗手段。
肿瘤坏死因子相关的凋亡诱导配体(TRAIL)可通过激活肿瘤细胞表面促凋亡死亡受体(DRs)4 和 5,诱导 Caspase-8 依赖性凋亡。TRAIL 可以选择性靶向肿瘤细胞,诱导癌细胞的凋亡,且对多数正常细胞表现无毒或低毒,具有较强的肿瘤细胞杀伤选择性,是极具潜力的新型抗肿瘤药物。研究证实,TRAIL 基因修饰的 MSC 注射至肺部转移癌动物模型体内后,TRAIL-MSC 细胞可以迁移至肿瘤组织中,并稳定持续释放 TRAIL,从而抑制肺部肿瘤细胞生长,促进肿瘤凋亡[5]。研究发现,TRAIL 蛋白单体分子具有高度的寡聚化倾向,天然状态下可形成分子量为 66 kD 的三聚体;而在 TRAIL 蛋白 N 末端增加肺表面活性蛋白-D(SPD)结构域,可使其形成稳定构象的十二聚体。十二聚体 TRAIL(dTRAIL)在肿瘤杀伤、稳定性方面明显优于 TRAIL 其他高级结构[6]。
本研究通过基因工程手段在体外构建了 TRAIL 和 SPD-TRAIL 基因,通过病毒载体转染间充质干细胞,使间充质干细胞分别高表达可溶性 TRAIL 及十二聚体 TRAIL,在此基础上验证其对肺腺癌细胞系的杀伤作用,以期为临床应用以 MSCs 为载体的肿瘤靶向治疗提供新的实验方法。
1 材料与方法
1.1 材料
人肺癌细胞 A549 购自中国医学科学院基础医学研究所;DMEM 高糖培养液、DMEM/F-12 培养液、胎牛血清、胰蛋白酶及成骨、成脂分化培养液等均购于美国 Thermo Fisher 公司;第四代慢病毒载体系统购自美国 Origene 公司;TRAIL 蛋白ELISA 检测试剂盒购于美国 R&D System 公司;CCK8 试剂盒及 Annexin V-FITC/PI 凋亡试剂盒购于日本东仁化学科技有限公司。
1.2 方法
1.2.1 脐带间充质干细胞获取及检测 人脐带组织来源于合作妇产科医院剖腹产出生的健康胎儿。选择健康供者脐带组织,将脐带组织剪至直径为1 ~ 1.5 mm 的小段,采用贴壁培养法获取原代脐带间充质干细胞(UC-MSCs)。待细胞融合度为 80% 后,对细胞进行蛋白酶消化和计数,并将细胞按1 × 104/cm2接种至新的培养瓶。按同样方法将细胞扩增至 P2代,冻存。
1.2.2 SPD-TRAIL 质粒构建及病毒转染间充质干细胞 按照文献[6]所述方法,设计并合成了 SPD-TRAIL基因质粒,利用第四代慢病毒载体系统构建 LV-SPD-TRAIL 慢病毒表达质粒,并以 LV-TRAIL作为对照病毒。
将 LV-SPD-TRAIL 质粒以及 LV-TRAIL 慢病毒表达质粒分别与慢病毒框架质粒混合,通过 LTX 脂质体导入 293T 细胞,包装得到成熟慢病毒,收获病毒。将收获的病毒转染至脐带间充质干细胞,24 h 后加入嘌呤霉素筛选加压,待加压结束后换新鲜完全培养液,继续培养至 80% 密度后传代扩增。
1.2.3 脐带间充质干细胞生物学功能检测 将转染后的细胞收获后,以正常脐带间充质干细胞(UC-MSC)作为对照,通过流式细胞术检测细胞表面抗原(CD73、CD90、CD105、CD34、CD45、CD11b、CD19 及 HLA-DR 等)。
将上述各组细胞接种至 96 孔板中,分别培养 0、24、48、72 及 96 h,采用 CCK8 试剂盒检测各组细胞增殖情况,各组细胞 6 个复孔。
将上述各组细胞接种至 24 孔板中,各组细胞待细胞密度达到 80% 融合度时分别加入成骨诱导培养液及成脂诱导培养液进行诱导,2 ~ 3 d 换一次诱导培养液。诱导培养 3 ~ 4 周后,成脂诱导的细胞采用油红-O 进行染色,成骨诱导的细胞采用茜素红-S 进行染色。
1.2.4 ELISA 检测基因修饰的间充质干细胞表达TRAIL 采用 TRAIL 蛋白 ELISA 检测试剂盒检测 UC-MSC、SPD-TRAIL-MSC 及 TRAIL-MSC 的细胞上清液中 TRAIL 的含量,具体方法参照说明书。
1.2.5 基因修饰的间充质干细胞对非小细胞肺癌A549 细胞的增殖抑制 SPD-TRAIL-MSC 及 TRAIL-MSC 培养上清液备用,将非小细胞肺癌 A549 细胞按照 5000/孔接种至 96 孔板,置于37 ℃ 5% CO2培养箱培养 12 h 后小心吸弃培养液。将培养液及稀释后的条件培养上清液加入 A549 细胞中,分组如下:200 μl完全培养液、200 μl UC-MSC 上清液、200 μl TRAIL-MSC 上清液、200 μl SPD-TRAIL-MSC 上清液,各培养 24、48、72 及 96 h,分别采用 CCK8 试剂盒检测肿瘤细胞增殖情况,各组细胞 6 个复孔。
1.2.6 基因修饰的间充质干细胞对非小细胞肺癌A549 细胞的凋亡情况 将 A549 细胞分为 4 组,分别按 2 × 105/孔接种至 6 孔板,置于 37 ℃ 5% CO2培养箱培养 12 h 后小心吸弃培养液。培养过程中 4 组细胞分别加入 2 ml 完全培养液、2 ml UC-MSC 上清液、2 ml TRAIL-MSC 上清液及 2 ml SPD-TRAIL-MSC 上清液,各培养 48 h 和 72 h,采用无 EDTA 胰酶消化、收集细胞,并采用 Annexin V-FITC/PI 流式细胞法检测肿瘤细胞凋亡情况,各组细胞重复 3 次。
1.3 统计学处理
2 结果
2.1 LV-TRAIL 病毒转染间充质干细胞
体外构建 LV-SPD-TRAIL、LV-TRAIL 等慢病毒表达载体,并分别转染间充质干细胞,采用嘌呤霉素筛选、加压后获得 SPD-TRAIL-MSC及 TRAIL-MSC。图 1 为 LV-SPD-TRAIL 和 LV-TRAIL 质粒结构图。其中 LV-SPD-TRAIL 结构为 tPA 作为启动子连接 SPD 序列,其后连接 hTRAIL 编码区;而 LV-TRAIL 结构为 tPA 作为启动子其后直接连接 hTRAIL 编码区。
2.2 基因修饰 MSC 生物学功能检测
采用流式细胞法检测 UC-MSC 及基因修饰后 MSC,结果如表 1 所示,各组细胞均符合 MSC 表型:CD19、CD34、CD11b、CD45 和 HLA-DR 均为阴性(阳性率 < 2%);CD73、CD90、CD105 均为阳性(阳性率 > 95%)。
采用成骨及成脂分化培养液对各组细胞进行分化诱导,结果(图 2)发现,成骨诱导培养 4 周后,各组细胞经茜素红-S 进行染色均为阳性;而成脂诱导 3 周后,各组细胞经油红-O 染色均为阳性。

图 1 TRAIL 及 SPD-TRAIL 慢病毒载体质粒结构图
Figure 1 Lentiviral vector plasmids structure of TRAIL and SPD-TRAIL
表 1 各组 MSC 流式细胞表型结果统计(%,)
图 2 基因修饰间充质干细胞成骨成脂分化结果(A:茜素红 S 染色,所示各组细胞均具有成骨分化结果;B:油红-O 染色结果,所示各组细胞均具有成脂分化结果)
Figure 2 Osteogenic and adipogenic differentiation results of MSCs from each group (A: Alizarin Red staining means osteogenic differentaiton result; B: Oil-O staining means adipogenic differentiation result)
采用 CCK8 检测各组 MSC 细胞的增殖能力,结果(图 3)发现,各组 MSC 之间的增殖能力无显著差异(> 0.05)。
2.3 TRAIL 表达水平检测
采用 TRAIL ELISA 检测试剂盒检测 SPD-TRAIL-MSC 及 TRAIL-MSC 上清液中TRAIL 的含量,结果发现:两种基因修饰 MSC 均可以高表达 TRAIL 蛋白,SPD-TRAIL-MSC 表达量显著高于 TRAIL-MSC(< 0.001)(图 4)。
2.4 TRAIL-MSC 对 A549 的增殖抑制作用
采用基因修饰间充质干细胞培养上清对非小细胞肺癌细胞系 A549 进行培养,通过 CCK8 检测细胞增殖情况。结果发现,SPD-TRAIL 及 TRAIL 基因修饰后间充质干细胞均显著抑制 A549 细胞增殖水平,而与 TRAIL-MSC 相比,SPD-TRAIL 基因修饰 MSC 对 A549 抑制效果更加显著(图 5)。

图 3 CCK8 检测各组细胞增殖(n = 6,*P > 0.05)
Figure 3 Cell proliferation of MSC with CCK8 assay (n = 6,*> 0.05)
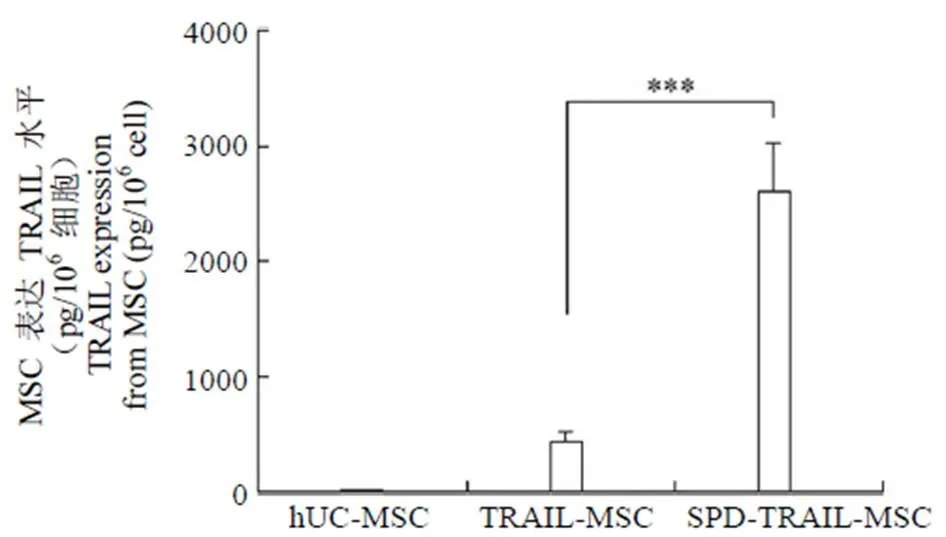
图 4 ELISA 检测基因修饰的间充质干细胞表达 TRAIL(pg/106细胞)[SPD-TRAIL-MSC 与 TRAIL-MSC 比较
(n = 6),***< 0.001]
Figure 4 TRAIL expression from each MSC group with ELISA assay (pg/106cell) [SPD-TRAIL-MSC vs TRAIL-MSC (n = 6),***< 0.001]

图 5 基因修饰的间充质干细胞对非小细胞肺癌 A549 细胞的抑制[SPD-TRAIL-MSC 与 TRAIL-MSC比较(n = 6),**P < 0.01]
Figure 5 TRAIL engineered MSC can inhibit the proliferation of A549 cells [SPD-TRAIL-MSC vs TRAIL-MSC (n = 6),**< 0.01]
2.5 TRAIL-MSC 对 A549 的杀伤作用
采用基因修饰间充质干细胞培养上清对非小细胞肺癌细胞系 A549 进行培养,通过 Annexin V-FITC/PI 凋亡试剂盒检测 A549 凋亡情况,结果发现,基因修饰后间充质干细胞可显著促进 A549细胞凋亡,而与对照组相比(TRAIL 基因修饰 MSC),SPD-TRAIL 基因修饰 MSC 对 A549 杀伤效果更加显著(表 2 及图 6)。
3 讨论
TRAIL 在不影响正常细胞的情况下导致肿瘤凋亡和死亡的能力使其成为一种非常令人兴奋的肿瘤治疗分子。TRAIL 蛋白的构型稳定性及聚集形式与其肿瘤杀伤活性、受体亲和性以及稳定性等有着密切的关系,当 TRAIL 在空间上形成十二聚体结构时,其抗肿瘤活性最佳而稳定性最高。研究发现,肺表面活性蛋白-D(surfactant protein-D,SPD)在分子结构上通过二硫键共价结合可形成三螺旋平行盘绕线圈结构域,从而帮助蛋白质折叠成十二聚体。本研究证明了 SPD-TRAIL 基因修饰的 MSC 及 TRAIL-MSC 均可以高表达 TRAIL 蛋白,SPD-TRAIL-MSC 表达量显著高于 TRAIL-MSC,对 A549 细胞抑制效果和促凋亡作用更加显著。
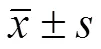
表 2 各组 MSC 对非小细胞肺癌 A549 细胞凋亡的影响流式结果(%, )
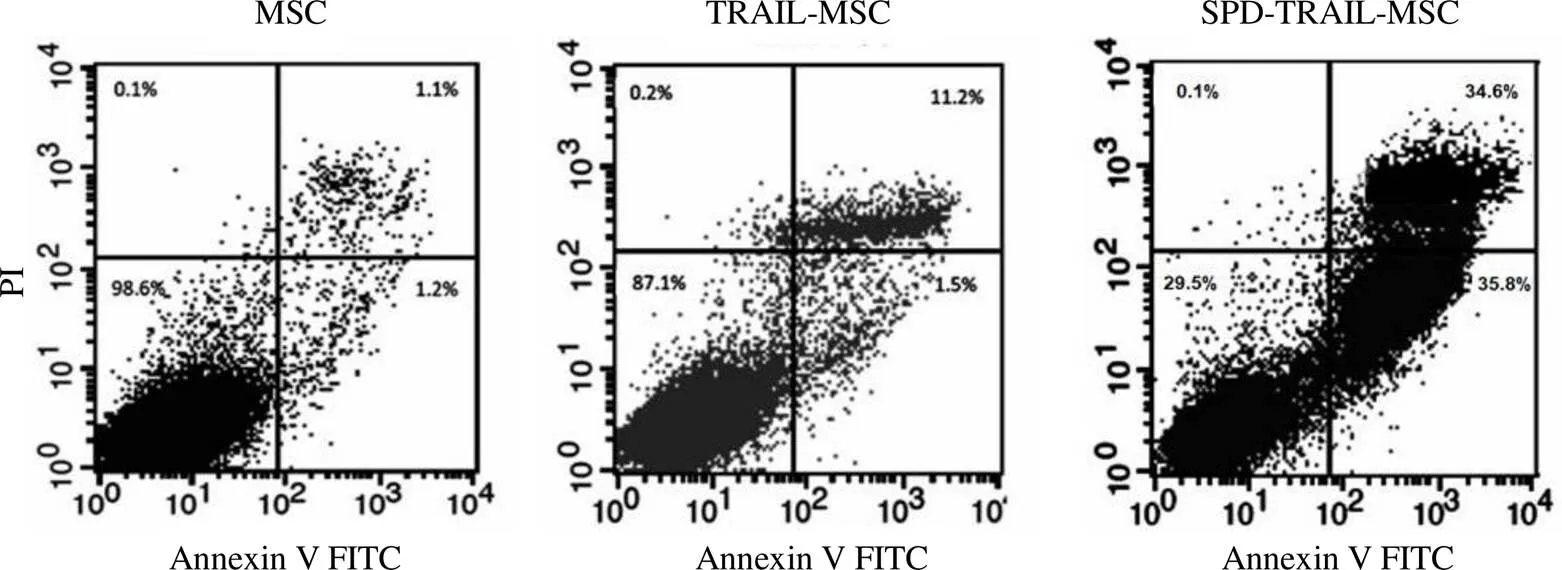
图 6 各组 MSC 对非小细胞肺癌 A549 细胞凋亡的影响代表性图片(n = 3)
Figure 6 Representative figures of MSC anti A549 cells (n = 3)
我们之所以把 MSC 作为基因传递载体,是因为 MSC 能够或至少优先归巢到肿瘤内,同时也因为 MSC 被广泛认为是免疫豁免的。从理论上讲,未来使用同种异体间充质干细胞的细胞治疗可以不预先使用免疫调节剂。并且,脐带源 MSC 比其他来源的 MSC 更加易于收获、培养和产业化。
间充质干细胞对疾病是否会产生直接的影响是很重要的。一些研究表明,MSCs 在一些动物模型中显示出内在的抗肿瘤特性,能够改善卡波西斯肉瘤[7]和皮下乳腺肿瘤[8]。人们提出了各种 MSC 抗肿瘤的机制,包括抑制 Akt[7],下调 NF-κB[9]和 Wnt 通路[8]。相反,间充质干细胞也被发现在某些模型中与肿瘤促进作用有关,包括促进结肠[10]和乳腺[11]皮下肿瘤模型的增长和转移。在肺腺癌的皮下肿瘤模型中,注射 MSC 后,没有看到肿瘤的增长,并且在肺腺癌转移模型中,间充质干细胞显示出了抗肿瘤作用[5]。本研究从细胞学水平证实了 TRAIL 基因修饰的 MSCs 能够抑制肺腺癌细胞增殖。SPD-TRAIL 基因修饰的 MSC 的 TRAIL 表达量更高,其对 A549 肺癌细胞的抑制效果和促凋亡作用也更加显著。
TRAIL 在体内具有肿瘤的免疫监测作用。注射抗 TRAIL 抗体或使用 TRAIL 敲除小鼠表明 TRAIL 缺陷的小鼠更易发生 TRAIL 敏感的肿瘤和转移[12-14]。研究表明,体内示踪的 TRAIL-MSC 可能替代了 NOD/SCID 小鼠缺陷的免疫监测系统缺陷,导致肿瘤细胞的破坏和预防转移的发生[5]。预防转移对于许多实体瘤的病人来说很重要,原发肿瘤可通过切除、化疗和放疗来治疗,但仍存在未来发生转移癌的风险。利用高灵敏度和特异性的分子及细胞学技术能够检测血液和骨髓中非常少量的循环肿瘤细胞[15-16],将来可能通过 TRAIL-MSC 靶向消除这些转移癌细胞。我们将进一步通过动物实验探究 SPD-TRAIL 基因修饰的 MSC 对肺腺癌的生长和转移作用。
[1] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012. CA Cancer J Clin, 2012, 62(1):10-29.
[2] Calvert H. An overview of folate metabolism: features relevant to the action and toxicities of antifolate anticancer agents. Semin Oncol, 1999, 26(2 Suppl 6):3-10.
[3] Galetta D, Cinieri S, Pisconti S, et al. Cisplatin/Pemet pnance bevacizumab in advanced nonsquamous lung cancer: The GOIM (Gruppo Oncologico Italia Meridionale) ERACLE phase III randomized trial. Clin Lung Cancer, 2015, 16(4):262-273.
[4] Damodar G, Gopinath S, Vijayakumar S, et al. Reasons for low quality of life in South Indian cancer patient population: a prospective observational study. Indian J Pharm Sci, 2014, 76(1):2-9.
[5] Loebinger MR, Eddaoudi A, Davies D, et al. Mesenchymal stem cell delivery of TRAIL can eliminate metastatic cancer. Cancer Res, 2009, 69(10):4134-4142.
[6] Kim SW, Kim SJ, Park SH, et al. Complete regression of metastatic renal cell carcinoma by multiple injections of engineered mesenchymal stem cells expressing dodecameric TRAIL and HSV-TK. Clin Cancer Res, 2013, 19(2):415-427.
[7] Khakoo AY, Pati S, Anderson SA, et al. Human mesenchymal stem cells exert potent antitumorigenic effects in a model of Kaposi's sarcoma. J Exp Med, 2006, 203(5):1235-1247.
[8] Qiao L, Xu ZL, Zhao TJ, et al. Dkk-1 secreted by mesenchymal stem cells inhibits growth of breast cancer cells via depression of Wnt signalling. Cancer Lett, 2008, 269(1):67-77.
[9] Qiao L, Zhao TJ, Wang FZ, et al. NF-kappaB downregulation may be involved the depression of tumor cell proliferation mediated by human mesenchymal stem cells. Acta Pharmacol Sin, 2008, 29(3):333-340.
[10] Zhu W, Xu W, Jiang R, et al. Mesenchymal stem cells derived from bone marrow favor tumor cell growth in vivo. Exp Mol Pathol, 2006, 80(3):267-274.
[11] Karnoub AE, Dash AB, Vo AP, et al. Mesenchymal stem cells within tumour stroma promote breast cancer metastasis. Nature, 2007, 449(7162):557-563.
[12] Takeda K, Smyth MJ, Cretney E, et al. Critical role for tumor necrosis factor-related apoptosis-inducing ligand in immune surveillance against tumor development. J Exp Med, 2002, 195(2):161-169.
[13] Cretney E, Takeda K, Yagita H, et al. Increased susceptibility to tumor initiation and metastasis in TNF-related apoptosis-inducing ligand-deficient mice. J Immunol, 2002, 168(3):1356-1361.
[14] Takeda K, Hayakawa Y, Smyth MJ, et al. Involvement of tumor necrosis factor-related apoptosis-inducing ligand in surveillance of tumor metastasis by liver natural killer cells. Nat Med, 2001, 7(1): 94-100.
[15] Riethdorf S, Wikman H, Pantel K. Review: Biological relevance of disseminated tumor cells in cancer patients. Int J Cancer, 2008, 123(9): 1991-2006.
[16] Lang JE, Hall CS, Singh B, et al. Significance of micrometastasis in bone marrow and blood of operable breast cancer patients: research tool or clinical application? Expert Rev Anticancer Ther, 2007, 7(10): 1463-1472.
Study of engineered mesenchymal stem cells with SPD-TRAIL gene and their killing effect on the lung adenocarcinoma cells
MI Yi, WANG Li-hua, LI Xin, WANG Hao, ZHANG Chen-liang, MA Jing, MIAO Li, LIU Yong-jun, LIU Guang-yang
Beijing Baylx Biotech Co., Ltd., Beijing 100176, China (MI Yi, LI Xin, WANG Hao, ZHANG Chen-liang, MA Jing, MIAO Li, LIU Yong-jun, LIU Guang-yang); Stem Cell Biology and Regenerative Medicine Institution, Yi-Chuang Institute of Bio-Industry, Beijing 100176, China (MI Yi, LI Xin, WANG Hao, ZHANG Chen-liang, MA Jing, MIAO Li, LIU Yong-jun, LIU Guang-yang); Department of Hematology, The Second Hospital of Hebei Medical University, Shijiazhuang 053600, China (WANG Li-hua)
To engineer mesenchymal stem cells (MSCs) to express dodecameric TRAIL and analyze the antitumor effect of dTRAIL-MSC.
TRAIL was genetic modified with SPD and then transfected into the mesenchymal stem cells. The characteristics of the cells were evaluated and we compared the antitumor effects of MSCs expressing SPD-TRAIL (SPD-TRAIL-MSCs) or TRAIL (TRAIL-MSCs) in A549 Lung adenocarcinoma cells.
The results showed that all UC-MSC groups, after TRAIL engineered or not, possessed the expression of the characteristic MSC surface marker and the ability of osteogenic and adipogenic differentiation. SPD-TRAIL-MSCs secreted more TRAIL protein than TRAIL-MSCs, and the SPD-TRAIL-MSCs exerted more significant inhibition of proliferation and induction of apoptosis in A549 cells.
SPD-TRAIL-modified MSCs can stably overexpress TRAIL protein and have a significant killing effect on lung cancer cell lines, providing new ideas for lung cancer treatment.
Mesenchymal stem cells; Lung adenocarcinoma; SPD-TRAIL; Gene engineering; Apoptosis
LIU Guang-yang, Email: Liugy04@163.com
刘广洋,Email:liugy04@163.com
10.3969/j.issn.1673-713X.2020.02.012
2019-10-31

