HPLC法测定吉西他滨肉豆蔻酸酯脂质体中主药的含量
罗芳,李岩,郭晓茹,汪阿鹏,夏桂民
·论著·
HPLC法测定吉西他滨肉豆蔻酸酯脂质体中主药的含量
罗芳*,李岩*,郭晓茹,汪阿鹏,夏桂民
100050 北京,中国医学科学院北京协和医学院医药生物技术研究所制剂研究室
建立吉西他滨肉豆蔻酸酯脂质体中主药的含量测定方法。
采用 HPLC 法测定脂质体中主药的含量并进行系统的方法学验证。
色谱分离度 R = 2.242,阴性对照无干扰;吉西他滨肉豆蔻酸酯在 5.52 ~ 116 μg/ml 范围内线性关系良好(= 0.9999);低、中、高 3 种浓度的平均回收率分别为 96.8%(RSD = 0.49%,n = 3)、99.7%(RSD = 0.15%,n = 3)和 99.8%(RSD = 0.50%,n = 3);日内精密度 RSD = 0.28%(n = 6),日间精密度 RSD = 0.55%(n = 6);流速在 0.99 ~ 1.01 ml/min 范围内变化时RSD = 1.19%(n = 9),柱温在28 ~ 32 ℃之间变化时 RSD = 0.66%(n = 9)。
建立的方法简便易行、稳定、准确、专属性强、耐用性好,可定量检测吉西他滨肉豆蔻酸酯脂质体中主药的含量。
高效液相色谱; 含量测定; 分析方法验证; 吉西他滨肉豆蔻酸酯; 脂质体
吉西他滨属细胞周期特异性抗代谢类药物,主要作用于 S 期,是一种人工合成的胞嘧啶核苷衍生物[1]。作为一线化疗用药,吉西他滨对多种实体瘤治疗效果显著,尤其是对胰腺癌、非小细胞肺癌和乳腺癌,单一用药或联合其他抗癌药物都能取得很好疗效。
临床常用的剂型为注射用盐酸吉西他滨,但是其在体内容易被胞嘧啶核苷脱氨酶等酶迅速降解(半衰期很短,仅为 8 ~ 17 min),成为无活性的双氟脱氧尿苷(dFdU),因此,吉西他滨若要维持有效的药物浓度就必须大剂量给药[2-3]。美国国家癌症综合网络及欧洲肿瘤协会指南推荐的标准剂量 1000 ~ 1250 mg/m2,且 30 min 内静脉输注完成。持续大剂量给药导致较强毒副作用,如:呼吸困难、脱发、水肿、骨髓抑制、肾毒性、胃肠道反应、流感样反应、过敏反应等[4-5]。
纳米技术的发展为改善药物体内循环时间,增效减毒带来了新希望。本课题组对吉西他滨进行结构改造,设计并合成脂水分配系数适宜的改良型新药吉西他滨肉豆蔻酸酯(dimyristoyl-gemcitabine,dmGEM,图 1),再利用纳米技术、以磷脂为基础赋形剂构建长循环脂质体,规避体内相关酶的降解,延长半衰期,增强疗效,降低毒性,提高患者依从性,其临床意义重大。目前,尚未见吉西他滨肉豆蔻酸酯纳米制剂中主药分析方法的相关报道,因此需要建立吉西他滨肉豆蔻酸酯脂质体中主药的含量测定法,便于吉西他滨肉豆蔻酸酯脂质体的定量分析。

图 1 吉西他滨肉豆蔻酸酯化学结构式(R = C13H17,分子式:C37H63F2N3O6,分子量:683.47)
Figure 1 Chemical structure of dimyristoyl-gemcitabine (R = C13H17,molecular formula: C37H63F2N3O6, molecular weight: 683.47)
本研究建立了简便、专属性强的 HPLC 法,并对该法进行了系统的方法学验证[6-8],证明该法适用于吉西他滨肉豆蔻酸酯脂质体的含量测定。本法对其他吉西他滨酯化物纳米制剂的含量测定也具有参考价值。
1 材料与方法
1.1 材料
LC-20A 高效液相色谱仪和 Inerstil ODS-SP 色谱柱(5 μm,150 mm × 4.6 mm)购自日本岛津公司;R-300 旋转蒸发仪购自瑞士 Buchi 公司;XSE105 分析天平购自瑞士梅特勒公司;KQ-250DB 型数控超声波清洗器购自昆山市超声仪器有限公司;低温光照仪购自药物制剂国家研究中心。
吉西他滨肉豆蔻酸酯脂质体自制,批号2019031405、2019032101、2019032102、2019032103、2019032104、2019032105;吉西他滨肉豆蔻酸酯原料及工作对照品,批号 20190307,99.0%,本所合成室制备;聚乙二醇二硬脂酸磷脂酰乙醇胺(PEG2000-DSPE)和注射级胆固醇购自上海艾韦特医药科技有限公司;色谱纯甲醇购自美国 Fisher Scientific 公司;分析纯二水合磷酸二氢钠购自国药集团化学试剂有限公司;其他试剂也均为色谱纯。
1.2 方法
1.2.1 配制 PBS 缓冲液(pH 2.4 ~ 2.6) 参照中国药典(2015),称取 NaH2PO413.8 g,置于 2000 ml烧杯,加水适量,使之溶解,另量取 H3PO42.5 ml 滴加至上述溶液,再加水稀释至 1000 ml,搅匀。用 H3PO4调节 pH 至 2.53,得 PBS 缓冲液(pH 2.53),0.22 μm 滤膜抽滤,临用前超声脱气 15 min,室温放置备用。
1.2.2 吉西他滨肉豆蔻酸酯对照溶液制备 精密称取吉西他滨肉豆蔻酸酯2.50 mg,置于 50 ml 量瓶中,加入适量甲醇,超声使其完全溶解,再用甲醇稀释至刻度,摇匀,即得 50 μg/ml 吉西他滨肉豆蔻酸酯对照溶液。
1.2.3 供试品溶液及空白对照溶液制备 精密量取 0.1 ml 吉西他滨肉豆蔻酸酯脂质体溶液,置于 2 ml 量瓶中,用甲醇定容至刻度,充分振荡、摇匀,于 4 ℃ 12 000 ×离心 10 min,上清液即为供试品溶液。另精密量取 0.1 ml 空白脂质体,同法操作,得空白对照溶液。
1.2.4 HPLC 法 色谱柱:Inerstil ODS-SP(5 μm,150 mm × 4.6 mm);流动相梯度洗脱详见表 1;流速 1.0 ml/min;检测波长 254 nm;柱温 30 ℃;进样量 20 μl。

表 1 流动相梯度洗脱
1.2.5 系统适用性试验 分别取“1.2.2”和“1.2.3”项下吉西他滨肉豆蔻酸酯对照溶液、供试品溶液及空白对照溶液适量,照“1.2.4”项下色谱条件操作,记录色谱图。
1.2.6 破坏性试验 分别取吉西他滨肉豆蔻酸酯脂质体、空白脂质体、吉西他滨肉豆蔻酸酯对照溶液各 5 份,进行以下破坏试验,再将各待测溶液注入高效液相色谱仪。
1.2.6.1 酸破坏 精密量取 2 ml 吉西他滨肉豆蔻酸酯脂质体,向其中加入 1 mol/L 盐酸溶液0.5 ml,室温下避光放置 0.5 h 后,再按“1.2.3”项下方法操作,得酸破坏供试品溶液。分别精密量取 2 ml 空白脂质体和吉西他滨肉豆蔻酸酯对照溶液,同法操作,得酸破坏空白对照溶液及酸破坏吉西他滨肉豆蔻酸酯对照溶液。
1.2.6.2 碱破坏 精密量取 2 ml 吉西他滨肉豆蔻酸酯脂质体,向其中加入 1 mol/L 氢氧化钠溶液 0.5 ml,立即按“1.2.3”项下方法操作,得碱破坏供试品溶液。分别精密量取 2 ml 空白脂质体和吉西他滨肉豆蔻酸酯对照溶液,同法操作,得碱破坏空白对照溶液及碱破坏吉西他滨肉豆蔻酸酯对照溶液。
1.2.6.3 氧破坏 精密量取 2 ml 吉西他滨肉豆蔻酸酯脂质体,向其中加入3% 过氧化氢溶液0.5 ml,室温下避光放置 3 h 后,再按“1.2.3”项下方法操作,得氧破坏供试品溶液。分别精密量取 2 ml 空白脂质体和吉西他滨肉豆蔻酸酯对照溶液,同法操作,得氧破坏空白对照溶液及氧破坏吉西他滨肉豆蔻酸酯对照溶液。
1.2.6.4 光破坏 精密量取 2 ml 吉西他滨肉豆蔻酸酯脂质体,向其中加入5% 葡萄糖溶液0.5 ml,在低温光照仪[(4500 ± 500)lx]中照射0.5 h 后,再按“1.2.3”项下方法操作,得光破坏供试品溶液。分别精密量取 2 ml 空白脂质体和吉西他滨肉豆蔻酸酯对照溶液,同法操作,得光破坏空白对照溶液及光破坏吉西他滨肉豆蔻酸酯对照溶液。
1.2.6.5 高温破坏 精密量取 2 ml 吉西他滨肉豆蔻酸酯脂质体,向其中加入5% 葡萄糖溶液0.5 ml,在 65 ℃水浴中避光加热 0.5 h 后,再按“1.2.3”项下方法操作,得高温破坏供试品溶液。分别精密量取 2 ml 空白脂质体和吉西他滨肉豆蔻酸酯对照溶液,同法操作,得高温破坏空白对照溶液及高温破坏吉西他滨肉豆蔻酸酯对照溶液。
1.2.7 线性与范围 分别精密称取吉西他滨肉豆蔻酸酯对照品 8 份,用甲醇溶解,得 8 种不同浓度的吉西他滨肉豆蔻酸酯溶液(浓度范围为 5.52 ~ 116 μg/ml)。照“1.2.4”项下条件操作,记录峰面积,以吉西他滨肉豆蔻酸酯峰面积为纵坐标,浓度为横坐标进行线性回归,建立回归方程。
1.2.8 检测限与定量限 精密量取吉西他滨肉豆蔻酸酯脂质体适量,用 5% 葡萄糖溶液递倍稀释,照“1.2.3”项下方法处理样品,照“1.2.4”项下条件操作,进样,并记录峰面积,分别以信噪比为 3:1 和 10:1 时相应的吉西他滨肉豆蔻酸酯的量为检测限和定量限。
1.2.9 重复性试验 取同一吉西他滨肉豆蔻酸酯脂质体 6 份,照“1.2.3”项下方法处理样品,照“1.2.4”项下条件进样,并记录峰面积。
1.2.10 精密度试验 取同一吉西他滨肉豆蔻酸酯脂质体,照“1.2.3”项下方法处理样品,照“1.2.4”项下条件,同 1 天内连续进样 6 次,记录吉西他滨肉豆蔻酸酯峰面积,计算日内精密度 RSD。另取同一份吉西他滨肉豆蔻酸酯脂质体,连续 6 d,每天同法处理并平行连续进样 3 次,计算吉西他滨肉豆蔻酸酯浓度的日间精密度 RSD。
1.2.11 回收率试验 精密称取吉西他滨肉豆蔻酸酯 5.5、5.0、4.5 mg 各 3 份,分别置于 50 ml 量瓶中,加甲醇适量并超声使吉西他滨肉豆蔻酸酯完全溶解,再加空白脂质体溶液 2.5 ml,用甲醇定量至刻度,摇匀,于 4 ℃、12 000 ×离心 10 min,得高、中、低 3 个浓度的供试品溶液。照“1.2.4”项下条件,分别进样,记录峰面积,按外标法求得吉西他滨肉豆蔻酸酯实测值与理论值之比,每个浓度平行测定 3 次,求得平均回收率。
1.2.12 耐用性试验
1.2.12.1 流速变化的影响 将流速分别设置为 0.99、1.00、1.01 ml/min,取同一份供试品溶液,照“1.2.4”项下条件,记录吉西他滨肉豆蔻酸酯保留时间与峰面积并依据外标法求得吉西他滨肉豆蔻酸酯浓度。
1.2.12.2 柱温对系统的影响 将柱温分别设置为 28、30、32 ℃,取同一份供试品溶液,照“1.2.4”项下条件,记录吉西他滨肉豆蔻酸酯保留时间与峰面积并依据外标法求得吉西他滨肉豆蔻酸酯浓度。
1.2.13 含量测定 取 5 批不同批次的吉西他滨肉豆蔻酸酯脂质体,分别照“1.2.3”和“1.2.4”项下的条件和操作,吸取供试液,注入高效液相色谱仪,记录色谱图,并按照外标法计算主药的含量(浓度)。
2 结果
2.1 系统适用性试验
在吉西他滨肉豆蔻酸酯对照溶液及供试品溶液中,吉西他滨肉豆蔻酸酯的保留时间均约15.9 min,分离度为 2.242。同时,空白脂质体对应色谱图中相应保留时间处未见吸收峰(图 2)。上述结果表明在已建立的色谱条件下,吉西他滨肉豆蔻酸酯脂质体的辅料对吉西他滨肉豆蔻酸酯的测定无干扰。
我国为了缓解交通压力,建立了各种桥体,如城市立交桥、高架桥、过街天桥等。城市绿化的相关工作人员可以利用这一条件,在桥身和立柱上设计种植槽和垂挂吊篮。目前,在桥面与桥身上可以设置金银花、牵牛花等植物,在桥柱上则可以配置一些凌霄、爬山虎等攀援植物,这种绿化形式可以在不影响驾驶员驾驶的情况下,起到美化城市和净化空气的作用。
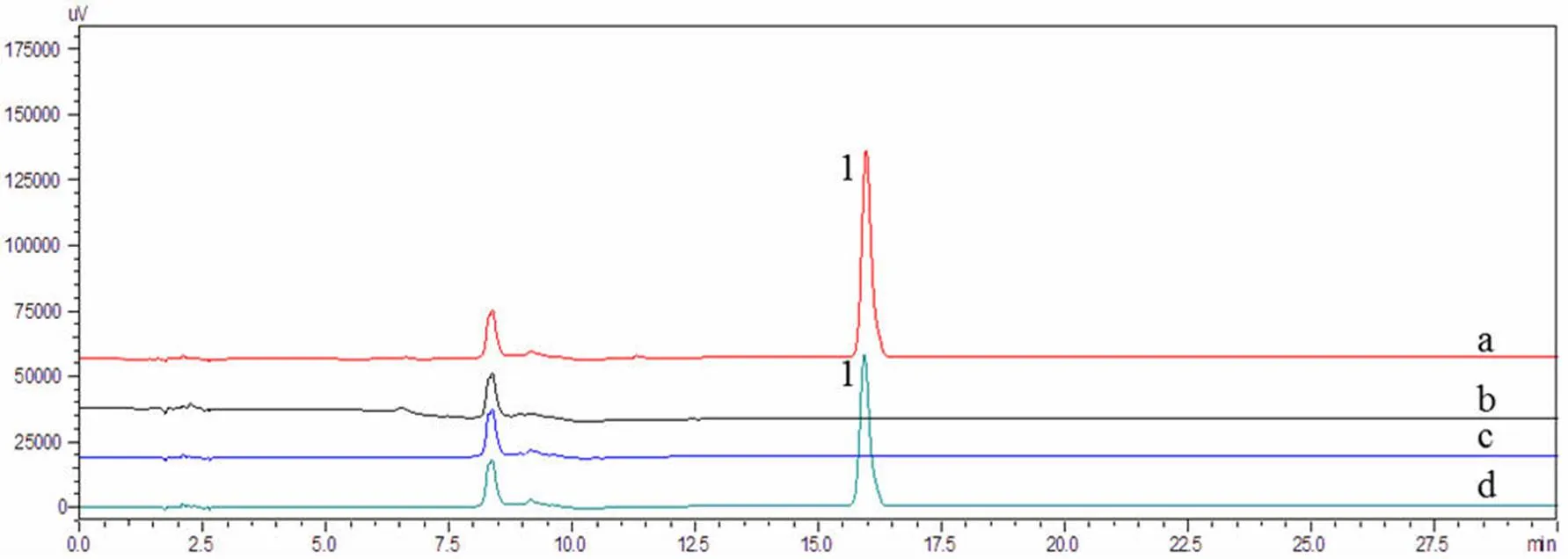
1:吉西他滨肉豆蔻酸酯;a:吉西他滨肉豆蔻酸酯脂质体;b:空白脂质体;c:溶媒;d:吉西他滨肉豆蔻酸酯对照溶液
Figure 2 Chromatograms of system suitability

1:吉西他滨肉豆蔻酸酯;a:空白脂质体;b:吉西他滨肉豆蔻酸酯脂质体;c:吉西他滨肉豆蔻酸酯对照溶液
Figure 3 Typical chromatograms of destructive test [Destruction by acid (A); by base (B); by oxidation(C); by illumination (D); by high temperature (E); nondestruction (F)]
2.2 破坏性试验
分别取各待测溶液,照“1.2.4”项下操作,记录色谱图(图 3)。结果表明,吉西他滨肉豆蔻酸酯色谱峰遇酸、氧、光、高温破坏产生的降解产物色谱峰均能有效分离,说明本方法专属性良好。碱破坏试验组均未检测出吉西他滨肉豆蔻酸酯色谱峰,加入碱后均出现大量气泡,表明其对碱极不稳定。
2.3 线性与范围
以吉西他滨肉豆蔻酸酯峰面积为纵坐标,浓度为横坐标进行线性回归,得回归方程:= 14721– 11435,= 0.9999,结果见表 2 和图 4。
2.4 检测限与定量限
经检测,吉西他滨肉豆蔻酸酯的检测限为2.0 ng(S/N = 3),定量限为 8.4 ng(S/N = 10)。结果见图 5 和图 6。
2.5 重复性试验
取同一吉西他滨肉豆蔻酸酯脂质体 6 份,经统计,吉西他滨肉豆蔻酸酯浓度的 RSD = 0.74%(n = 6)(表 3)。

表 2 线性与范围

图 4 线性与范围
Figure 4 Linear and range

图 5 检测限色谱图
Figure 5 Limit of detection chromatogram
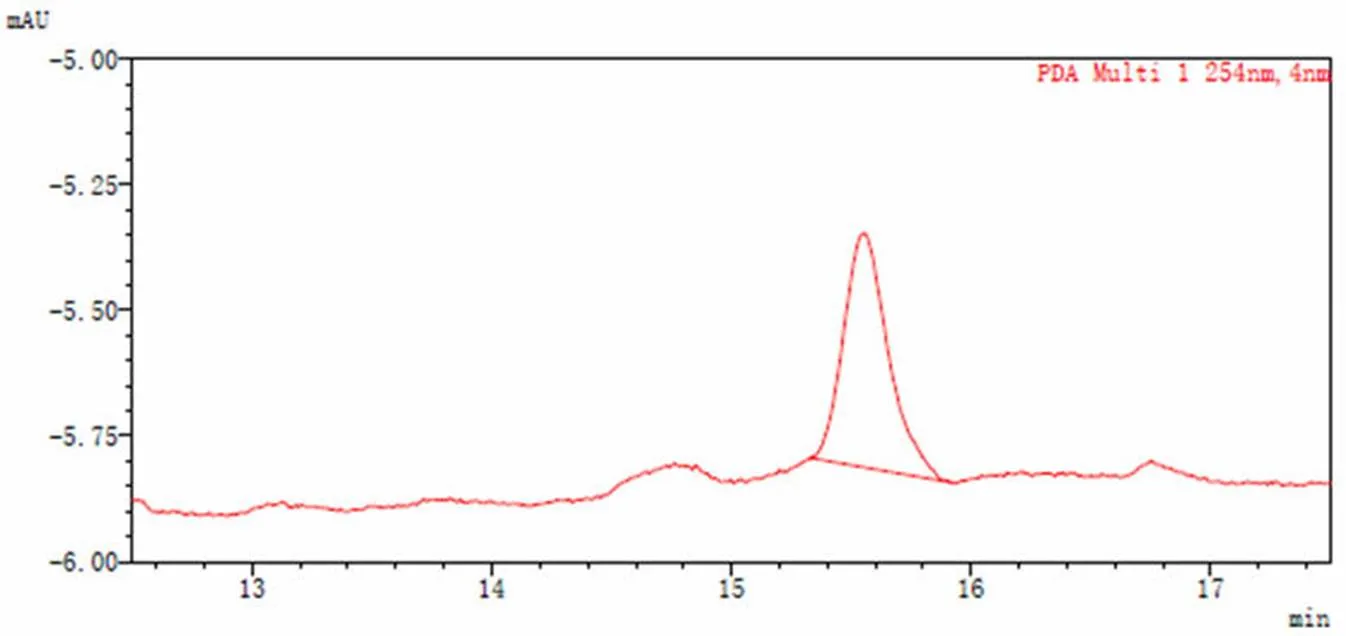
图 6 定量限色谱图
Figure 6 Limit of quantification chromatogram
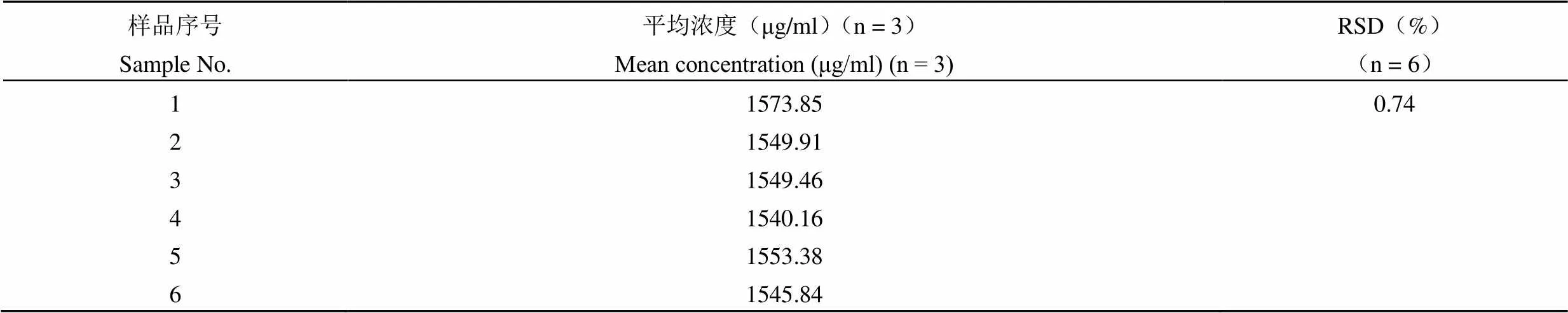
表 3 重复性试验
2.6 精密度试验
统计得吉西他滨肉豆蔻酸酯浓度的日内精密度 RSD 为 0.28%(n = 6),吉西他滨肉豆蔻酸酯浓度的日间精密度 RSD 为 0.55%(n = 6)(表4 和表 5)。
2.7 回收率试验
统计求得高、中、低 3 个加样平均回收率为 96.8%(RSD = 0.49%,n = 3)、99.7%(RSD = 0.15%,n = 3)和 99.8%(RSD = 0.50%,n = 3)(表 6)。
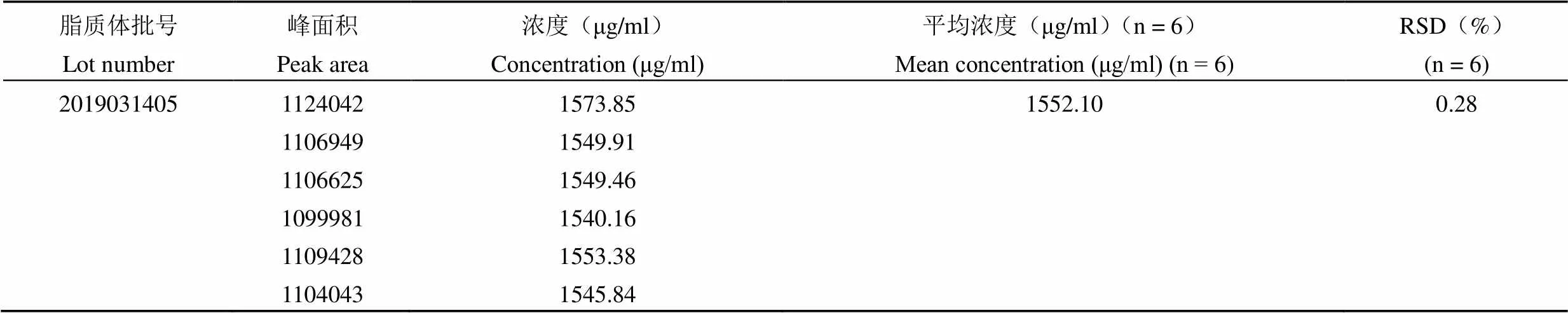
表 4 日内精密度
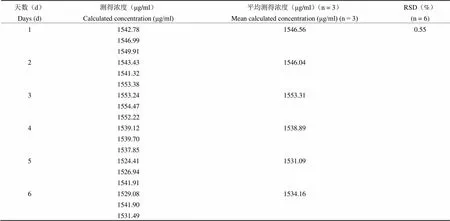
表 5 日间精密度

表 6 回收率试验结果统计
2.8 耐用性试验
流速在 0.99 ~ 1.01 ml/min 范围内变化时,吉西他滨肉豆蔻酸酯浓度的 RSD 为 1.19%(n = 9)(表 7),说明该方法的耐用性良好。柱温在 28 ~ 32 ℃之间变化时吉西他滨肉豆蔻酸酯浓度的 RSD 为 0.66%(n = 9)(表 7),说明柱温在 28 ~32 ℃之间变化时对吉西他滨肉豆蔻酸酯含量测定结果的影响在可接受范围内。
2.9 含量测定
5 批脂质体含量测定结果见表 8。

表 7 耐用性试验结果统计

表 8 五批吉西他滨肉豆蔻酸酯脂质体含量测定结果
3 讨论
3.1 样品提取方法及脂质体破乳剂用量倍数的选择
脂质体中主药的含量需采用适当的方法破坏脂质体双分子层,使药物释放出来,再用 HPLC 法测定其含量。用有机溶剂破乳是目前常用的破坏脂质体双分子层的方法。吉西他滨肉豆蔻酸酯在非极性溶剂(如甲醇)中具有较好的溶解性,同时甲醇也为 HPLC 法中常用的有机相,因此本实验选择甲醇作为溶剂,破乳的同时,也能将主药充分溶解提取,便于后续的含量测定。
脂质体破乳完全与否对准确测定脂质体中主药的含量至关重要。破乳时有机溶剂加入倍数太低可能导致脂质体破坏不完全,药物提取不充分,测得含量偏低;有机溶剂加入倍数太高可能会导致主药被过量稀释,测得含量不准确,因此需要选择合适的破乳剂用量(倍数)。在实验中我们设计了 5、10、20、30、40、50和 60 倍的破乳倍数,当破乳 20 倍时,继续增加破乳倍数,测得含量不再增加且药物收率大于 99%,表明破乳剂用量 20 倍时,能破乳完全且能将主药充分溶解并提取,且又能准确定量检测。因此,我们将最佳破乳剂用量倍数确定为 20。
3.2 药物稳定性的影响因素
在本文的专属性实验过程中发现,吉西他滨肉豆蔻酸酯在酸、光和高温下不稳定,而吉西他滨肉豆蔻酸酯脂质体在酸、光和高温下较稳定,表明脂质体对药物的包封包载能够保护药物免于某些条件的降解破坏,体现了脂质体具有稳定药物的优点。同时,在建立的色谱条件下,主药色谱峰与破坏产生的降解产物色谱峰均能有效分离,说明本方法专属性良好。
本研究建立 HPLC 法用于吉西他滨肉豆蔻酸酯脂质体中吉西他滨肉豆蔻酸酯含量的测定,通过系统的方法学研究与验证,认为本方法操作简便、专属性好、准确度高,适合于吉西他滨肉豆蔻酸酯脂质体中主药的含量测定。本方法对其他吉西他滨酯化物纳米制剂的含量测定具有参考价值。
[1] Dubey RD, Saneja A, Gupta PK, et al. Recent advances in drug delivery strategies for improved therapeutic efficacy of gemcitabine. Eur J Pharm Sci, 2016, 93:147-162.
[2] Wang G, Chen H, Zhao D, et al. Combination of L-carnitine with lipophilic linkage-donating gemcitabine derivatives as intestinal novel organic cation transporter 2-targeting oral prodrugs. J Med Chem, 2017, 60(6):2552-2561.
[3] Li T, Chen L, Deng Y, et al. Cholesterol derivative-based liposomes for gemcitabine delivery: preparation, in vitro, and in vivo characterization. Drug Dev Ind Pharm, 2017, 43(12):2016-2025.
[4] Zhang YS, Tian L, Chen TZ. Application of gemcitabine in various tumors. Chongqing Med, 2018, 47(20):2724-2728. (in Chinese)
张云嵩, 田莉, 陈田子. 吉西他滨在多种肿瘤中的应用. 重庆医学, 2018, 47(20):2724-2728.
[5] Luo F, Wang D, Xia GM. Research advances of anticancer drug gemcitabine nano-delivery system. Chin Med Biotechnol, 2019, 14(1): 83-88. (in Chinese)
罗芳, 王丹, 夏桂民. 抗癌药物吉西他滨纳米递送系统的研究进展. 中国医药生物技术, 2019, 14(1):83-88.
[6] International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use. ICH Q2(R1) - Validation of analytical procedures: text and methodology. ICH: 1995.
[7] Moein MM, El Beqqali A, Abdel-Rehim M. Bioanalytical method development and validation: Critical concepts and strategies. J Chromatogr B Analyt Technol Biomed Life Sci, 2017, 1043:3-11.
[8] Shabir GA, Lough WJ, Arain SA, et al. Evaluation and application of best practice in analytical method validation.J Liquid Chromatography Relat Technol, 2007, 30(3):311-333.
Determination of the principal agent in dimyristoyl-gemcitabine liposomes by HPLC
LUO Fang, LI Yan, GUO Xiao-ru, WANG A-peng, XIA Gui-min
Pharmaceutics Department, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
To establish an HPLC method for the quantification of the principal agent in dimyristoyl-gemcitabine liposomes.
HPLC method was used to determine the content of the principal agent in liposomes and systematic methodological verification was performed.
The method was validated: with a resolution of 2.242; linear, in the range of 5.52 - 116 μg/ml (= 0.9999) and accurate, with the average recovery rate of 96.8% (RSD = 0.49%, n = 3), 99.7% (RSD = 0.15%, n = 3) and 99.8% (RSD = 0.50%, n = 3) at low, medium and high concentrations; precision, intra-day and inter-day precision reflected by the relative standard deviation (RSD) values of 0.28% (n = 6) and 0.55% (n = 6) respectively, robust under slight changes of flow rate (0.99 - 1.01 ml/min) and column temperature (28 - 32 ℃) with RSD of 1.19% (n = 9) and 0.66% (n = 9), respectively.
A simple, selective, sensitive and robust HPLC method has been established for the determination of the principal agent in dimyristoyl-gemcitabine liposomes.
HPLC; Determination; Validation; Dimyristoyl-gemcitabine; Liposome
XIA Gui-min, Email: xiaguimin@126.com
10.3969/j.issn.1673-713X.2020.02.010
国家重点研发计划(2016YFA0201504);国家自然科学基金(81673383、81603063);中国医学科学院医学与健康科技创新工程(2016-12M-3-013)
夏桂民,Email:xiaguimin@126.com
2019-11-14
*同为第一作者

